多孔氢键金属-有机框架材料对乙炔和二氧化碳的吸附分离
谢丹妍,邢华斌,张治国,杨启炜,杨亦文,任其龙,鲍宗必
(浙江大学化学工程与生物工程学院,生物质化工教育部重点实验室,浙江 杭州 310029)
多孔氢键金属-有机框架材料对乙炔和二氧化碳的吸附分离
谢丹妍,邢华斌,张治国,杨启炜,杨亦文,任其龙,鲍宗必
(浙江大学化学工程与生物工程学院,生物质化工教育部重点实验室,浙江 杭州 310029)
以腺嘌呤和溴化铜(氯化铜)为原料,采用慢扩散合成法,合成多孔氢键金属-有机框架材料 MPM-1-Br和MPM-1-Cl。采用SEM、PXRD、TGA及比表面积分析等技术对材料进行综合表征,并测定了此二种同构多孔氢键金属-有机框架材料对乙炔和二氧化碳单组分气体的吸附等温线。实验结果表明,MPM-1-Br和MPM-1-Cl的比表面积分别为373 m2·g−1和 417 m2·g−1,且在<240℃的温度范围内有良好的稳定性;在298 K和总压100 kPa下,通过IAST理论计算得到其对C2H2/CO2混合气体(体积比50:50)的吸附选择性分别达到了3.8和3.0,与HKUST-1(4.7)和UTSA-30(3.3)等金属-有机框架材料有相当的分离性能。
氢键金属-有机框架材料;慢扩散合成法;吸附;分离;乙炔;二氧化碳
引 言
乙炔(C2H2)是石油化工和电子工业生产中重要原料之一,同时也是金属加工中氧乙炔切割必不可缺的原料[1]。工业上一般通过烃类热裂解得到粗制乙炔,粗制乙炔中含有大量的反应副产物,其中就包括了二氧化碳(CO2)[2]。C2H2和CO2的分离异常困难,因为这两种线性气体分子拥有相似的三维尺寸(0.332 nm×0.334 nm×0.570 nm和3.19 nm× 3.34 nm×5.36 nm)以及沸点(−84℃和−78.5℃),传统材料分子筛和活性碳对二者的吸附量几乎相同,难以实现有效分离。此外,C2H2还是一种高反应活性的气体,在室温无氧状态下,压缩压力大于0.2 MPa即会发生爆炸,而传统工业采用低温蒸馏对其进行分离,不仅危险,还需耗费大量的能量[3-6]。
由于能耗低和过程简单等优点,基于多孔材料的吸附分离技术正在逐步替代传统的氨净化和低温精馏技术[7-8]。近二十年来,金属有机框架材料(metal-organic frameworks, MOFs)和共价有机框架材料 (covalent-organic frameworks, COFs)等大量新型多孔材料问世,这类材料由于规整的孔结构及较大的比表面积等特点,对气体的吸附容量和选择性超越了传统分子筛材料[9-11]。此外,这类材料的最大特点是具有可设计性,可通过引入不同结构的配体从而改变孔道大小[12]或在孔道表面构筑金属不饱和配位位点[13-15]、Lewis酸及碱位点等[16-17],以此来增强或减小特定气体分子与材料的相互作用,从而达到选择性识别气体分子的目的。
MOFs和COFs通过配位或共价键连接结构单元进行自组装,而氢键有机框架材料(hydrogen-bonded organic frameworks, HOFs)则是利用氢键作用来构建骨架,由于其具有易于纯化、再生和重结晶等优点,近年来逐渐引起了人们的注意[18-28]。但与MOFs和COFs这些拥有较强的配位键或共价键的材料相比,HOFs结构中的氢键作用显得较为脆弱,因此其结构的稳定性往往较差,不少 HOFs在失去溶剂或高温的情况下结构就会崩塌,这严重影响它们的工业应用价值。据作者所知,目前仅HOF-3被应用于C2H2/CO2气体分离。欲提高HOFs的孔结构稳定性,其中一个策略便是将金属-有机配合物作为构筑单元通过氢键网络构建多孔的HOFs材料[29-32],如Zaworotko课题组报道的MPM-1-TIFSIX材料,因其引入了金属-有机配位单元,使得其结构结合了MOFs和HOFs的优点。鉴于Br−和Cl−为良好的氢键碱性受体,乙炔具有酸性的氢原子,可与之形成氢键[33-35],而二氧化碳则缺乏潜在的氢键作用。基于上述思路,本文在Zaworotko等的工作基础上,合成了多孔氢键金属有机金属框架材料 MPM-1-Br[30]和 MPM-1-Cl(结构如图1所示),将其应用于乙炔和二氧化碳的吸附分离。
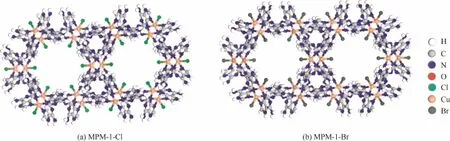
图1 MPM-1-Cl 和MPM-1-Br材料在c轴方向的网络结构图Fig.1 Views of networks along c axis of MPM-1-Cl and MPM-1-Br
1 实验部分
1.1 材料与仪器
腺嘌呤、溴化铜、氯化铜,含量大于99%,上海晶纯生化科技股份有限公司(阿拉丁试剂);无水甲醇、异丙醇,分析级,国药集团化学试剂有限公司。实验用水为去离子水。实验药品直接用于样品合成,未做任何纯化处理。
1.2 合成方法
(1)MPM-1-Br([Cu2(μ-adenine)4Br2]Br2·2MeOH)的制备:以腺嘌呤和溴化铜为原料,通过慢扩散合成法在室温下合成 MPM-1-Br。将腺嘌呤 11.1 mg(0.08 mmol)溶于12 ml甲醇中,将溴化铜8.8 mg(0.04 mmol)溶于12 ml 异丙醇中。将腺嘌呤的甲醇溶液加入试管中,然后缓慢滴加溴化铜的异丙醇溶液,使其覆盖在甲醇溶液上方,在室温条件下静置反应一周。将初合成的材料用甲醇洗涤2~3次并静置溶剂置换3 d(8小时/次),得到约6 mg样品。
由图5可以看出以目前工区所有采用板墙厚度可以满足集中拉底后的充填需要,如局部拉底高度过高,例如25#进路、26#进路和29#进路拉底较高的进路,可以考虑板墙砌筑厚度由400 mm增加到800 mm,防止由于进路高度增加进路内充填料浆体积增大对板墙的压力增大,造成板墙倒塌[3],影响工区正常生产。
(2)MPM-1-Cl([Cu2(μ-adenine)4Cl2]Cl2·2MeOH)的制备:同样采用慢扩散法,以腺嘌呤和氯化铜为原料在室温下合成MPM-1-Cl。将27 mg(0.2 mmol)腺嘌呤溶于40 ml甲醇中,将氯化铜13 mg(0.096 mmol)溶于15 ml 异丙醇中。将腺嘌呤的甲醇溶液加入试管中,然后缓慢滴加氯化铜的异丙醇溶液,使其覆盖在甲醇溶液上方,在室温条件下静置反应一周。将初合成的材料用甲醇洗涤2~3次并静置溶剂置换3 d(8小时/次),得到约12 mg样品。
1.3 结构表征
采用德国Bruker公司 D8 Advance θ/θ 型X射线衍射仪对样品的晶体结构、结晶度等进行了表征,激发光源为CuKα射线(λ=0.1542 nm),管电压 40 kV,管电流 40 mA,扫描范围 2θ=5°~40°,扫描速率 10.16 (°)·min−1,步长 0.0167°;采用荷兰FEI公司 SIRION-100型的仪器进行扫描电子显微镜(SEM)观测形貌,分析前样品在室温干燥后进行喷金处理;同时也采用Olympus公司CX22型生物显微镜观察样品的形貌;采用美国Micromeritics公司的快速比表面积及孔结构分析仪 ASAP 2050对样品的比表面积及孔径分布进行测定,在吸附测试之前,吸附剂需要在 25℃下高真空脱气处理 24 h进行活化,比表面积由196 K下的 CO2吸附等温线采用BET(Brunauer-Emmett-Teller)比表面积计算模型计算得到,孔径分布采用 HK(Horvath-Kawazoe)模型进行计算;采用美国Perkingnelmer公司Pyris 1 TGA型热重分析仪对样品的热稳定性进行表征(TGA),热分解在N2氛围中进行,温度范围为50~800℃。
1.4 吸附与分离性能测试
二氧化碳和乙炔的纯组分吸附等温线在美国Micromeritics公司的快速比表面积及孔结构分析仪ASAP 2050上进行。吸附等温线的气压范围选择为0~108 kPa;选择273、298和308 K 3个温度,由外置循环水浴精确控制,控制精度为 0.01℃;样品量约100 mg。使用高纯气体包括:氦气(99.999%),乙炔(>99%),二氧化碳(99.99%),氮气(99.99%)。经无水甲醇溶剂交换的MPM-1-Br和MPM-1-Cl在298 K下真空(< 0.789 Pa)活化24 h后进行气体吸附实验。
用双位点 Langmuir-Freundlich 等温线模型对纯气体组分气体吸附等温线进行拟合
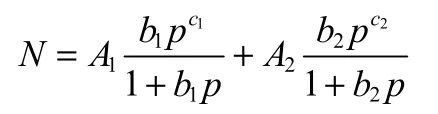
式中,N表示某气体组分的摩尔吸附量,mol·kg−1;A1表示位点1的饱和吸附量,mol·kg−1;b1表示某气体组分在吸附位点 1上的双位点Langmuir-Freundlich 常数,kPa−c1;A2表示位点 2的饱和吸附量,mol·kg−1;b2表示某气体组分在吸附位点 2上的双位点 Langmuir-Freundlich 常数,kPa−c2;c表示双位点Langmuir-Freundlich 等温线指数;p为混合气体中某组分的分压,kPa。

图2 MPM-1-Br 和MPM-1-Cl的模拟、刚合成及活化PXRD谱图Fig.2 PXRD patterns of calculated, as-syntheszed and activated MPM-1-Br and MPM-1-Cl
2 实验结果与讨论
2.1 材料表征
2.1.2 SEM 和显微镜表征 MPM-1-Br和MPM-1-Cl的扫描电子显微镜图片和显微镜图片如图3所示。从图中可以看出,MPM-1-Br和MPM-1-Cl晶体长度约为100 μm,宽度约为20 μm。由于晶体较长,在纯化过程中易折断和磨损,扫描电子显微镜图片中晶体多为晶体的一部分,但仍能找到完整的晶体,且都呈蓝色梭状形貌,如图3(c)、(d)所示。
2.1.3 比表面积分析 MPM-1-Br和MPM-1-Cl在77 K条件下对N2均无吸附,这一现象也存在一些微孔MOFs和HOFs中[36-37],目前机理仍不清楚,可能与在77 K下N2分子与孔道口有强相互作用,阻碍了气体分子进入孔道有关[31]。如图4所示,在196 K 下两种材料对 CO2的吸附等温线显示MPM-1-Br和MPM-1-Cl均是多孔材料且BET比表面积分别为417 m2·g−1和373 m2·g−1;同时,两者的孔径均为0.85左右,前者略大于后者,与二者为同构材料的事实相符。

图3 MPM-1-Br 和MPM-1-Cl SEM图片和显微镜图片Fig.3 SEM images and microscope pictures of MPM-1-Br and MPM-1-Cl
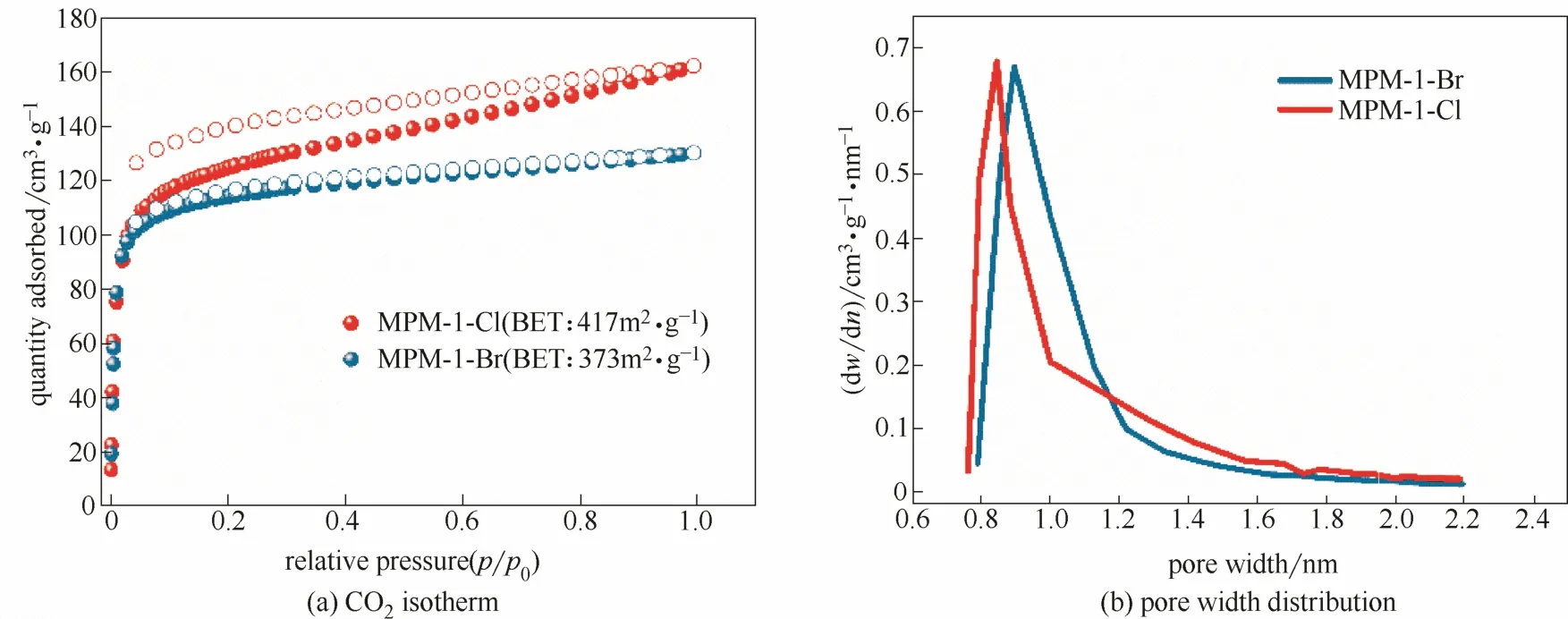
图4 MPM-1-Br 和MPM-1-Cl 在196 K下的CO2吸附等温线和孔径分布图Fig.4 CO2isotherm collected at 196 K and pore width distribution of MPM-1-Br and MPM-1-Cl
2.1.4 热重分析 图5为MPM-1-Br和MPM-1-Cl的热重分析曲线。由图可以看出,50~138℃失去了两个甲醇分子;温度大于240℃时4个腺嘌呤分子开始升华分解;大约800℃,剩下固体为CuO。从图上可以看出,温度低于 240℃时,两材料的质量变化速率均为 0,表明处于稳定的状态,即MPM-1-Br和MPM-1-Cl均具有热稳定性。
2.2 气体吸附实验
MPM-1-Br和MPM-1-Cl均具有较高的比表面积,属于多孔材料。同时,Br−和Cl−均匀分布在孔道中,作者对这两种材料的气体吸附性能产生了浓厚的兴趣,特别是工业上分离难度较大的C2H2/CO2气体组分。
图6(a)、(b)分别为MPM-1-Br和MPM-1-Cl在273、298和308 K下的吸附等温线。以298 K为例,MPM-1-Br在100 kPa处对C2H2和CO2的吸附量分别为2.85 mmol·g−1和1.57 mmol·g−1;而MPM-1-Cl在100 kPa处对C2H2和CO2的吸附量分别为2.78 mmol·g−1和1.74 mmol·g−1这两种材料的一维孔道直径都比C2H2分子和CO2分子的直径大,两种材料对C2H2和CO2的吸附量存在差异的原因可能与MPM-1-Br和MPM-1-Cl一维孔道上表面分布有Br−和Cl−有关,Br−和Cl−为良好的氢键碱性受体,而乙炔具有酸性的氢原子,可与之形成氢键作用,而二氧化碳则不能与之形成氢键,从而导致两种材料对 C2H2的吸附量均明显大于对 CO2的吸附量。
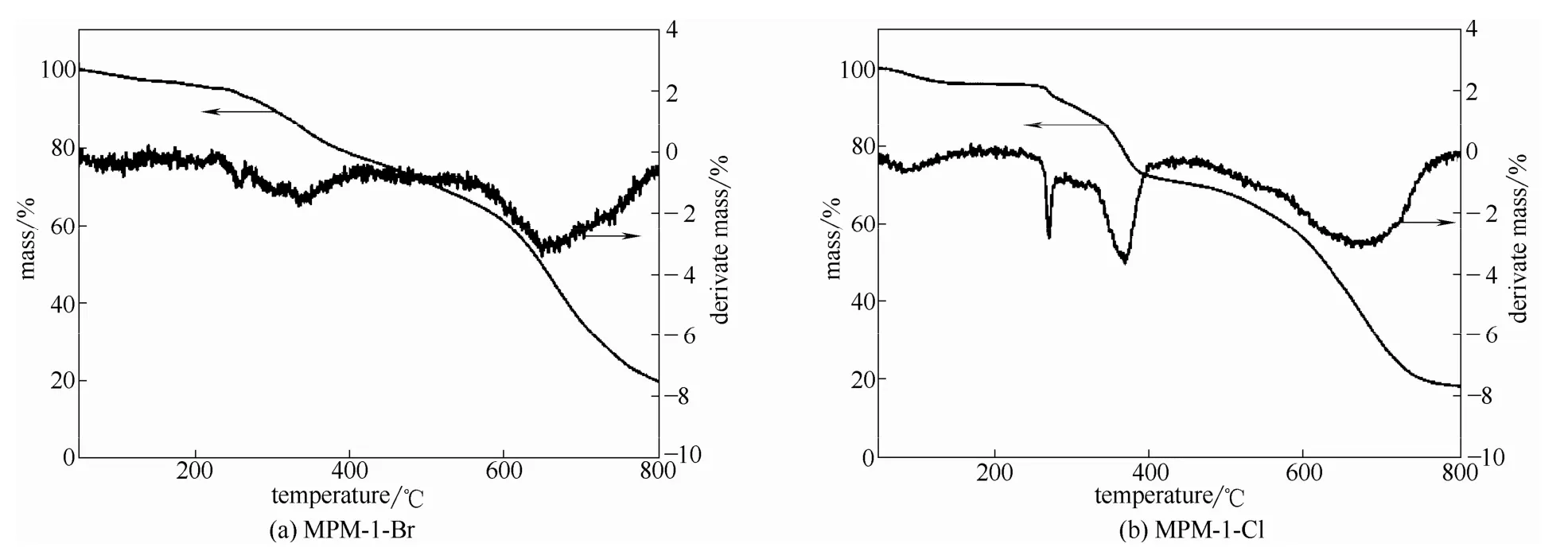
图5 MPM-1-Br和MPM-1-Cl的TGA曲线Fig.5 TGA curves of MPM-1-Br and MPM-1-Cl

图6 MPM-1-Br 和MPM-1-Cl 在273、298和308 K下对C2H2和CO2吸附等温线Fig.6 C2H2and CO2isotherms collected at 273 K, 298 K and 308 K of MPM-1-Br and MPM-1-Cl(1 mmHg=133.3 Pa)
为了探究材料对C2H2/CO2的吸附选择性,选用273 K 和 298 K 下的吸附等温线,用双位点Langmuir-Freundlich 等温线模型对纯气体组分气体吸附等温线进行拟合,拟合参数根据理想溶液吸附理论(IAST)计算材料对二元 C2H2/CO2混合气体(体积比50:50)的吸附选择性,拟合结果见表1。图7(a)为MPM-1-Br和MPM-1-Cl与其他4种多孔材料对C2H2/CO2混合气体的吸附选择性比较。由图可以看出,在298 K、总压为100 kPa的情况下,MPM-1-Br和MPM-1-Cl对C2H2/CO2的吸附选择性分别达到了 3.8和 3.0,与 HKUST-1a(4.7)和UTSA-30a(3.3)[16]有相当的分离性能。
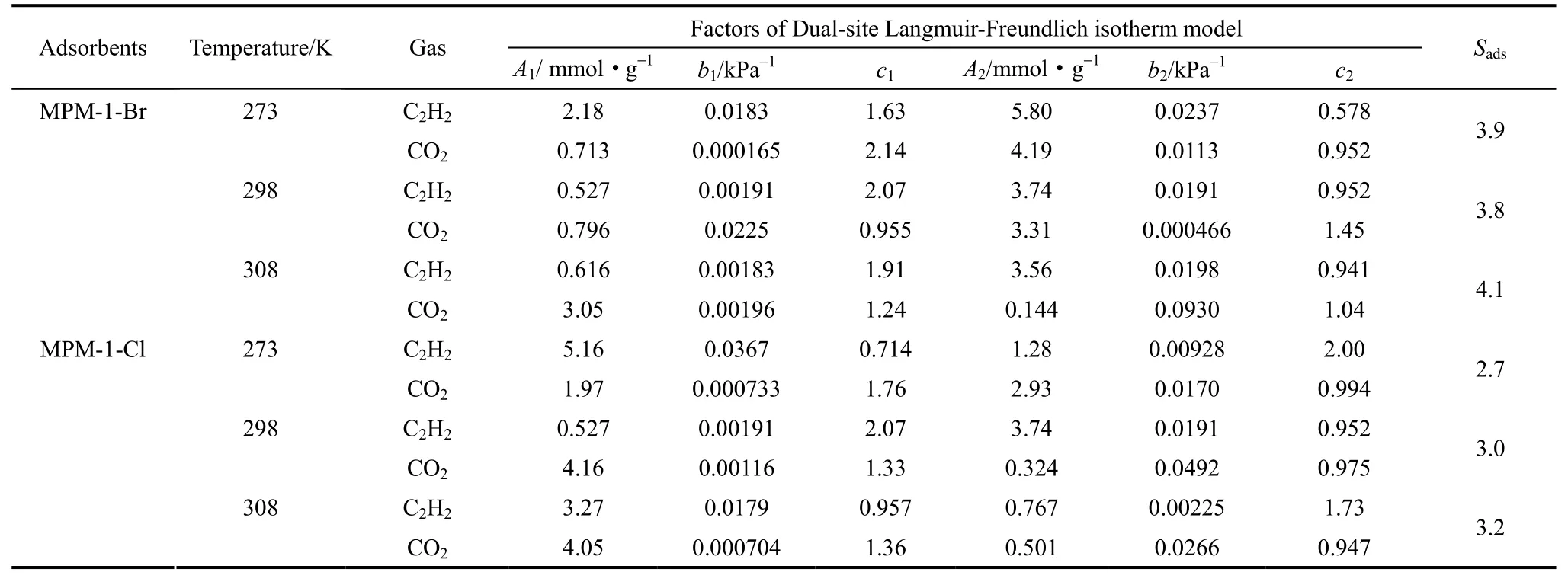
表1 C2H2和CO2在MPM-1-Br和MPM-1-Cl材料上的双位点Langmuir-Freundlich吸附等温线参数及对50:50 C2H2/CO2的吸附分离选择性系数Table 1 Parameters of Dual-site Langmuir-Freundlich model for adsorption isotherms of C2H2and CO2, and selectivity (Sads) for binary mixture of C2H2/CO2(50/50) on MPM-1-Br and MPM-1-Cl
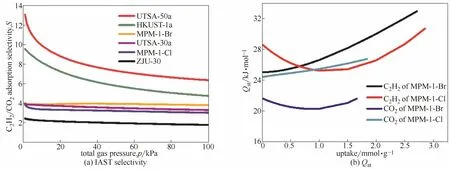
图7 MPM-1-Br、MPM-1-Cl在298 K下与4种多孔材材料对50:50 C2H2/CO2混合气体的IAST吸附选择性比较及其对C2H2和CO2的等量吸附热Fig.7 IAST selectivity for 50:50 C2H2/CO2binary mixtures, and Qston C2H2and CO2of MPM-1-Br, MPM-1-Cl and other four materials at 298 K
为了研究结合能,利用维里方程(Virial equation)分别计算 C2H2和 CO2对 MPM-1-Br和MPM-1-Cl的等量吸附热,结果如图7(b)所示。C2H2和CO2对MPM-1-Br和MPM-1-Cl的初始等量吸附热分别为33、22、31和27 kJ·mol−1,均处在正常的等量吸附热范围内。表2为MPM-1-Br、MPM-1-Cl与其他4种吸附剂C2H2和CO2的吸附量、初始等量吸附热及其对 C2H2/CO2(50:50)的吸附选择性的比较[7,38-41]。从表中可以看出,C2H2和CO2的等量吸附热的差异可以部分反映吸附选择性,即 C2H2和CO2的等量吸附热的差异越大,对应的吸附选择性更大。从图中可以看出,MPM-1-Br对 C2H2和CO2的等量吸附热的差异较MPM-1-Cl的大,这一现象也可进一步说明MPM-1-Br对C2H2/CO2的吸附选择性比MPM-1-Cl大的原因。从图中还可以看出,MPM-1-Br和MPM-1-Cl对C2H2的结合能相当,而MPM-1-Cl对CO2的结合能比MPM-1-Br要大,可能与CO2和Cl−有更强的静电相互作用有关[42-45],因而在每个温度下MPM-1-Cl对CO2的吸附量都比MPM-1-Br的大,最终表现为 MPM-1-Br对C2H2/CO2的吸附选择性大于MPM-1-Cl。

表2 6种吸附剂C2H2和CO2的吸附量、初始等量吸附热Qst及其对C2H2/CO2(50:50)的吸附选择性Table 2 Uptakes and initial values of Qston C2H2and CO2of six adsorbents and their adsorbed selectivity (Sads) of 50:50 C2H2/CO2
考虑吸附剂的循环使用,在同一批材料上重复实验,以及不同温度和不同气体的实验。实验证明材料可重复使用。与此同时,吸附等温线与脱附等温线基本重合,如图8所示,说明吸附剂具有良好的脱附性能,有利于工业循环利用。
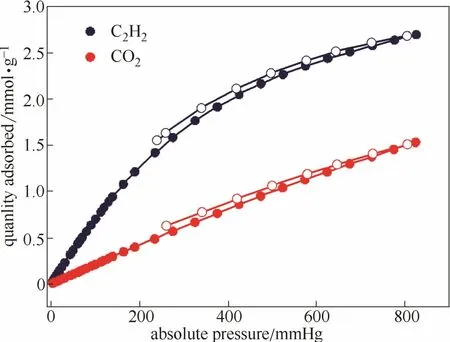
图8 MPM-1-Cl在308K下的C2H2和CO2吸附脱附等温线Fig.8 C2H2and CO2adsorption and desorption isotherm collected at 308 K of MPM-1-Cl
3 结 论
(1)通过慢扩散反应法,制备了两种多孔氢键金属-有机框架材料MPM-1-Br和MPM-1-Cl,通过XRD、SEM和显微镜观察等手段确认了材料结构;BET比表面积分析表明MPM-1-Br和MPM-1-Cl为多孔材料;TGA结果表面此二种材料有较好的热稳定性。
(2)由单组分吸附等温线结果表明,MPM-1-Br和MPM-1-Cl对乙炔和二氧化碳的理想吸附热分别为33、22、31和27 kJ·mol−1。乙炔的较大吸附热与其能与材料形成更强的氢键作用有关。基于IAST理论计算得到的298 K、100 kPa总压下的混合气体(体积比 50:50)的吸附分离选择性分别为 3.8和3.0,表明MPM-1-Br和 MPM-1-Cl可作为潜在的C2H2/CO2气体分离材料。
符 号 说 明
A1——位点1的饱和吸附量,mol·kg−1
A2——位点2的饱和吸附量,mol·kg−1
b1——某气体组分在吸附位点 1上的双位点Langmuir-Freundlich 常数,kPa−c1
b2——某气体组分在吸附位点 2上的双位点Langmuir-Freundlich 常数,kPa−c2
c——双位点Langmuir-Freundlich 等温线指数
Ni——气体组分i的摩尔负载量,mol·kg−1
pi——混合气体中组分i的分压,kPa
Qst——等量吸附热,kJ·mol−1
Sads——吸附选择性
[1]ZHAO X, XING H, YANG Q, et al. Differential solubility of ethylene and acetylene in room-temperature ionic liquids: a theoretical study[J]. J. Phys. Chem. B, 2012, 116(13): 3944-53.
[2]EGUCHI R, UCHIDA S, MIZUNO N. Inverse and high CO2/C2H2sorption selectivity in flexible organic-inorganic ionic crystals[J]. Angewandte Chemie International Edition, 2012, 51(7): 1635-1639.
[3]LI P, HE Y, ZHAO Y, et al. A rod-packing microporous hydrogen-bonded organic framework for highly selective separation of C2H2/CO2at room temperature[J]. Angewandte Chemie International Edition, 2015, 54(2): 574-577.
[4]RAO X, CAI J, YU J, et al. A microporous metal-organic framework with both open metal and Lewis basic pyridyl sites for high C2H2and CH4storage at room temperature[J]. Chemical Communications, 2013, 49(60): 6719-6721.
[5]DUAN J, JIN W, KRISHNA R. Natural gas purification using a porous coordination polymer with water and chemical stability[J]. Inorganic Chemistry, 2015, 54(9): 4279-4284.
[6]YOON J W, LEE J S, LEE S, et al. Adsorptive separation of acetylene from light hydrocarbons by mesoporous iron trimesate MIL-100 (Fe)[J]. Chemistry-A European Journal, 2015, 21(50): 18431-18438.
[7]CHANG G, LI B, WANG H, et al. Control of interpenetration in a microporous metal-organic framework for significantly enhancedC2H2/CO2separation at room temperature[J]. Chemical Communications, 2016, 52(17): 3494-3496.
[8]DAVIS M E. Ordered porous materials for emerging applications[J]. Nature, 2002, 417(6891): 813-821.
[9]ZHANG Z, ZHAO Y, GONG Q, et al. MOFs for CO2capture and separation from flue gas mixtures: the effect of multifunctional sites on their adsorption capacity and selectivity[J]. Chemical Communications, 2013, 49(7): 653-661.
[10]HE Y, ZHOU W, QIAN G, et al. Methane storage in metal-organic frameworks[J]. Chemical Society Reviews, 2014, 43(16): 5657-5678.
[11]FURUKAWA H, CORDOWA K E, O'KEEFFE M, et al. The chemistry and applications of metal-organic frameworks[J]. Science, 2013, 341(6149): 1230444.
[12]李亮莎, 王可可, 黄宏亮, 等. 高稳定铪金属-有机骨架材料的合成及二氧化碳捕获性能[J]. 化工学报, 2014, 65(5): 1706-1715. LI L S, WANG K K, HUANG H L, et al. Synthesis of exceptional stable Hf-based metal-organic frameworks:characterization, stability and CO2adsorption performance[J]. CIESC Journal, 2014, 65(5): 1706-1715.
[13]LI J R, KUPPLER R J, ZHOU H C. Selective gas adsorption and separation in metal-organic frameworks[J]. Chemical Society Reviews, 2009, 38(5): 1477-1504.
[14]CHUI S S Y, LO S M F, CHARMANT J P H, et al. A chemically functionalizable nanoporous material [Cu3(TMA)2(H2O)3]n[J]. Science, 1999, 283(5405): 1148-1150.
[15]乔智威, 杨仁党, 王海辉, 等. 面向生物甲烷分离的不同金属配位金属-有机骨架材料的分子设计[J]. 化工学报, 2014, 65(5): 1729-1735. QIAO Z W, YANG R D, WANG H H, et al. Molecular design of metal-organic frameworks with different metal ligands for bio-methane separation[J]. CIESC Journal, 2014, 65(5): 1729-1735.
[16]HE Y, KRISHNA R, CHEN B. Metal-organic frameworks with potential for energy-efficient adsorptive separation of light hydrocarbons[J]. Energy & Environmental Science, 2012, 5(10): 9107-9120.
[17]杨宵, 刘晶, 胡建波. 氢气在共价有机骨架材料中的吸附机理[J].化工学报, 2015, 66(7): 2540-2546. YANG X, LIU J, HU J B . Adsorption mechanism of H2on covalent organic frameworks[J]. CIESC Journal, 2015, 66(7): 2540-2546.
[18]MILLWARD A R, YAGHI O M. Metal-organic frameworks with exceptionally high capacity for storage of carbon dioxide at room temperature[J]. Journal of the American Chemical Society, 2005, 127(51): 17998-17999.
[19]MATSUDA R, KITAULA R, KITAGAWA S, et al. Highly controlled acetylene accommodation in a metal-organic microporous material[J]. Nature, 2005, 436(7048): 238-241.
[20]TIAN J, THALLAPALLY P K, MCGRAIL B P. Porous organic molecular materials[J]. CrystEngComm, 2012, 14(6): 1909-1919.
[21]HISAKI I, NAKAGAWA S, TOHNAI N, et al. A C3-symmetric macrocycle-based, hydrogen-bonded, multiporous hexagonal network as a motif of porous molecular crystals[J]. Angewandte Chemie International Edition, 2015, 54(10): 3008-3012.
[22]LI P, HE Y, ZHAO Y, et al. A rod-packing microporous hydrogen-bonded organic framework for highly selective separation of C2H2/CO2at room temperature[J]. Angewandte Chemie International Edition, 2015, 54(2): 574-577.
[23]LI P, HE Y, ARMAN H D, et al. A microporous six-fold interpenetrated hydrogen-bonded organic framework for highly selective separation of C2H4/C2H6[J]. Chemical Communications, 2014, 50(86): 13081-13084.
[24]LUO X Z, JIA X J, DENG J H, et al. A microporous hydrogen-bonded organic framework: exceptional stability and highly selective adsorption of gas and liquid[J]. Journal of the American Chemical Society, 2013, 135(32): 11684-11687.
[25]WANG H, LI B, WU H, et al. A flexible microporous hydrogen-bonded organic framework for gas sorption and separation[J]. Journal of the American Chemical Society, 2015, 137(31): 9963-9970.
[26]YANG W, LI B, WANG H, et al. A microporous porphyrin-based hydrogen-bonded organic framework for gas separation[J]. Crystal Growth & Design, 2015, 15(4): 2000-2004.
[27]CHEN T H, POPOV I, KAVEEVIVITCHAI W, et al. Thermally robust and porous noncovalent organic framework with high affinity for fluorocarbons and CFCs[J]. Nature Communications, 2014, 5(1): 5131.
[28]ZENTNER C A, LAI H W H, GREENFIELD J T, et al. High surface area and Z' in a thermally stable 8-fold polycatenated hydrogen-bonded framework[J]. Chemical Communications, 2015, 51(58): 11642-11645.
[29]ZHOU D D, XU Y T, LIN R B, et al. High-symmetry hydrogen-bonded organic frameworks: air separation and crystal-to-crystal structural transformation[J]. Chemical Communications, 2016, 52(28): 4991-4994.
[30]THOMAS-GIPSON J, BEOBIDE G, CASTILLO O, et al. Paddle-wheel shaped copper (Ⅱ)-adenine discrete entities as supramolecular building blocks to afford porous supramolecular metal-organic frameworks (SMOFs)[J]. Crystal Growth & Design, 2014, 14(8): 4019-4029.
[31]THOMAS-GIPSON J, BEOBIDE G, CASTILLO O, et al. Porous supramolecular compound based on paddle-wheel shaped copper (Ⅱ)-adenine dinuclear entities[J]. CrystEngComm, 2011, 13(10): 3301-3305.
[32]NUGENT P S, RHODUS V L, PHAM T, et al. A robust molecular porous material with high CO2uptake and selectivity[J]. Journal of the American Chemical Society, 2013, 135(30): 10950-10953.
[33]LEE J M, PALGUNADI J, KiIM J H, et al. Selective removal of acetylenes from olefin mixtures through specific physicochemical interactions of ionic liquids with acetylenes[J]. Physical Chemistry Chemical Physics, 2010, 12(8): 1812-1816.
[34]ZHAO X, XING H, YANG Q, et al. Differential solubility of ethylene and acetylene in room-temperature ionic liquids: a theoretical study[J]. The Journal of Physical Chemistry B, 2012, 116(13): 3944-3953.
[35]PALGUNADI J, HONG S Y, LEE J K, et al. Correlation between hydrogen bond basicity and acetylene solubility in room temperature ionic liquids[J]. The Journal of Physical Chemistry B, 2011, 115(5): 1067-1074.
[36]BURD S D, MA S, PERMAN J A, et al. Highly selective carbon dioxide uptake by [Cu(bpy-n)2(SiF6)](bpy-1= 4,4'-Bipyridine; bpy-2= 1,2-bis (4-pyridyl) ethene)[J]. Journal of the American Chemical Society, 2012, 134(8): 3663-3666.
[37]MOHAMED M H, ELSAIDI S K, WOJTAS L, et al. Highly selective CO2uptake in uninodal 6-connected “mmo” nets based upon(M= Cr, Mo) pillars[J]. Journal of the American Chemical Society, 2012, 134(48): 19556-19559.
[38]XU H, HE Y, ZHANG Z, et al. A microporous metal-organic framework with both open metal and Lewis basic pyridyl sites for highly selective C2H2/CH4and C2H2/CO2gas separation at room temperature[J]. Journal of Materials Chemistry A, 2013, 49(60): 77-81.
[39]HE Y, XIANG S, ZHANG Z, et al. A microporous lanthanide-tricarboxylate framework with the potential for purification of natural gas[J]. Chemical Communications, 2012, 48(88): 10856-10858.
[40]XIANG S, ZHOU W, GALLENGOS J M, et al. Exceptionally high acetylene uptake in a microporous metal-organic framework with open metal sites[J]. Journal of the American Chemical Society, 2009, 131(34): 12415-12419.
[41]SUMIDA K, ROGOW D L, MASON J A, et al. Carbon dioxide capture in metal-organic frameworks[J]. Chemical Reviews, 2011, 112(2): 724-781.
[42]CUI XL, CHEN K J, XING H B, et al. Pore chemistry and size control in by brid porous materials for acetylene capture from ethylene[J]. Science, 2016, 353(6295): 141-144.
[43]LI P, HE Y, GUANG J, et al. A homochiral microporous hydrogen-bonded organic framework for highly enantioselective separation of secondary alcohols[J]. Journal of the American Chemical Society, 2014, 136(2): 547-549.
[44]LU J, PEREZ-KRAP C, SUYETIN M, et al. A robust binary supramolecular organic framework (SOF) with high CO2adsorption and selectivity[J]. Journal of the American Chemical Society, 2014, 136(37): 12828-12831.
[45]ELSAIDI S K, MOHAMED M H, SCHAEL H T, et al. Hydrophobic pillared square grids for selective removal of CO2from simulated flue gas[J]. Chemical Communications, 2015, 51(94): 15530-15533.
Porous hydrogen-bonded organometallic frameworks for adsorption separation of acetylene and carbon dioxide
XIE Danyan, XING Huabin, ZHANG Zhiguo, YANG Qiwei, YANG Yiwen, REN Qilong, BAO Zongbi
(Key Laboratory of Biomass Chemical Engineering of Ministry of Education, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310029, Zhejiang, China)
Two porous hydrogen-bonded organometallic frameworks, termed as MPM-1-Br and MPM-1-Cl,were synthesized from adenine and CuBr2(or CuCl2) at room temperature by slow diffusion method. The synthesized materials were characterized by analysis techniques including SEM, PXRD, TGA and specific surface area analysis. Single-component adsorption isotherms for acetylene and carbon dioxide on these materials were also determined.The experimental results revealed that MPM-1-Br and MPM-1-Cl have moderately high BET surface (373 m2·g−1, 417 m2·g−1), and they show good thermo stability at temperature up to 240℃. The calculations were performed using the ideal adsorbed solution theory (IAST) based on the single-component adsorption isotherms, obtaining the adsorption selectivity of MPM-1-Br and MPM-1-Cl for binary mixture of acetylene and carbon dioxide (50:50, volume ratio) to be 3.8 and 3.0 at temperature of 298 K and total pressure of 100 kPa, respectively, which are comparable to those on HKUST-1 and UTSA-30.
hydrogen-bonded organometallic framework; low diffusion method; adsorption;separation; acetylene; carbon dioxide
BAO Zongbi, baozb@zju.edu.cn
TQ021.4
:A
:0438—1157(2017)01—0154—09
10.11949/j.issn.0438-1157.20161055
2016-07-26收到初稿,2016-10-03收到修改稿。
联系人:鲍宗必。
:谢丹妍(1990—),女,硕士研究生。
国家自然科学基金项目(21376205,U1407134)。
Received date: 2016-07-26.
Foundation item: supported by the National Natural Science Foundation of China (21376205,U1407134).

