雷帕霉素减轻氧糖剥夺对SH-SY5Y细胞的损伤*
卢 娜, 魏林郁, 王宝英, 李 璐, 杨坤丽, 李东亮
(新乡医学院生理学与神经生物学教研室,河南 新乡 453003)
雷帕霉素减轻氧糖剥夺对SH-SY5Y细胞的损伤*
卢 娜△, 魏林郁, 王宝英, 李 璐, 杨坤丽, 李东亮
(新乡医学院生理学与神经生物学教研室,河南 新乡 453003)
目的: 观察雷帕霉素(Rapa)对氧糖剥夺(OGD)的人神经母细胞瘤SH-SY5Y细胞的影响,并探讨自噬在其中的作用。方法: SH-SY5Y细胞随机分为4组: 正常对照组(常规培养,不进行OGD处理)、Rapa组、OGD组(无糖培养基、1% O2的三气培养箱内孵育细胞12 h)和Rapa+OGD组。进行形态学观察;MTT法检测细胞活力;乳酸脱氢酶(LDH)漏出率判断细胞损伤的程度;caspase-3 活性检测试剂盒检测酶活性;原位末端标记(TUNEL)法检测凋亡水平;Western blot法检测凋亡相关蛋白Bax和Bcl-2、自噬标志蛋白LC3B-Ⅱ及自噬调控蛋白beclin-1的表达。结果: 与OGD组相比,Rapa+OGD组的细胞存活率明显升高(P<0.05),LDH 漏出率及caspase-3酶活性明显降低(P<0.05)。TUNEL染色观察结果显示,与OGD组相比,Rapa+OGD组的细胞凋亡明显减少(P<0.05);Western blot实验结果显示Rapa+OGD组的Bcl-2、beclin-1及LC3B-Ⅱ蛋白的表达水平显著高于OGD组(P<0.05),而Bax蛋白水平明显低于OGD 组(P<0.05)。 结论: Rapa对OGD 损伤的SH-SY5Y细胞具有保护作用,其机制可能与上调beclin-1蛋白、激活自噬有关。
雷帕霉素; SH-SY5Y细胞; 氧糖剥夺; 自噬
神经细胞的氧糖剥夺(oxygen-glucose deprivation,OGD)模型近年来多被用于在细胞水平模拟临床脑卒中过程,并主要以氧糖剥夺后快速恢复氧糖供应,从而模拟脑缺血再灌注损伤进行细胞自主修复及药物研究[1]。雷帕霉素(rapamycin,Rapa)不仅是一种免疫抑制剂,同时也是一种自噬反应增强剂[2]。近年来,来自人类和动物模型的大量研究均显示,细胞自噬与多种神经系统疾病的进展及预后密切相关[3-5]。本研究拟以SH-SY5Y细胞为对象,通过建立氧糖剥夺模型来模拟卒中的局部脑梗死过程,并进一步研究Rapa对于SH-SY5Y 细胞损伤的影响,对进一步探讨自噬对缺血缺氧过程中神经元的保护机制, 探索新的治疗靶点具有重要意义。
材 料 和 方 法
1 材料及主要仪器
人神经母细胞瘤SH-SY5Y细胞株由上海中科院典型细胞培养库提供;DMEM培养液和胎牛血清购于HyClone;MTT细胞活力及细胞毒性检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、caspase-3活性检测试剂盒和一步法TUNEL细胞凋亡检测试剂盒均购自碧云天生物技术公司;鼠抗Bcl-2和Bax单克隆抗体及兔抗beclin-1、LC3B-Ⅱ多克隆抗体购自Abcam;蛋白Marker购自碧云天生物技术公司;Rapa购自Gene Operation。三气培养箱购自Thermo Scientific;IX71荧光显微镜购自Olympus。
2 方法
2.1 SH-SY5Y细胞培养及分组 细胞置于含体积分数为10%胎牛血清的DMEM中,在37 ℃、含体积分数为5% CO2的饱和水汽培养箱中培养,每隔48 h换培养液,当单层细胞融合后,行传代处理。传代后随机分为对照(control)组、Rapa组、OGD组和Rapa+OGD组。每次每组设6 个平行复孔,实验重复3 次。
2.2 SH-SY5Y细胞OGD模型的建立 OGD模型制备参照文献[1, 6-8]并进行改良。选用生长良好的SH-SY5Y细胞,置换成无糖无血清培养基孵育,放入37 ℃三气培养箱(1% O2、5% CO2和94% N2)中培养3 h、6 h、9 h、12 h和24 h,以选择最佳作用时间。
2.3 Rapa工作液的配置 取5 mg Rapa粉末,置于灭菌EP管中,加入100 μL无水乙醇充分溶解,加至100 mL DMEM完全培养基,充分混匀,即为50 mg/L Rapa工作液。
2.4 形态学观察 SH-SY5Y细胞分别进行不同处理后,置于Olympus CKX41倒置相差显微镜上观察各组细胞形态特征,随机选择视野拍照。
2.5 MTT比色法检测细胞存活率 将细胞以5×107/L密度接种于96孔培养板,每孔100 μL,24 h后处理细胞。作用完毕后每孔加入MTT(5.0 g/L)10 μL、置入培养箱孵育4 h后,每孔再加入100 μL Formanzan溶解液,在细胞培养箱内再继续孵育4 h。采用酶联免疫检测仪在570 nm测定各孔吸光度(absorbance,A),评价细胞存活率。SH-SY5Y存活率(%)=实验组A值/对照组A值×100%。本实验对照组的细胞存活率定为100.0%。
2.6 LDH释放检测 根据细胞的大小和生长速度将适量细胞接种到96孔细胞培养孔板中,细胞密度约70%~80%。处理完毕后,将细胞培养板用多孔板离心机400×g离心5 min。取上清120 μL,移入新的96孔板相应孔中,各孔再加入60 μL LDH检测工作液,混匀,室温(约25℃)避光孵育30 min(用铝箔包裹后置于水平摇床或侧摆摇床上缓慢摇动)。然后在490 nm处测定吸光度。选用600 nm作为参考波长进行双波长测定。LDH活力=(处理样品吸光度-背景空白对照孔吸光度)/(标准管吸光度-标准空白管吸光度)×标准品浓度。
2.7 Caspase-3活性检测试剂盒检测caspase-3酶活性 冰浴裂解细胞15 min,4 ℃、20 000×g离心10 min,将上清转移到96孔板中。配置反应体系,再加入Ac-DEVD-pNA反应底物后混匀,37 ℃孵育60 min,测定A405。通过标准曲线对比计算出样品中催化产生多少量的黄色的对硝基苯胺(p-nitroaniline, pNA),反映caspase-3的活性。
2.8 一步法TUNEL细胞凋亡检测试剂盒检测细胞凋亡 取生长状态良好的对数生长期细胞,以2×105/L、每孔500 μL细胞悬液接种于24孔板内的载玻片上。培养24 h后,分组处理细胞;弃培养液、PBS洗涤1次、4%多聚甲醛固定1 h、0.1% Triton X-100冰浴孵育5 min、在样品上加50 μL TUNEL检测液,37 ℃避光孵育60 min,封片后立即在荧光显微镜下观察。在100倍镜下,随机取5个视野,计数呈现绿色荧光的凋亡细胞,取平均值,计算细胞凋亡率(%)=凋亡细胞数/视野下细胞总数×100%。实验重复3 次。
2.9 Western blot法检测蛋白表达 收获细胞,4 ℃预冷的PBS洗1次,加入适量的细胞裂解液,用细胞刮子刮下细胞,低温离心机12 000 ×g离心10 min,取上清液,弃沉淀。用BCA法测定各组蛋白含量,每孔上样25 μL蛋白,经15% SDS-PAGE 80 V电泳2 h后,300 mA恒流转膜40 min,5% 脱脂牛奶常温下封闭1 h后,在 4 ℃ 孵育Ⅰ抗(鼠抗人Bcl-2及Bax稀释比例为1∶2 000,兔抗人beclin-1及LC3B-II稀释比例为1∶3 000);5%脱脂牛奶常温下封闭Ⅱ抗(羊抗兔辣根过氧化物酶IgG 和羊抗小鼠辣根过氧化物酶IgG 稀释比例为 1∶5 000,5% 脱脂牛奶配制),ECL 显影显示目的条带和内参照,用ImageJ软件分析吸光度值,代表蛋白表达的相对水平。
3 统计学处理
用SPSS 18.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 不同OGD处理时间对SH-SY5Y细胞存活率的影响
MTT法检测结果以OGD处理0 h组细胞存活率为100.0%,则OGD处理3 h、6 h、9 h、12 h和24 h组存活率分别为96.2%、84.8%、74.5%、52.3%和26.8%;与0 h组比较,6 h、9 h、12 h和24 h组的存活率均显著降低(P<0.05),见图1。后续实验采用OGD处理12 h建立模型。

Figure 1.The effect of treatment with OGD for different time periods on the viability of SH-SY5Y cells. Mean±SD.n=3.*P<0.05vs0 h group.
图1 不同OGD处理时间对SH-SY5Y细胞存活率的影响
2 不同浓度Rapa处理组SH-SY5Y细胞形态的观察
倒置相差光学显微镜下观察SH-SY5Y细胞形态的变化,正常SH-SY5Y 细胞大部分呈梭形、三角形,少数呈多边形,胞浆饱满,多数可见细胞突起,折光性好,贴壁能力强;Rapa处理后,随着浓度增加,细胞贴壁数量明显减少,细胞形态不规则,体积皱缩,突起减少或消失,折光性减弱,脱壁的细胞增加,见图2。

Figure 2.The effect of Rapa at different concentrations on the morphological changes of SH-SY5Y cells (×100).
图2 不同浓度Rapa对SH-SY5Y 细胞形态的影响
3 Rapa作用的最适浓度选择
MTT法检测结果以空白对照组细胞存活率为100.0%,则50、40、30、20、10和5 mg/L Rapa作用24 h的存活率分别为28.7%、34.2%、40.5%、54.3%、97.1%和98.2%;后2个浓度Rapa组与空白对照组比较差异无统计学显著性(P>0.05),见图3。 后续实验选择10 mg/L为Rapa作用的最适浓度。
4 不同处理因素对SH-SY5Y 细胞形态的影响
倒置相差光学显微镜下观察SH-SY5Y细胞形态的变化,可见正常SH-SY5Y 细胞大部分呈梭形、三角形,少数呈多边形,胞浆饱满,多数可见细胞突起,折光性好,贴壁能力强;OGD处理后,细胞贴壁数量明显减少,细胞形态不规则,体积皱缩,突起减少或消失,折光性减弱,脱壁的细胞增加;Rapa+OGD组细胞的缺氧缺糖损伤明显减轻,提示自噬激动剂Rapa能减轻 OGD引起的细胞损伤,见图4。
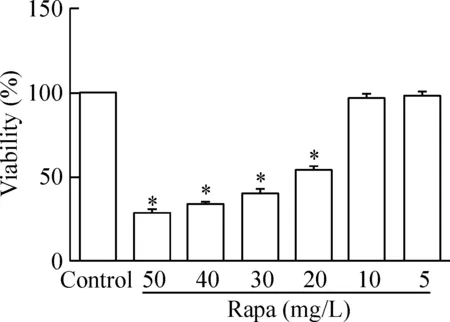
Figure 3.Effect of different concentrations of Rapa on the viabi-lity of SH-SY5Y cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3 不同浓度Rapa对SH-SY5Y 细胞存活率的影响
5 不同处理因素对SH-SY5Y细胞存活率的影响
MTT法检测结果以空白对照组细胞存活率为100.0%,则Rapa、OGD和Rapa+OGD组存活率分别为98.6%、53.8%和79.5%;OGD和Rapa+OGD组与对照组比较差异均有统计学显著性(P<0.05);OGD组与Rapa+OGD组比较差异有统计学显著性(P<0.05),见表1。

Figure 4.The effect of different treatment factors on the morphological changes of SH-SY5Y cells (×100).
图4 不同处理因素对SH-SY5Y细胞形态的影响
6 不同处理因素对SH-SY5Y细胞培养上清液中LDH漏出量的影响
LDH释放是细胞膜完整性的重要指标, LDH活性检测结果显示OGD组和Rapa+OGD组培养上清液中的LDH活性明显高于正常对照组(P<0.05);Rapa+OGD 组的LDH活性明显低于OGD组(P<0.05),见表1。
表1 Rapa对氧糖剥夺损伤 SH-SY5Y细胞的存活率和LDH漏出量的影响
Table 1.The effects of Rapa on the viability and leakage of LDH in the SH-SY5Y cells injured by OGD (Mean±SD.n=3)

GroupCellviability(%)LDH(U/L)Control100.0±0.066.2±5.8Rapa98.6±2.370.6±5.5OGD53.8±2.5∗803.3±5.4∗Rapa+OGD79.5±2.7#708.7±5.6#
*P<0.05vscontrol group;#P<0.05vsOGD group.
7 不同处理因素对SH-SY5Y细胞caspase-3酶活性的影响
Caspase-3活性检测试剂盒检测结果以空白对照组细胞的caspase-3酶活性为1,则Rapa、OGD和Rapa+OGD组的caspase-3酶活性分别为1.08、3.16和2.63。OGD组和Rapa+OGD组与对照组比较差异均有统计学显著性(P<0.05);Rapa+OGD组与OGD组比较差异有统计学显著性(P<0.05),见图5。

Figure 5.The caspase-3 activity in the SH-SY5Y cells with different treatments. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsOGD group.
图5 各组细胞caspase-3酶活性的比较
8 TUNEL法荧光染色检测细胞凋亡率
TUNEL 荧光染色可见control组和Rapa组阳性凋亡细胞数较少; OGD组和Rapa+OGD组阳性细胞数明显增多,Rapa+OGD组明显低于OGD组(P<0.05),见图6。
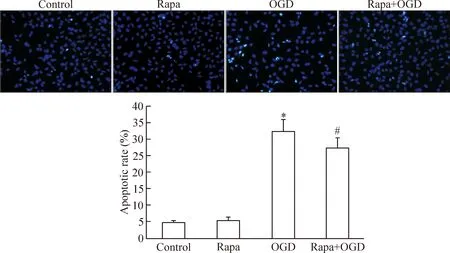
Figure 6.The TUNEL staining and apoptotic rate in the SH-SY5Y cells with different treatments (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsOGD group.
图 6 各组细胞的TUNEL荧光染色及凋亡率比较
9 Western blot法检测 Bcl-2、Bax、beclin-1和LC3B-Ⅱ蛋白水平的变化
Western blot分析结果显示,与正常对照组比较,OGD组和Rapa+OGD组的Bax蛋白表达量均明显增加(P<0.05);而Bcl-2表达明显减低(P<0.05)。Rapa+OGD组Bax蛋白表达明显低于OGD组(P<0.05);Rapa+OGD组的Bcl-2蛋白表达明显高于OGD组(P<0.05)。与正常对照组比较,Rapa组和Rapa+OGD组的beclin-1和LC3B-Ⅱ蛋白表达量均明显增加(P<0.05);且Rapa+OGD组beclin-1和LC3B-Ⅱ蛋白表达明显高于OGD组(P<0.05),见图7。

Figure 7.The protein levels of Bcl-2, Bax, beclin-1 and LC3B-Ⅱ in the SH-SY5Y cells with different treatments. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsOGD group.
图7 各组SH-SY5Y细胞Bcl-2、Bax、beclin-1及LC3B-Ⅱ蛋白水平的比较
讨 论
自噬是指细胞在自噬相关基因(autophagy-rela-ted gene,Atg)的调控下,清除细胞内少量受损的细胞器(如线粒体等)和生物大分子(如蛋白质等),维持细胞内环境自身稳定的一种溶酶体依赖的降解途径[9]。自噬广泛存在于真核细胞中,参与了如神经退行性改变、精神分裂、脑损伤等多种疾病的发病过程[10]。目前,大多数研究证实自噬具有脑保护作用[11-12],提示一定程度自噬的增强对维持神经细胞内环境稳定意义重大。自噬过程包括自噬的诱导;自噬体组装成形;自噬体的运输、与溶酶体融合;自噬体的降解。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3/Atg8)即是自噬体膜上的标记蛋白。LC3 蛋白在合成后其C端即被Atg4蛋白酶切割变成 LC3-Ⅰ,LC3-Ⅰ散在分布于细胞浆内。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺(phosphatidylethanolamine,PE)偶联形成 LC3-Ⅱ,并定位于自噬体内膜和外膜,而且LC3-Ⅱ始终稳定地保留在自噬体膜上直到与溶酶体融合,因此被用来作为自噬体的标记,且 LC3-Ⅱ的水平在某种程度上反映了自噬体的数量[13]。Beclin-1是自噬过程中一个重要的正性调节因子。哺乳动物自噬基因beclin-1是酵母apg6/vps30基因的同源物。Beclin-1 对自噬的调节不是孤立的,相反,它能与多种分子相互作用,形成不同复合体而发挥作用。Beclin-1既可以与Bcl-2、Bcl-xL结合调控凋亡,又与PI3KC3形成复合物在自噬过程中发挥关键作用,是凋亡与自噬途径相互交流和协调的重要蛋白质[14]。
雷帕霉素是一类新型免疫抑制剂,它通过抑制mTOR的蛋白激酶活性发挥作用。在很多哺乳动物细胞证实具有自噬诱导效应[15],如人类乳腺癌细胞、 肺癌细胞、角质细胞瘤细胞等。目前研究发现,Rapa通过激活自噬系统,减少大鼠脊髓损伤后神经元凋亡[16];Rapa干预自噬可减轻高糖对系膜细胞的氧化损伤[17];Rapa能够增强自噬,减少足细胞凋亡[18],提示Rapa可增强自噬,具有细胞保护作用。本研究拟以SH-SY5Y细胞为对象,通过建立氧糖剥夺模型来研究Rapa对于SH-SY5Y 细胞损伤的影响,进一步探讨自噬在神经元缺血缺氧过程中的作用, 探索新的治疗靶点。
本研究结果提示OGD对SH-SY5Y细胞存活率的影响存在时间依赖性,选取OGD处理12 h为合适细胞模型;Rapa对SH-SY5Y细胞存活率存在剂量依赖性,高浓度Rapa明显降低细胞存活率,选择10 mg/L Rapa为最适作用浓度,进行后续实验;Rapa明显增加OGD导致的SH-SY5Y细胞存活率,降低了LDH漏出量,明显降低OGD导致的SH-SY5Y细胞caspase-3酶活性的升高,明显降低了OGD导致的SH-SY5Y细胞凋亡率,提示Rapa对神经细胞缺氧缺血具有保护作用,与相关研究结果基本相符[19-21]。进一步通过Western blot法对凋亡相关蛋白Bcl-2、Bax及自噬相关蛋白LC3、beclin-1的表达进行检测,结果发现Rapa+OGD组Bax蛋白表达量明显低于OGD组;而Bcl-2、LC3B-Ⅱ、beclin-1蛋白表达明显高于OGD组。提示Rapa提高OGD损伤耐受性的机制可能与上调beclin-1、维持Bcl-2表达、抑制Bax表达从而减少细胞凋亡有关。因此, 我们推测Rapa通过上调beclin-1来诱导细胞自噬[22],自噬的激活为细胞提供营养物质,可对抗神经元的氧糖剥夺损伤;自噬与凋亡存在负相关,对细胞的存活起一定的保护作用。
自噬是细胞内的一种“自食(Self-eating)”现象,凋亡是“自杀(self-killing)”现象。两者之间存在复杂联系,在一定条件下自噬是细胞对应激的适应性反应,可避免发生死亡;而在其它环境中,自噬可能是细胞死亡的替代途径。 Bcl-2家族成员在细胞凋亡与自噬过程中发挥着交叉性作用。Beclin-1有1个 BH3 结构域,Bcl-2、Bcl-xL 等可以通过这个BH3结构域与 beclin-1 结合而影响其活性。抗凋亡 Bcl-2家族蛋白和 beclin-1的表达水平、磷酸化、分子的亚细胞定位以及BH3-only 蛋白等,均可调节 beclin-1 蛋白和 Bcl-2 家族蛋白结合水平,进而调控自噬的发生,并可能对细胞最终走向自噬还是凋亡起着关键作用[14]。自噬和凋亡有共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚[23]。自噬在脑损伤中的作用仍需进行后续的探讨来加以验证,为脑缺血的防治开辟新的途径。
[1] Zhu QZ, Zhang YF, Liu YL, et al. MLIF alleviates SH-SY5Y neuroblastoma injury induced by oxygen-glucose deprivation by targeting eukaryotic translation elongation factor 1A2 [J]. PLoS One, 2016, 11(2):e0149965.
[2] Campos T, Ziehe J, Fuentes-Villalobos F, et al. Rapamycin requires AMPK activity and p27 expression for promoting autophagy-dependent Tsc2-null cell survival [J]. Biochim Biophys Acta, 2016, 1863(6 Pt A):1200-1207.
[3] Hu G, Gong X, Wang L, et al. Triptolide promotes the clearance of α-synuclein by enhancing autophagy in neuronal cells[J]. Mol Neurobiol, 2016 Mar 9 [Epub ahead of print].
[4] Kizilarslanolu MC, Ülger Z. Role of autophagy in the pathogenesis of Alzheimer disease[J].Turk J Med Sci, 2015, 45(5):998-1003.
[5] Chang YC, Lin CW, Hsu CM, et al. Targeting the prodromal stage of spinocerebellar ataxia type 17 mice: G-CSF in the prevention of motor deficits via upregulating chape-rone and autophagy levels[J]. Brain Res, 2016, 1639:132-148.
[6] Wang Y, Zhang J, Han M, et al. SMND-309 promotes neuron survival through the activation of the PI3K/Akt/CREB-signalling pathway[J]. Pharm Biol, 2016, 54(10):1982-1990.
[7] Lin-Holderer J, Li L, Gruneberg D, et al. Fumaric acid esters promote neuronal survival upon ischemic stress through activation of the Nrf2 but not HIF-1 signaling pathway[J]. Neuropharmacology, 2016, 105:228-240.
[8] Darshit BS, Ramanathan M. Activation of AKT1/GSK-3β/β-catenin-TRIM11/survivin pathway by novel GSK-3β inhibitor promotes neuron cell survival: study in differen-tiated SH-SY5Y cells in OGD model[J]. Mol Neurobiol, 2016, 53(10):6716-6729.
[9] Denton D, Xu T,Kumar S. Autophagy as a pro-death pathway[J].Immunol Cell Biol, 2015, 93(1):35- 42.
[10]Shpilka T, Elazar Z. Shedding light on mammalian microautophagy[J]. Dev Cell, 2011, 20(1):1-2.
[11]Kasprowska D, Machnik G, Kost A, et al. Time-dependent changes in apoptosis upon autophagy inhibition in astrocytes exposed to oxygen and glucose deprivation [J]. Cell Mol Neurobiol, 2016 Mar 16. [Epub ahead of print]
[12]Xie C, Ginet V, Sun Y, et al. Neuroprotection by selective neuronal deletion of Atg7 in neonatal brain injury[J]. Autophagy, 2016, 12(2):410-423.
[13]Kimura S, Fujita N, Noda T, et al. Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452:1-12.
[14]Kang R, Zeh HJ, Lotze MT, et al. The Beclin 1 network regulates autophagy and apoptosis [J]. Cell Death Differ, 2011, 18(4):571-580.
[15]Abdulrahman BA, Khweek AA, Akhter A, et al. Auto-phagy stimulation by rapamycin suppresses lung inflammation and infection by Burkholderia cenocepacia in a model of cystic fibrosis[J]. Autophagy, 2011, 7(11):1359-1370.
[16]杨 清, 刘文革, 王振宇. 雷帕霉素增强大鼠脊髓损伤后神经元自噬对凋亡影响的观察[J]. 福建医药杂志, 2012, 6(34):59-63.
[17]李 锦, 白雪源, 崔少远. 雷帕霉素对高糖诱导的肾系膜细胞自噬抑制、氧化损伤和衰老的影响[J]. 南方医科大学学报, 2012, 32(4):467-471.
[18]杨凤杰, 周建华, 吕倩影, 等. 雷帕霉素减缓大鼠被动 Heymann 肾炎的进展[J]. 中国病理生理杂志, 2014, 30(9):1661-1665.
[19]Cao K, Graziotto JJ, Blair CD, et al. Rapamycin reverses cellular phenotypes and enhances mutant protein clearance in Hutchinson-Gilford progeria syndrome cells[J]. Sci Transl Med, 2011, 3(89):89ra58.
[20]宋 宇. 雷帕霉素对大鼠脊髓损伤的保护作用及机制研究[D]. 吉林:吉林大学, 2015: 22-37.
[21]Pignataro G, Capone D, Polichetti G, et al.Neuroprotective, immunosuppressant and antineoplastic properties of mTOR inhibitors: current and emerging therapeutic options[J]. Curr Opin Pharmacol, 2011, 11(4):378-394.
[22]Jung CH, Ro SH, Cao J, et al. mTOR regulation of autophagy[J]. FEBS Lett, 2010, 584 (7):1287-1295.
[23]Maejima Y, Isobe M, Sadoshima J. Regulation of auto-phagy by Beclin 1 in the heart[J]. J Mol Cell Cardiol, 2016, 95:19-25.
(责任编辑: 林白霜, 罗 森)
Rapamycin reduces SH-SY5Y cell damage induced by oxygen-glucose deprivation
LU Na, WEI Lin-yu, WANG Bao-ying, LI Lu, YANG Kun-li, LI Dong-liang
(DepartmentofPhysiologyandNeurobiology,XinxiangMedicalUniversity,Xinxiang453003,China.E-mail: 13462225817@163.com)
AIM: To observe the effect of rapamycin (Rapa) on human neuroblastoma SH-SY5Y cell injury induced by oxygen-glucose deprivation (OGD), and to explore the role of autophagy in this process. METHODS: The SH-SY5Y cells were randomly divided into 4 groups: normal control group: the cells were cultured without OGD treatment; Rapa group: the cells were pretreated with Rapa for 1 h; OGD group: the culture medium was replaced by glucose-free medium and the cells were transferred to a humidified incubation chamber flushed by a gas mixture of 1% O2, 94% N2and 5% CO2for 12 h; Rapa+OGD group: the cultured cells were treated with Rapa for 1 h, and then were given the same treatments as those in OGD group. The cell viability was assessed by MTT assay. The degree of the cell damage was evaluated by determining the leakage of lactate dehydrogenase (LDH). The enzyme activity of caspase-3 was detected. TUNEL staining were used to detect the variation of cell apoptosis. The protein levels of apoptosis-related proteins Bax and Bcl-2, autophagy-related protein beclin-1 and autophagy marker protein LC3B were determined by Western blot. RESULTS: Compared with OGD group, the viability of the SH-SY5Y cells was significantly increased, and the activity of caspase-3 was significantly reduced in Rapa+OGD group (P<0.05). The SH-SY5Y cell injury was apparent after OGD with a great increase in the apoptotic rate (P<0.05). Compared with OGD group, the apoptotic rate significantly decreased in Rapa+OGD group (P<0.05). Compared with control group, the protein level of Bcl-2 was significantly decreased (P<0.05) and the protein level of Bax was significantly increased in OGD group. Compared with OGD group, the levels of Bcl-2, beclin-1 and LC3B-Ⅱ were significantly increased and the protein level of Bax was significantly increased in Rapa+OGD group (P<0.05). CONCLUSION: Rapamycin has a protective effect oninvitrocultured SH-SY5Y cells injured by OGD. The mechanism may be related to the promotion of autophagy.
Rapamycin; SH-SY5Y cells; Oxygen-glucose deprivation; Autophagy
1000- 4718(2017)01- 0104- 06
2016- 04- 08
2016- 11- 30
河南省教育厅科学技术重点研究项目(No. 14A310009;No. 14A310019)
R363.21
A
10.3969/j.issn.1000- 4718.2017.01.017
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13462225817; E-mail: 13462225817@163.com
——雷帕霉素

