shSASH1基因对卵巢癌细胞SKOV3生物学功能的影响
王玉娣,章建国,刘益飞
(1.高邮市妇幼保健院,江苏 扬州 225600;2.南通大学附属医院,江苏 南通 226001)
shSASH1基因对卵巢癌细胞SKOV3生物学功能的影响
王玉娣1,章建国2,刘益飞2
(1.高邮市妇幼保健院,江苏 扬州 225600;2.南通大学附属医院,江苏 南通 226001)
目的 探讨SASH1对卵巢癌细胞SKOV3的增殖、凋亡与侵袭方面的影响。方法 标本组织来源于妇产科手术收集的50例卵巢癌组织。通过建立重组质粒pcDNA3.1-SASH1,并借助于脂质体2000转染到SKOV3,采用流式细胞计(FCM)分析实验和细胞侵袭实验,来探索SASH1对卵巢癌细胞SKOV3在细胞扩散、凋亡和侵袭中的影响。结果 pcDNA3.1-SASH1转染组中的S期细胞分值(%)低于正常(未转染的)对照组(χ2=26.78,P<0.01)或空载组(pcDNA3.1)(χ2=25.12,P<0.01)。与空载组和正常(未转染的)对照组相比,pcDNA3.1-SASH1转染组中的SKOV3明显降低了癌细胞的生长、增殖和侵袭的能力(χ2=31.25,P<0.01),然而在空载组和正常(未转染的)对照组中没有明显的差异;pcDNA3.1-SASH1细胞组显示更多的凋亡细胞(χ2=36.58,P<0.01)。结论 SASH1可抑制卵巢癌细胞SKOV3的生长、增殖和侵袭能力,并促进其凋亡。
SASH1基因;卵巢癌细胞SKOV3;增殖;凋亡;侵袭
卵巢癌是最致命的妇科恶性肿瘤之一,是妇科肿瘤死亡的主要原因[1-2]。卵巢癌通过多基因发展变化,目前还未明确这些信号道路是如何发挥作用的。新的致癌基因和抑癌基因的发现仍是了解此病发病机制的重要途径[3-4]。SASH1(SAM- and SH3-domain containing 1, SASH1)基因,是一种新的候选抑癌基因,是SLY(SH3-domain containing expressed in lymphocytes, SLY)基因家族中的一种信号衔接蛋白[5],在人体多种正常组织中广泛表达。随着对SASH1基因的研究,发现SASH1基因在多种肿瘤组织中表达下降,如结肠癌、黑色素瘤、肺癌、骨肉瘤、食管鳞癌等;并对肿瘤的侵袭性生长、转移灶的形成及预后产生影响[6]。但至今国内外仍未见SASH1基因与卵巢癌细胞之间关系的研究报道。本研究主要探讨SASH1基因对卵巢癌细胞SKOV3生物学功能方面的影响,在卵巢癌发生、发展过程中的作用,是否能成为卵巢癌独立预后的指标之一。
1资料与方法
1.1研究对象
新鲜卵巢癌组织切除样本来自2011年1月至2013年12月南通大学附属医院50名卵巢癌患者。样本取出后立即放入液氮中,然后置于-80℃冰箱中保存,按照伦理和法律标准,所有患者匿名。所有卵巢癌患者术前均未做任何治疗,均无其他相关炎症性疾病。手术切除的50例卵巢癌组织均被病理诊断核实,并且有完整的临床资料。
1.2方法
1.2.1质粒构建
基因SASH1开放侧面引物和限制性内切酶的设计采用Primer Premier 5软件实施。正向引物:5′-CG GGATCC ATG GAG GAC GCG GGA GCA GC-3′,包含BamHⅠ限制性内切酶位点;反向引物:5′-CC CTCGAG CAT GGC CTC AGG GCC TGG CG-3′,包含XhoⅠ限制性内切酶位点。cDNA第1条链由来自SKOV3细胞的mRNA的模板合成,PCR用基因SASH1的引物来引导。PCR产品被克隆成pGEM-T空载。经过限制性核酸内切酶裂解和识别后,校正的重组质粒被序列化。空载pcDNA3.1和重组质粒pGEM-SASH1 同时被限制性核酸内切酶BamH I和Xho I裂解,目标片段被分别收集,并通过T4 DNA连接酶连接,重组质粒pGEM-SASH1被转换为DH5α感应细胞。
1.2.2 细胞培养和转染
将卵巢癌SKOV3细胞置于RPMI-1640培养基中,置于37°C、5%CO2、饱和湿度培养24h后,收集在对数生长期的细胞,以便实验。建立正常(未转染的)对照组。在常温下,SKOV3细胞接种于6孔培养皿中,采用Lipofectamine 2000转染,转染为空带菌者(pcDNA3.1)和重组表达质粒pcDNA3.1-SASH1。质粒被无血清的RPMI-1640培养基稀释,轻轻混匀;将脂质体 Lipofectamine 2000添加到RPMI-1640培养基中,轻度混合后,在常温下培养5min后,与稀释的质粒混合;在常温下培养20min,形成混合物,加到含有SKOV3细胞的培养皿中,置于37℃、饱和湿度、5%CO2中培养箱中培养5h后,再换到含有5%胎牛血清的RPMI-1640培养基中培养48h。在SKOV3细胞转染质粒pcDNA3.1-SASH1 48h后,采用Western blot分析测定SASH1表达。
1.2.3流式细胞术测定细胞周期
在常温下,培养的SKOV3细胞均匀接种在6孔培养皿中,浓度为3×105细胞/mL。转染后48h,收集的细胞用0.25%胰蛋白酶进行消化后,在PBS中洗2次,加入预冷的70%乙醇,在-20℃下固定24h。次日,用柠檬酸-磷酸盐缓冲液和PBS 洗后,再按0.1mg/mL加入RNase溶液,在37℃下静置30min,之后加入PI溶液染色30min。细胞被保存在避光的冰上,并立即对之进行流式细胞术(FCM)分析。采用Macquit 和 FCM Cell Quest软件来分析。试验重复3次。
1.2.4生长曲线分析
在细胞分别转染了24h、48h、72h和96h后,用Hoechst33342 (Beyotime公司)对SKOV3细胞株进行染色。用DME荧光显微镜观察染色后的细胞形态和数量,并借助Image Pro Plus 6.0版软件来统计细胞总数。从3个孔板中随机选取10个视野统计细胞数量。此试验被重复3次。
1.2.5 FCM测定细胞凋亡
在常温下,收集培养的SKOV3细胞,均匀接种在6孔培养皿中。转染后48h,细胞用0.25%胰蛋白酶进行消化,在PBS中洗两次,悬浮放入195μL Annexin V-FITC(Roche公司) 结合缓冲液中。加入5μL的Annexin V-FITC并轻轻地混合,SKOV3 细胞在室温下避光染色10min,然后,将SKOV3细胞以1 000g离心5min,并轻柔地悬浮在190μL Annexin V-FITC结合缓冲液中。最后,加入10μL PI着色液,轻轻地混合,细胞被保存在避光的冰上,并立即采用Macquit 和 FCM Cell Quest软件来分析。此试验被重复3次。
1.2.6 Transwell侵袭实验
将20μL基质胶均匀地覆盖在聚碳酸脂膜(8.0μm)的表面,从而形成基质胶膜。转染后,每一组SKOV3细胞覆盖在无血清培养基的transwell小室的聚碳酸酯膜的上边。在室温下5%CO2培养48h后,观察细胞的情况,用PBS缓冲液清洗细胞1~2次,并用Hoechst 33342染色。穿过滤过膜的癌细胞即侵袭细胞,这些细胞被随机分为8个视野,放在Leica显微镜下观察并计算数量,每一组重复试验3次,结果取平均值。
1.3统计学方法
统计分析采用Stata 7.0软件,χ2检验,P<0.05具有统计学意义。
2结果
2.1 SASH1对卵巢癌细胞SKOV3 细胞增殖的影响
用FCM来检测SASH1在SKOV3细胞周期中的情况。结果显示,pcDNA3.1-SASH1转染组中的S期细胞分值(%)低于正常(未转染的)对照组(χ2=26.78,P<0.01)或空载组(pcDNA3.1)(χ2=25.12,P<0.01)。其S期分数在正常(未转染的)对照组和空载组没有明显的区别,见图1。通过细胞生长曲线观察转染了pcDNA3.1-SASH1的SKOV3的生长情况,与空载组或对照组相比,转染了pcDNA3.1-SASH1的SKOV3细胞株的数量在转染后的48h、72h、96h都是降低的。见图2。提示SASH1可能会抑制卵巢癌细胞SKOV3的增殖。
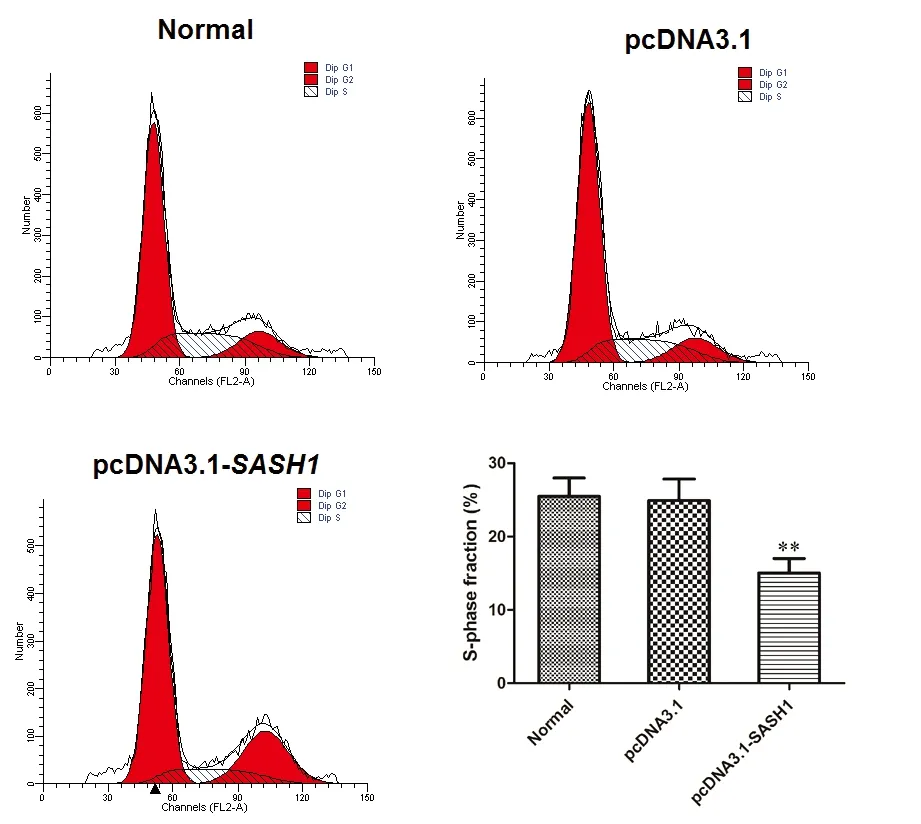
注:曲线显示pcDNA3.1-SASH1转染组、空载组和正常(未转染的)对照组不同时间长度的SKOV3的生长变化,在Hoechst 33342着色后通过显微镜下计数细胞数评估。pcDNA3.1-SASH1转染组的SKOV3细胞数明显减少(**P<0.05)
图1 FCM分析SASH1对卵巢癌细胞SKOV3扩散的影响,并与空载组和正常(未转染的)对照组比较
Fig.1 Effect of SASH1 on proliferation of ovarian cancer cell SKOV3 analyzed by FCM and comparison with empty vector group and normal(non-transfected) control group
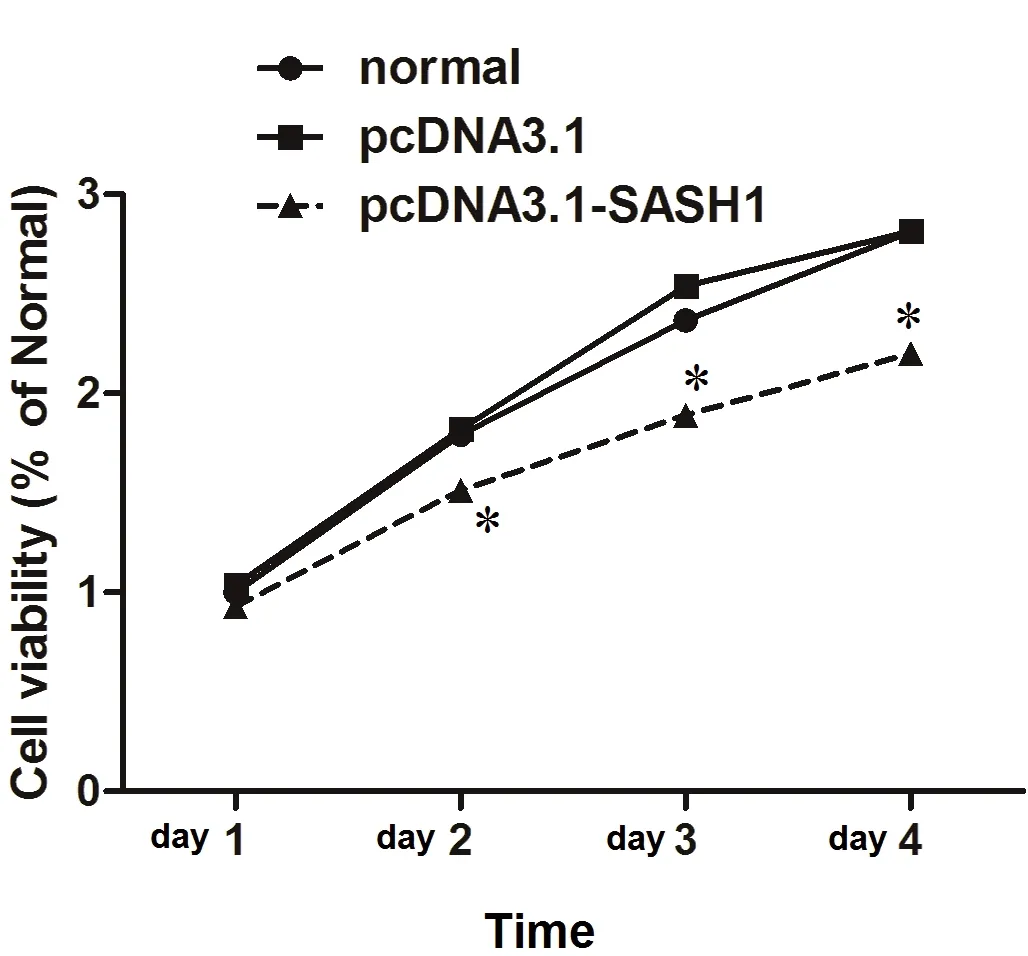
图2 细胞生长曲线分析SASH1 对卵巢癌细胞SKOV3生长的影响
Fig.2 Effect of SASH1 on the growth of ovarian cancer cell SKOV3 analyzed by cell growth curve
2.2 SASH1对卵巢癌细胞SKOV3凋亡的影响
经Annexin V和PI双染后,用FCM来分析SASH1在SKOV3中的凋亡情况。FCM结果显示,pcDNA3.1-SASH1转染组的凋亡百分比明显高于正常(未转染的)对照组和空载组(χ2=36.58,P<0.01)。然而,细胞凋亡数在正常(未转染的)对照组和空载组之间没有明显的区别,提示SASH1可能促进卵巢癌细胞SKOV3凋亡,见图3。

注:与空载组和正常(未转染的)对照组相比,pcDNA3.1-SASH1转染组细胞SKOV3凋亡明显增多(**P<0.01)。
图3 FCM分析SASH1在卵巢癌细胞SKOV3凋亡中的影响
Fig.3 Effect of SASH1 on the apoptosis of ovarian cancer cell SKOV3 analyzed by FCM
2.3 SASH1对卵巢癌细胞SKOV3侵袭的影响
通过transwell试验来评估SKOV3的侵袭能力。与正常(未转染的)对照组和空载组相比,pcDNA3.1-SASH1转染组的细胞株穿过滤过膜的数量明显降低(χ2=31.25,P<0.01)。提示SASH1的过度表达与SKOV3的侵袭能力有关,见图4。
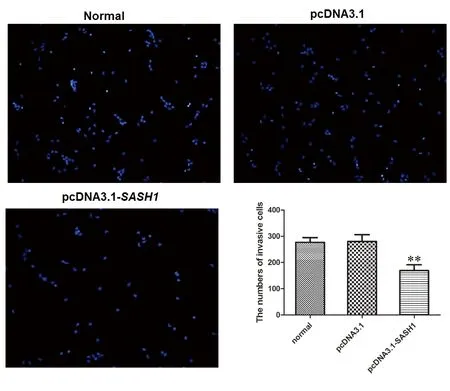
注:穿过聚碳酸酯膜的细胞量在Hoechst 33342着色后通过显微镜下计数及评估,结果显示,与空载pcDNA3.1和正常(未转染的)对照组相比,pcDNA3.1-SASH1转染组细胞数明显减少(**P<0.01)。
图4 transwell实验分析SASH1对卵巢癌细胞SKOV3侵袭的影响
Fig.4 Effect of SASH1 on invasion of ovarian cancer cell SKOV3 analyzed by transwell experiment
3讨论
SASH1基因通过多种途径对细胞增殖、分化、凋亡及免疫应答实行调控,并参与肿瘤侵袭性生长、转移灶的形成,从而参与了多种疾病的发生和发展。SASH1由22个外显子和21个内含子构成, 其表达产物包含两个重要的结构域:SH3和SAM域[7]。两个结构域都能调节介导蛋白对蛋白的相互作用,SH3域通过识别富含脯氨酸和疏水残基的序列来介导蛋白之间的相互作用,而SAM域以一种更复杂的方式发挥作用-它们通过其他蛋白上SAM域中的同源和异源性寡聚化反应来介导蛋白之间的相互作用,也通过介导Smaug蛋白质和mRNAs捆绑来调整转录[8]。蛋白基因结构的分析揭示,SASH1是一个最近被描述为SH3/SAM适配分子家族的一员,并因此提示其参与相关信号转导途径[9]。在过去几年里,SASH1一直被证实作为一个候选的肿瘤抑制基因,它广泛表达于人体的乳腺、肺、甲状腺、胸腺等正常组织和上皮细胞系中(淋巴细胞除外),SASH1的减少或缺失与肿瘤的生长、浸润、转移及不良的预后密切相关。Zeller等[7]于2003年首先报道65例乳腺癌中,有70%的乳腺癌样本中,出现SASH1mRNA的表达水平明显降低;另30%乳腺癌样本出现SASH1基因缺失。而且,在甲状腺原发性癌中的表达也明显降低。此外,SASH1表达的下调与不同时期的远处转移有关。SASH1表达的下调可能在肿瘤发生、发展和演化过程中发挥重要作用。本研究的目的是通过研究SASH1对卵巢癌细胞株SKOV3影响,从而探讨其在卵巢癌发生发展中的作用。
为了分析SASH1对卵巢癌细胞SKOV3在细胞生物学特征方面的影响,本研究构建了SASH1的重组表达空载体和pcDNA3.1-SASH1转染组。SASH1在转染上pcDNA3.1-SASH1的SKOV3中呈过度表达,但在空载组和正常(未转染的)对照组,其表达水平较低。因此,成功建立了SASH1的过度表达细胞模型。通过使用细胞生长曲线或FCM分析SASH1对 SKOV3生长和增殖中的影响。FCM分析显示,pcDNA3.1-SASH1转染组中的S期分数(%)低于正常(未转染的)对照组(P<0.01)或空载组(P<0.01)。与正常(未转染的)对照组或空载组相比,SKOV3细胞数被转染上pcDNA3.1-SASH1后48h、72h及96h均表现为减少。这些研究的结果提示,SASH1可能抑制卵巢癌细胞SKOV3的生长和增殖。然而,准确的作用机制仍需进一步探索。运用FCM检测SASH1 对 SKOV3细胞凋亡的作用的过程中采用了Annexin V和PI双染,结果,pcDNA3.1-SASH1转染组中的凋亡细胞的百分比明显高于正常(未转染的)对照组和空载组(P<0.01)。实验结果提示,SASH1作为肿瘤抑制基因,除了可以抑制肿瘤细胞的生长和增殖,还可以促进细胞的凋亡。
在本研究中,通过Transwell试验即细胞侵袭实验来研究SASH1对SKOV3的侵袭能力的影响。与正常(未转染的)对照组和空载组相比,穿过聚碳酸酯膜pcDNA3.1-SASH1转染组中的细胞量明显减少(P<0.01)。这些数据提示SASH1的过表达与SKOV3侵袭能力被抑制有关。原因是SASH1调节细胞骨架,并促进细胞基质的黏附作用,而黏附功能的下降是恶性肿瘤细胞发生转移的关键[6]。Martini等[10]也证明了SASH1可以通过调节肌动蛋白细胞骨架之间的相互作用,促进细胞机制黏附,抑制癌细胞的增殖;SASH1的表达导致细胞黏附于纤维连接蛋白和层黏连蛋白增多,因而抑制了癌细胞转移。提示SASH1可能涉及卵巢癌的浸润和转移,SASH1在抑制转移过程中可能也起重要的作用。研究结果表明,SASH1参与肿瘤侵袭和转移相关的分子途径。
综上所述,SASH1抑制卵巢癌细胞SKOV3的生长、增殖和侵袭能力,并促进其凋亡,提示SASH1可能在卵巢癌的发生、发展、侵袭和转移过程中起重要作用。SASH1蛋白在卵巢癌中如何导致肿瘤发生、发展、侵袭和转移的具体机制还有待今后进一步的研究,从而为卵巢癌的治疗提供更新的方法。
[1]Schwab C L,English D P,Roque D M,etal.Past,present and future targets for immunotherapy in ovarian cancer[J].Immunotherapy,2014,6(12):1279-1293.
[2]Seidman J D,Vang R,Ronnett B M,etal.Distribution and case-fatality ratios by cell-type for ovarian carcinomas:a 22-year series of 562 patients with uniform current histological classification[J].Gynecol Oncol,2015, 136(2):336-340.
[3]Vermeersch K A,Wang L,McDonald J F,etal.Distinct metabolic responses of an ovarian cancer stem cell line[J].BMC Syst Biol,2014,8:134.
[4]Chen K,Ma H,Li L,etal.Corrigendum:Genome-wide association study identifies new susceptibility loci for epithelial ovarian cancer in Han Chinese women[J].Nat Commun,2014,5:5828.
[5]Beer S, Scheikl T, Reis B,etal.Impaired immune responses and prolonged allograft survival in Sly1 mutant mice[J].Mol Cell Biol,2005,25(21):9646-9660.
[6]刘秋菊,贺远龙,刘红云,等. SASH1基因在食管鳞癌中的表达及临床意义[J].世界华人消化杂志,2013,21(22):2198-2201.
[7]Zeller C,Hinzmann B, Seitz S,etal.SASH1:a candidate tumor suppressor gene on chromosome 6q24.3 is downregulated in breast cancer[J].Oncogene,2003,22(19): 2972-2983.
[8]Courcet J B,Elalaoui S C, Duplomb L,etal.Autosomal-recessive SASH1 variants associated with a new genodermatosis with pigmentation defects, palmoplantar keratoderma and skin carcinoma[J].Eur J Hum Genet,2014,23(7):957-962.
[9]Dauphinee S M,Clayton A,Hussainkhel A,etal.SASH1 is a scaffold molecule in endothelial TLR4 signaling[J].J Immunol,2013,191(2):892-901.
[10]Martini M,Gnann A,Scheikl D,etal.The candidate tumor suppressor SASH1 interacts with the actin cytoskeleton and stimulates cell-matrix adhesion[J].Int J Biochem Cell Biol,2011,43(11):1630-1640.
[专业责任编辑:张冠军]
Effect of shSASH1 gene on biological function of ovarian cancer cell SKOV3
WANG Yu-di1, ZHANG Jian-guo2, LIU Yi-fei2
(1.Maternal and Child Health Care Hospital of Gaoyou, Jiangsu Yangzhou 225600; China;2.AffiliatedHospitalofNantongUniversity,JiangsuNantong226001,China)
Objective To investigate the effect of SAM- and SH3-domain containing 1 (SASH1) on cell proliferation, apoptosis and invasion of ovarian cancer cell SKOV3. Methods Sample tissues were collected from tissues of 50 cases of human ovarian cancer in gynecologic surgery. A recombinant plasmid pcDNA3.1-SASH1 was established and transfected into SKOV3 cells with help of Lipofectamine 2000. Effect of SASH1 on cell proliferation, apoptosis and invasion of ovarian cancer cell SKOV3 were explored through flow cytometry (FCM) analysis and cell invasion test. Results Cell proportion (%) at S stage in pcDNA3.1-SASH1 transfected group was lower than normal (non-transfected) control group (χ2=26.78,P<0.01) or empty vector group (pcDNA3.1) (χ2=25.12,P<0.01). Ability of growth, proliferation and invasion of cancer cells SKOV3 reduced significantly in pcDNA3.1-SASH1 transfected group compared to empty vector group and normal (non-transfected) control group (χ2=31.25,P<0.01), but there was no significant difference between the empty vector group and normal (non-transfected) control group. Significantly more apoptotic cells were found in pcDNA3.1- SASH1 group than in empty vector group and normal control group (χ2=36.58,P<0.01). Conclusion SASH1 can inhibit growth, proliferation and invasion of ovarian cancer cell SKOV3, and promote its apoptosis.
SASH1; ovarian cancer cell SKOV3; proliferation; apoptosis; invasion
2016-05-27
王玉娣(1973-),女,副主任医师,主要从事卵巢肿瘤临床诊疗工作。
10.3969/j.issn.1673-5293.2016.12.015
R737.31
A
1673-5293(2016)12-1475-04

