热休克蛋白60联合银杏叶提取物对动脉粥样硬化大鼠血中调节性T细胞含量及主动脉根部巨噬细胞CD36表达的影响
段虎斌,郝春艳,刘翠明,刘学军
热休克蛋白60联合银杏叶提取物对动脉粥样硬化大鼠血中调节性T细胞含量及主动脉根部巨噬细胞CD36表达的影响
段虎斌,郝春艳,刘翠明,刘学军
目的 研究联合使用热休克蛋白60(HSP60)及银杏叶提取物(GBE)对动脉粥样硬化(AS)大鼠血中调节性T细胞(Treg)含量及主动脉根部巨噬细胞CD36表达的影响。方法 取出生后30 d(1月龄)SD雄性大鼠50只,体重100 g±10 g。随机分为5组:健康对照组(C组),AS未干预组(A组),HSP60干预组(H组),银杏叶提取物干预组(G组),联合干预组(H+G组),以上每组10只。实验采用高脂饲料造 AS 模型,于出生后150 d(即高脂饮食后120 d)各组停止高脂饮食,H组开始用HSP60灌胃,G组用GBE灌胃,H+G组用HSP60及GBE灌胃;于大鼠 180 日龄时采血并取大鼠主动脉根部后处死,通过用流式细胞技术检测各组血中Treg细胞的含量,免疫组化检测各组大鼠主动脉根部巨噬细胞CD36表达情况。结果 高脂饮食实验组主动脉内膜增厚,平滑肌细胞增生,排列紊乱,泡沫细胞浸润,肌纤维断裂;各组血清总胆固醇(TC)在180 d时较30 d时有明显升高,依次为A组、H组、G组、H+G组、C组;A组和H组之间差别无统计学意义(P>0.05),但较G组、H+G组、C组升高均明显(P<0.05),H+G组和G组二者之间差别无统计学意义(P>0.05),但较C组为高,较A组和H组为低(P<0.05);C组、A组、H组、G组、H+G组各组血中Treg细胞含量分别为(2.53±0.30)%,(1.64±0.29)%,(3.39±0.31)%,(1.70±0.25)%,(3.58±0.35)%,各组主动脉根部巨噬细胞CD36表达情况为:7.03±1.41,20.95±2.19,13.51±1.10,14.98±1.61,10.68±1.03。结论 口服热休克蛋白可以诱导免疫耐受,减轻内膜炎症,稳定斑块,阻止内膜增厚,银杏叶提取物活血化瘀,通络止痛,敛肺平喘,化浊降脂,减少脂质斑块的形成,减轻内膜炎症和内膜增厚,二者联合使用可以通过诱导免疫耐受和降脂,进一步减少内膜炎症反应,最终达到增强改善AS病变程度的效果。
动脉粥样硬化;热休克蛋白60;银杏叶提取物;调节性T细胞;巨噬细胞CD36
动脉粥样硬化(AS)可以造成血管狭窄或阻塞导致组织器官缺血缺氧或坏死,是严重危害健康的“杀手”[1]。治疗AS的药物有多种,主要包括西药(如阿托伐他汀类药物等)和中药(如银杏叶提取物等)。多位学者提出通过调节自身免疫可改善血管内膜炎症达到治疗AS的目的[2-3]。本研究探讨联合使用热休克蛋白60(heat shock protein 60,HSP60)及银杏叶提取物(Ginkgo biloba extract,GBE),中西医结合治疗AS的机制。
1 材料与方法
1.1 试剂仪器 GBE(每支17.5 mg/mL,含24%银杏黄酮苷,3.1%银杏内酯,2.9%白果内酯,德国威玛舒培博士药厂生产),HSP60 抗原(中国 北京博奥生生物技术公司)猪胆固醇每瓶25 g/瓶(中国 天津大茂化学试剂厂),猪胆盐每瓶10 g(中国 上海江莱生物科技有限公司),丙基硫氧嘧啶每瓶100 g(中国 苏州东瑞制药有限公司),猪油(自购),基础饲料(山西医科大学实验动物中心提供)维生素D3粉剂(饲料级)50万U/g(浙江花园生物高科股份有限公司),注射维生素D3针剂1 mL:7.5 mg,30万单位(中国 江苏吴中实业股份有限公司苏州第六制药厂),CD4FITC、CD25 APC、FOXP3 PE(美国 BDFarmige公司);PV-6001二步法免疫组化试剂盒(中国 北京中杉金桥生物技术公司);全自动多功能生化分析仪(日本罗氏Hitach公司),MIAS-2000图像分析系统(中国 四川川大智胜软件股份有限公司),流式细胞仪(型号:FACS Calibur.美国Becton-Dickinson,B-D公司)。
1.2 动物分组与给药方案 取出生后30 d(1月龄)SD雄性大鼠50只(山西医科大学实验动物中心提供),体重100 g±10 g。随机分为5组:健康对照组(C组),AS未干预组(AS组),HSP60干预组(H组),银杏叶提取物干预组(G组),联合干预组(H+G组),以上每组10只。 C组喂饲普通饲料,AS组、H组、G组、H+G组喂饲高脂饲料(2%胆固醇,0.2%猪胆盐,0.2%丙基硫氧嘧啶,10%猪油,87.6%基础饲料)和维生素D3粉剂(1.25×106U/kg饲料)120 d,建立AS大鼠模型,实验开始时于右下肢肌内注射维生素D3针剂(3×105U/kg体重),每隔30 d一次,动物自由饮水;于出生后150 d(即高脂饮食后120 d)各组停止高脂饮食,H组开始用HSP60(HSP60 10 μg溶于500 μLPBS液)灌胃,G组开始用GBE溶液400 μL(含GBE0.7 mg)和100 μLPBS液灌胃,H+G组用HSP60溶液(10 μg溶于100 μLPBS液)及GBE溶液400 μL共500 μL灌胃, C组、AS组仍以500 μLPBS液灌胃,每日一次,5个组均灌胃30 d,期间均采用普通饲料喂养;于出生后180 d统一眼眶动脉和静脉采血后处死,取大鼠主动脉根部标本。流式细胞技术检测血中 CD4+CD25+Foxp3+调节性 T 细胞(Treg)含量。免疫组织化学(IHC)检测主动脉根部CD36表达情况。
1.3 制作标本 石蜡切片后采用图像分析系统照相分析,观察各组大鼠主动脉病理改变,计算血管内膜(IT )与血管内径(ID )之比( IT / ID )。
1.4 免疫组化检测 采用PV-6001二步法免疫组织化学检测试剂盒(北京中山金桥生物技术公司)。用0.01 mol/L枸橼酸钠缓冲溶液(pH6.0),高压热修复;过氧化氢孵育;加兔抗大鼠CD36(北京博奥生生物技术公司)4℃过夜。使用效价为1∶200。次日加辣根过氧化物酶(HRP)标记山羊抗兔IgG抗体一HRP多聚体,37℃孵育30 min:二氨基联苯胺(DAB)显色,显微镜下控制显色时间。采用MIAS—2000型图像分析系统拍照,检测每个高倍视野(40×10)的目标平均灰度(Co)、视场平均灰度(Gv)和面积密度(AAR),计算阳性单位(PU),即Pu=[|Go—Gv|×100]/[(1-AAR)×Gmax],其中Gmax为最大灰度(255)。
1.5 血脂检测 采用酶比色法(GPO-PAP),严格按照试剂盒说明方法操作,取血清标本10 μL加入工作液1 mL,充分混匀各试剂管,37℃保温10 min,以试剂空白管较零,读取505 nm下的标准管和样品管吸光度。由公式计算其浓度。计算公式:血清总胆固醇浓度=样品管吸光度/标准管吸光度(mg/dL)
1.6 流式细胞仪( FCM )检测 流式细胞仪用前向角( Fsc )测向角( Ssc )设二维点图,用 Gate1 将淋巴细胞圈住,检测Gate1内细胞 10 000 个。获取荧光信号并分析数据,软件均使 用CELLQUEST 软件,用对数方式分别以 FL1 FL3,FL2 FL3作二维点图,检测 CD4、 CD25、 Foxp3 阳性率。

2 结 果
2.1 血脂检测结果(见表1) 各组血清总胆固醇(TC)在180 d时较30 d时有明显升高,依次为A组、H组、G组、H+G组、C组;A组和H组之间差别无统计学意义(P>0.05),但较G组、H+G组、C组升高均明显(P<0.05),H+G组和G组二者之间差别无统计学意义(P>0.05),但较C组为高,较A组和H组为低(P<0.05)。
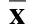
表1 各组不同时间血清总胆固醇水平比较(±s) mg/dL
2.2 苏木精-伊红染色(HE)染色结果 正常对照组大鼠主动脉光镜下见内皮细胞完整,内膜光滑,外膜、中膜和内膜分界清楚,中膜主要由呈同心排列的弹性纤维膜组成,基质内可见环形平滑肌细胞,内膜较薄,为疏松结缔组织,内含少量平滑肌细胞。高脂饮食实验组可形成AS斑块,AS组主动脉内膜增厚,平滑肌细胞增生,排列紊乱,部分血管内膜突起,淋巴细胞、炎性细胞、泡沫细胞浸润,肌纤维断裂,斑块形成斑块处可形成夹层动脉瘤,甚至斑块有破裂出血。各组主动脉血管内膜厚度与内径的比值。实验组主动脉血管内膜厚度与内径的比值较对照组均高(P<0.05); H组、G组、H+G组较动脉粥样硬化未干预组(A组)IT/ID值为低(P<0.05);但H组和G组之间差异无统计学意义(P>0.05),二者较H+G组均高(P<0.05)。详见表2。
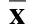
表2 主动脉血管内膜厚度与内径比值(±s) %
2.3 免疫组织化学结果 实验组较对照组CD36、NF-κB表达增高(P<0.05),干预组(H组、G组、H+G组)较A组表达均低(P<0.05),H组、G组较H+G组为高(P<0.05),但H组、G组之间差异无统计学意义(P>0.05)。详见表3。
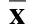
表3 各组主动脉CD36和NF-κB表达情况(阳性单位,Pu值) (±s)
2.4 流式细胞仪检测各组外周血CD4+CD25+Foxp3+Treg细胞含量 A组和G组CD4+CD25+Foxp3+Treg占CD4+T细胞比例较对照组(C组)为低(P<0.05),但A组与G组之间差异无统计学意义(P>0.05),H+G组和H组较C组、A组和G组为高(P<0.05),但H+G组和H组之间差异无统计学意义(P>0.05)。详见表4。
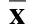
表4 各组外周血CD4+CD25+Foxp3+Treg细胞含量(±s)
3 讨 论
GBE是一种作用广泛的天然药物,其有效成分主要为黄酮苷类和银杏内酯类化合物,具有保护血管内皮细胞,拮抗血小板活化因子,扩张血管,改善血液循环等多种作用;此外,GBE还可以改善血液流变学、降低血液黏度,目前临床上广泛应用于心脑血管疾病的治疗,如缺血性心脏病、脑损伤、血管痉挛等[4-5]。
HSP60是一种主要由受刺激以及死亡的内皮细胞分泌和释放的蛋白,在动脉内皮细胞受外界因素如应激、高血压、感染等刺激时,可引起HSP60的表达,被树突状细胞、淋巴细胞所识别,从而触发自身免疫反应[6]。Xu等[7]调查发现,越来越多的证据表明HSP60与AS密切相关。
近年来,有研究通过口服抗原和口服芳香烃受体配体诱导叉头蛋白P3(Forkhead box p3,Foxp3)诱导型调节性T细胞(induced Treg,iTregs),可改善自身免疫性疾病和炎症性疾病动物模型的病情[8]。本研究通过口服HSP60抗原和银杏叶提取物,中西医结合干预动脉粥样硬化血管内膜炎症和增厚情况。

[1] Scherer DJ,Psaltis PJ. Future imaging of atherosclerosis: molecular imaging of coronary atherosclerosis with (18)F positron emission tomography[J].Cardiovasc Diagn Ther,2016,6(4):354-367.
[2] Rajaiah R,Moudgil KD.Heat-shock proteins can promote as well as regulate autoimmunity[J].Autoimmun Rev,2009,8(5):388-393.
[3] Usman A,Ribatti D,Sadat U,et al.From lipid retention to immune-mediate inflammation and associated angiogenesis in the pathogenesis of atherosclerosis[J].J Atheroscler Thromb,2015,22(8):739-749.
[4] Wei JM,Wang X,Gong H,et al.Ginkgo suppresses atherosclerosis through downregulating the expression of connexin 43 in rabbits[J].Arch Med Sci,2013,9(2):340-346.
[5] 陈维洲,张培智.银杏叶提取物的药理和临床研究进展(上)[J].中国新药与临床杂志,1999,18(5): 315-317.
[6] Almanzar G,Öllinger R,Leuenberger J,et al.Autoreactive HSP60 epitope-specific T-cells in early human atherosclerotic lesions[J].J Autoimmun,2012 ,39(4):441-450.
[7] Xu Q,Metzler B,Jahangiri M,et al.Molecular chaperones and heat shock proteins in atherosclerosi’s[J].Am J Physiol Heart Circ Physiol,2012,302(3):H506-514.
[8] Foteinos G,Xu Q.Immune-mediated mechanisms of endothelial damage in atherosclerosis[J].Autoimmunity,2009,42(7):627-633.
[9] Kutukculer N,Azarsiz E,Aksu G,et al.CD4+CD25+Foxp3+T regulatory cells,Th1 (CCR5,IL-2,IFN-γ) and Th2 (CCR4,IL-4,IL-13) type chemokine receptors and intracellular cytokines in children with common variable immunodeficiency[J].Int J Immunopathol Pharmacol,2016,29(2):241-251.
(本文编辑王雅洁)
山西省卫计委科技攻关项目(No.201301068 );山西省自然基金面上项目(No.201601D011119);山西省归国留学基金项目(No.2011-096);山西省基础研究计划(No.2010021034-4)
山西医科大学第一医院(太原 030001)
郝春艳,E-mail:haochunyan 68@126.com
R285.4
A
10.3969/j.issn.1672-1349.2016.24.013
1672-1349(2016)24-2893-04
2016-10-10)
引用信息: 段虎斌,郝春艳,刘翠明,等.热休克蛋白60联合银杏叶提取物对动脉粥样硬化大鼠血中调节性T细胞含量及主动脉根部巨噬细胞CD36表达的影响[J].中西医结合心脑血管病杂志,2016,14(24):2893-2896.

