乳腺癌前哨淋巴结活检假阴性相关因素的分析
王新昭, 刘兆芸, 徐娜娜, 卓培英, 王蕾蕾, 马清华, 于志勇
论 著
乳腺癌前哨淋巴结活检假阴性相关因素的分析
王新昭, 刘兆芸, 徐娜娜, 卓培英, 王蕾蕾, 马清华, 于志勇
目的 分析乳腺癌前哨淋巴结活检假阴性率的相关临床病理因素,探讨如何降低乳腺癌前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)的假阴性。方法 回顾性分析2012年1月至2015年12月山东省肿瘤医院645例乳腺癌并腋窝淋巴结清扫的临体资料。采用Log-rank行单因素分析,Cox比例风险模型行多因素分析。结果 645例中真阳性、真阴性及假阴性分别为59.4%、33.3%及9.2%。在所有假阴性病例中92.3%患者腋窝阳性淋巴结出现在Ⅰ和(或)Ⅱ水平。阴性预测值为96.4%,准确率为92.7%。单因素分析显示前哨淋巴结FN与ER表达、PR表达、HER2表达、分子分型及阳性淋巴结数目有关(均P<0.05),而发病年龄、是否绝经、Ki-67表达、SLN 检测方法及肿瘤大小在FN组及TP组无明显差异(均P>0.05)。其中ER表达(OR=0.303,P<0.05)、HER2表达(OR=9.594,P<0.05)以及阳性腋窝淋巴结数目(OR=0.409,P<0.05)是假阴性的独立影响因素。结论 对于ER阴性、PR阴性及HER2阳性的高危乳腺癌,术中清扫Ⅰ和(或)Ⅱ水平淋巴结可能更安全。
乳腺肿瘤; 前哨淋巴结活检; 假阴性; 腋窝淋巴结清扫
腋窝淋巴结转移是乳腺癌重要的预后因素,早期乳腺癌的淋巴结表达对手术方式选择及预后均具有重要的价值。前哨淋巴结(sentinel lymph node,SLN)是原发肿瘤引流区域淋巴结中的第一枚或一组淋巴结。如果SLN为阴性,那么其他淋巴结应该也为阴性。临床中我们根据前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)结果决定是否进一步行腋窝淋巴结清扫术(axillary lymph node dissection,ALND),SLNB为阴性,则可免行ALND。SLNB在20世纪90年代引入临床[1],试图替代ALND,但是由于SLN假阴性的存在,可能低估病情,增加复发风险。本文就如何降低乳腺癌SLNB假阴性做一探讨。
1 资料和方法
1.1 临床资料 收集2012年1月至2015年12月就诊于山东省肿瘤医院的乳腺癌病例,入组标准:(1)所有病例经SLNB后行ALND;(2)排除新辅助化疗后手术的病例;(3)既往腋窝未手术或放疗;(4)所有病例资料完整,免疫组化指标包括雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体(HER2)及Ki-67。乳腺癌分期依据2010版美国癌症联合委员会(AJCC)癌症分期指南。本研究符合山东省肿瘤医院伦理委员伦理要求。
1.2 方法 采用链霉素抗生物素蛋白-过氧化物酶法(SP)操作,检测指标包括ER、PR、HER2及Ki-67。ER、PR及Ki-67染色主要位于细胞核内,HER2染色主要位于细胞膜或细胞质。ER及PR阳性细胞比例≥1%定义为阳性[2]。Ki-67>20%定义为高表达。根据美国临床肿瘤学协会(ASCO)/美国病理医师学院(CAP)推荐标准将HER2分为HER2阳性,评分3+;HER2可疑阳性,评分2+;HER2阴性,评分0或1+。对可疑阳性的病例行原位荧光杂交(FISH)。根据2013年St Gallen国际乳腺癌会议专家共识,将乳腺癌分为四种分子亚型:(1)管腔A型(luminal A型):ER阳性、PR>20%[3]、HER2阴性及Ki-67≤20%;(2)管腔B(HER2阴性)型:ER阳性、HER2阴性、PR>20%[3]或Ki-67>20%;(3)管腔B(HER2阳性)型:ER及HER2阳性;(4)HER2过表达型:ER、PR阴性,HER2阳性;(5)三阴性(TNBC):ER、PR及HER2均阴性。
亚甲蓝(江苏济川药业集团股份有限公司)或卡纳琳(重庆莱美药业股份有限公司)与锝99(99mTc)硫胶体联合应用寻找SLN。术前3~20 h在乳腺肿瘤表面皮下注射99mTc硫胶体0.5~1.0 mCi/0.5~2.0 ml。术前15~30 min在乳晕下注射亚甲蓝(2 ml)或卡纳琳(1 ml)。我们采用γ探测仪检测SLN,记录术中放射强度。术中将超过热点强度10%的淋巴结定义为SLN。
1.3 统计分析 数据统计分析采用SPSS 17.0软件,根据Louisville大学SLNB技术标准,假阴性率(FNR)=FN/(FN+TP);阴性预测值(NPV)=TN/ALN阴性;准确率=(TP+TN)/ALN阳性。FN与TP两个样本率的比较采用χ2检验,单因素分析采用Log-rank检验,再将单因素分析有统计学意义的指标进行Cox比例风险模型回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般结果统计 共入组645例患者,中位年龄49岁(26~28岁),中位SLN数目是4枚(1~12枚),患者的临床资料详见表1。
2.2 前哨淋巴结FN与TP临床病理特点相关性分析 SLN阳性病例391例(60.6%),SLN阳性并腋窝淋巴结转移病例383例(59.4%),FN病例39例(9.2%),SLN阳性并腋窝淋巴结阴性病例8例(1.2%),SLN真阴性病例215例(33.3%),NVP为96.4% (215/223),准确率为92.7% (494/598)。
前哨淋巴结FN与ER表达、PR表达、HER2表达、分子分型及阳性淋巴结数目有关(均P<0.05),而发病年龄、是否绝经、Ki-67表达、SLN 检测方法及肿瘤大小在FN组及TP组无明显差异(均P>0.05),详见表2。
多因素Cox回归分析得出:ER表达(OR=0.303,P<0.05)、HER2表达(OR=9.594,P<0.05)及阳性淋巴结数目 (OR=0.409,P<0.05)是FN独立影响因素,见表3。

表1 645例乳腺癌患者的临床病理资料统计
*腺样囊性癌(1/21);微乳头状癌(4/21);混合癌(8/21);神经内分泌癌(2/21);筛状癌(3/21);大汗腺癌(2/21);印戒细胞癌(1/21)
2.3 不同水平的腋窝淋巴结转移的比较 在前哨淋巴结FN的病例中,仅Ⅰ水平阳性病例为56.4%,仅Ⅱ水平阳性病例为12.8%,仅Ⅲ水平阳性病例5.1%,Ⅰ及Ⅱ水平均阳性的病例为23.1%。Ⅰ水平和(或)Ⅱ水平阳性病例为92.3%(见表4)。
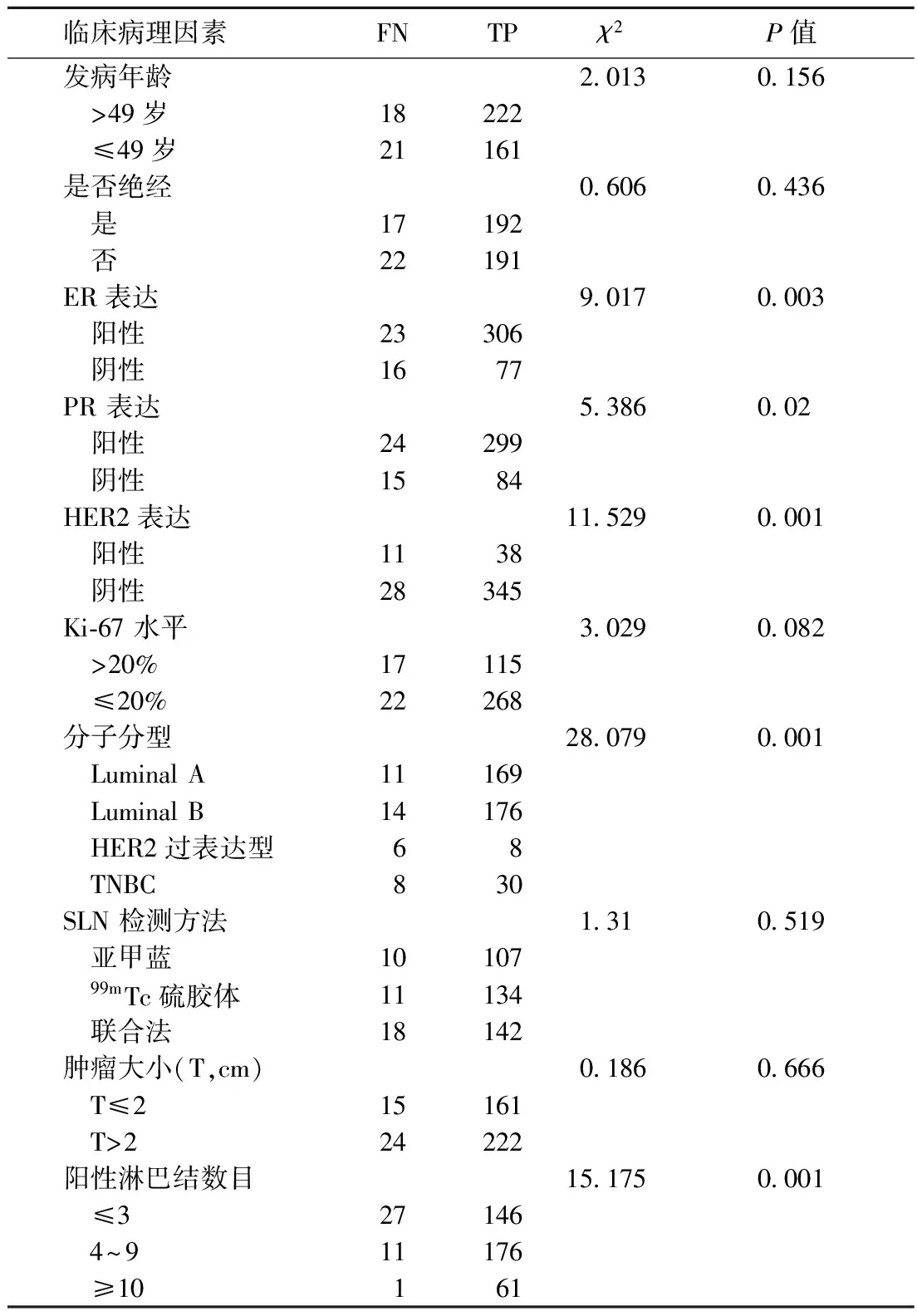
表2 前哨淋巴结FN与TP的临床病理特点相关性分析

表3 前哨淋巴结FN的Cox多因素分析
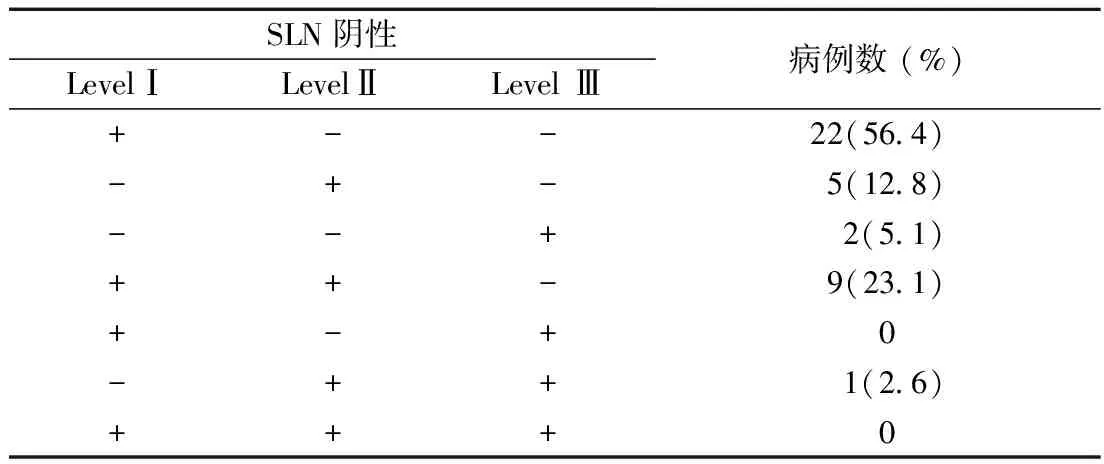
表4 FN乳腺癌中腋窝淋巴结不同水平的淋巴结情况
3 讨论
随着乳腺癌SLNB研究的不断深入,SLNB现已广泛应用于临床。因乳腺癌ALN很少发生跳跃性转移,Jatoi等[4]报道其转移率为3%~4%。通过SLNB能够准确了解ALN的状况。如SLN无肿瘤转移,腋窝其他淋巴结不应有转移或转移的可能性极小。美国NSABPB-32试验报道SLN切除术对于ALN阴性患者具有相同的总生存率、无病生存率和区域控制,同时上肢水肿、麻木及活动受限等ALND术后不良反应发生率大大减少[6]。目前,临床对乳腺癌治疗的共识是:对于SLN阴性的乳腺癌可以免行放疗。SLN假阴性而未行ALND,患者有可能在不久的将来复发,SLN假阴性问题也越来越受到重视。既往研究报道SLN假阴性率为4%~29%[7]。本研究假阴性率为9.2%,达到了大部分报道的平均水平。世界各地报道的FNR差异可能与外科医师熟练水平以及检测技术差别有关。本研究SLNB的准确率为92.7%,这与Pargaonkar等人[8]报道的接近。
本研究通过比较FN与TP,发现FN与ER阴性及PR阴性相关。Kim等人[9]研究称FN与激素受体相关。然而,Zavagno等人[10]报道称激素受体与FN无相关性,这可能与ER及PR的判定标准或种族差异有关。本研究中HER2过表达病例更易出现FN,可能是癌栓堵塞淋巴结系统破坏了淋巴正常引流,亦可能是由于巨噬细胞的吞噬功能减退,导致示踪剂不能正常汇入淋巴系统。
本研究还发现,检测到的腋窝淋巴结数目越多,出现FN的可能性越小。当检测到的SLN数目分别为1、2、3及4个时,SLN假阴性率分别为30.5%, 23.1%, 14.3% 及4.5%。随着检测出的SLN数目增多,SLNB假阴性率降低。既往有报道称SLN检出超过4个,SLN诊断的准确性明显提高[11]。本研究中SLN检出超过5个后,SLN假阴性消失。本研究中FN与示踪剂的注射方式无相关性,单纯亚甲蓝或99mTc或者二者联合应用均无显著性差异。
根据美国Z0011试验[12], T1~2期保留乳房乳腺癌、不超过2个SLN阳性、术后拟行放射治疗的患者是否行ALND对于5年总生存率无影响。由于SLN能够使患者获益并且可行,SLNB越来越被广泛接受。然而,外科医师应该尽最大努力降低SLN假阴性率,尤其是术后无需放疗的患者。对于FN的乳腺癌,我们发现腋窝阳性淋巴结多数出现在Ⅰ、Ⅱ水平,因此技术不熟练的外科医师或者设备条件落后的医院,对于存在SLNB假阴性高危因素的病例有必要行Ⅰ、Ⅱ水平腋窝淋巴结清除术。
降低SLNB假阴性是SLNB的重要步骤,只有降低FN率,外科医师才可以放心地省略ALND,因此,SLN的评估必须要准确。本研究中FN与ER、PR、HER2表达及分子分型有关,对于外科医师技术不熟练以及设备条件落后的医院,尽管SLN为阴性,Ⅰ、Ⅱ水平腋窝淋巴结清除术可能是更安全的措施。
[1] KRAG D N, WEAVER D L, ALEX J C, et al.Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe [J]. Surg Oncol, 1993, 2(6):335-339.
[2] HAMMOND M E, HAYES D F, DOWSETT M, et al. American society of clinical oncology/college of american pathologists guideline recommendations forimmunohistochemical testing of estrogen and progesterone receptors in breast cancer (unabridged version) [J]. Arch Pathol Lab Med, 2010, 134(7): e48-e72.
[3] PRAT A, CHEANG M C, MARTN M, et al. Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically definedluminal A breast cancer[J]. J Clin Oncol, 2013, 31(2):203-209.
[4] JATOI I.Management of the axilla in primary breast cancer [J].Surg Clin North Am, 1999, 79(5):1061-1073.
[5] KRAG D N,JULIAN T B, HARLOW S P, et al.NSABP-32: Phase III, randomized trial comparing axillary resection with sentinal lymph node dissection: a description of the trial[J]. Ann Surg Oncol, 2004, 11(3 Suppl):208S-210S.
[6] 卜宪才,曹苏生,王伟,等.前哨淋巴结活检术在早期乳腺癌保乳术中的应用[J].中国肿瘤外科杂志,2013,5(6):356-358.
[7] LYMAN G H, GIULIANO A E, Somerfield M R, et al.American society of clinical oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer[J]. J Clin Oncol, 2005, 23(30):7703-7720.
[8] PARGAONKAR A S, BEISSNER R S, SNYDER S, et al. Evaluation of immunohistochemistry and multiple-level sectioning in sentinel lymph nodes from patients with breast cancer[J].Arch Pathol Lab Med, 2003, 127(6):701-705.
[9] KIM B, VERGHESE E T, HORGAN K. Causes of false-negative sentinel node biopsy in patients with breast cancer[J]. Br J Surg, 2013, 100(10):1398-1399.
[10] ZAVAGNO G, DEL BIANCO P, KOUSSIS H, et al. Clinical impact of false-negative sentinel lymph nodes in breast cancer[J].Eur J Surg Oncol, 2008,34(6):620-625.
[11] ZAKARIA S, DEGNIM A C, KLEER C G, et al. Sentinel lymph node biopsy for breast cancer: how many nodes are enough[J]. J Surg Oncol, 2007, 96(7): 554-559.
[12] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel nodemetastasis: a randomized clinical trial [J].JAMA, 2011, 305(6):569-575.
Analysis of false negative correlation factors of sentinel lymph node biopsy in breast cancer
WANG Xinzhao1, LIU Zhaoyun1, XU Nana2, ZHUO Peiying1, WANG Leilei1, MA Qinghua1, YU Zhiyong1
(1.Department of Breast Surgery, Shandong Provincial Cancer Hospital Affiliated to Shandong University, Jinan 250117, China;2.Department of General Surgery, The Fifth People’s Hospital of Jinan, Jinan 250022, China)
YUZhiyong,E-mail:drzhiyongyu@aliyun.com
Objective To analyze the clinical and pathological factors of false negative rate of sentinel lymph node biopsy in breast cancer, and to explore how to reduce false negative of lymph node biopsy SLNB (sentinel) of breast cancer sentinel lymph node biopsy. Methods A retrospective analysis was made on 645 cases of breast cancer and axillary lymph node dissection in Shandong Provincial Cancer Hospital from January 2012 to December 2015, using Log-rank to carry on the single factor analysis, the Cox proportional hazard model carries on the multi factor analysis. Results Among 645 cases of breast cancer, positive, true negative and false negative were 59.4%, 33.3% and 9.2% respectively. Positive axillary lymph nodes were found in 92.3% of all false negative cases. The negative predictive value was 96.4% and the accuracy was 92.7%. Single factor analysis showed that: sentinel lymph node FN with the expression of Er, PR, HER2, molecular type and positive lymph node is related to the number (P<0.05), and age of onset, whether menopause, Ki-67 expression and SLN detection method and the size of tumor in the FN group and TP group no significant difference (P> 0.05). ER expression (OR=0.303,P< 0.05), HER2 expression (OR=9.594,P< 0.05) and positive axillary lymph node number (OR=0.409,P<0.05) are false negative independent influence factors. Conclusions For the patients with ER negative, PR negative and HER2 positive breast cancer, it may be a safe measure to clean the level of Ⅰ and / or Ⅱ lymph nodes during surgery.
Breast neoplasms; Sentinel lymph node biopsy; False negative; Axillary lymph node dissection
山东省医学科学院青年基金 (2015-58)
250117 山东 济南,山东大学附属山东省肿瘤医院 乳腺外科(王新昭、刘兆芸、卓培英、王蕾蕾、马清华、于志勇); 250022 山东 济南,济南市第五人民医院 外一科(徐娜娜)
王新昭,男,住院医师,研究方向:乳腺肿瘤的诊断与治疗,E-mail:08wangxinzhao@163.com
于志勇,男,主任医师,研究方向:乳腺肿瘤的诊断与治疗,E-mail:drzhiyongyu@aliyun.com
10.3969/j.issn.1674-4136.2016.05.004
1674-4136(2016)05-0294-04
2016-05-31][本文编辑:李 庆]

