艾迪注射液与肝动脉栓塞化疗联合治疗原发性肝癌的系统评价Δ
杨玉雪,何 璇,文建霞,吴明权,黄银秋,赵艳玲#,魏士长
(1.成都中医药大学药学院,四川 成都 611137; 2.成都市新都区石板滩镇卫生院药剂科,四川 成都 610511; 3.解放军第302医院药学部,北京 100039)
艾迪注射液与肝动脉栓塞化疗联合治疗原发性肝癌的系统评价Δ
杨玉雪1*,何 璇2,文建霞1,吴明权3,黄银秋3,赵艳玲3#,魏士长3
(1.成都中医药大学药学院,四川 成都 611137; 2.成都市新都区石板滩镇卫生院药剂科,四川 成都 610511; 3.解放军第302医院药学部,北京 100039)
目的:系统评价艾迪注射液与肝动脉栓塞化疗(transcatherter arterial chemoembolization,TACE)联合治疗原发性肝癌的疗效与安全性。方法:计算机检索维普资讯中文科技期刊数据库、中国期刊全文数据库、万方数据库、PubMed、Embase、Cochrane等,搜集艾迪注射液与TACE联合治疗原发性肝癌的随机对照研究,检索时间从建库至2016年7月。由2位研究者独立筛选文献、提取资料、评价文献质量。采用Cochrane系统评价方法,采用RevMan 5.0软件对所提取的数据进行文献荟萃(Meta)分析。结果:共纳入的19个研究、1 351例研究对象。Meta分析结果显示,与对照组(单纯TACE)比较,观察组方案(艾迪注射液联合TACE)可明显提高近期有效率、改善生活质量及临床症状、提高1年及2年生存率,差异均有统计学意义(P<0.05)。在减轻TACE所致不良反应方面,艾迪注射液与TACE联合治疗能显著减轻TACE治疗后骨髓抑制及肝损害,与对照组比较,差异有统计学意义(P<0.05);而对发热、胃肠道反应的缓解效果不明显。结论:与单纯TACE比较,艾迪注射液与TACE联合治疗原发性肝癌,可在一定程度上提高TACE治疗效果,提高患者的生活质量,并可在一定程度上缓解TACE所致不良反应。
艾迪注射液; TACE; 原发性肝癌; Meta分析
原发性肝癌是全球第5大常见的恶性肿瘤,在肿瘤致死原因中居第3位,全球每年有超过50万人患有肝癌,其中55%的患者出现在中国[1-3]。目前,治疗原发性肝癌的方法主要包括手术、肝动脉结扎、肝动脉栓塞化疗(transcatherter arterial chemoembolization,TACE)、射频、冷冻、激光、生物治疗以及中医药治疗等。其中,手术治疗是治疗肝癌的首选,但一些巨大肝癌无法Ⅰ期切除,可术前采用TACE、肝动脉结扎、局部冷冻等综合治疗方法,使肿瘤灶缩小后进行Ⅱ期手术治疗[4]。近年来,TACE已成为中、晚期原发性肝癌的首选治疗方法[5]。该技术诞生30年来,经不断完善和提高,目前已在全球得到广泛应用。但由于中、晚期恶性肿瘤患者本身对药物的敏感性降低,仅靠介入治疗往往难以奏效;并且,由于全身性化疗副作用大,栓塞后综合征如胃肠道反应和骨髓抑制等时有发生[6-7]。因此,需进行多学科综合治疗以达到控制病情、提高生活质量、延长生存期的目的。中医学认为,原发性肝癌多属“癓瘕”“积聚”“黄疸”“肝积”等病证范畴,主要病因为湿热、热毒、血瘀、气滞,根据辨证论治的治疗法则,中医在治疗肝癌的过程中,依据病情的需要,早期以攻毒祛邪为主,中期攻补兼施,晚期则以扶正为主[8-9]。艾迪注射液主要由斑蝥、人参、黄芪、刺五加等组成,具有清热解毒、消瘀散结的功效,主要用于原发性肝癌、肺癌、直肠癌、恶性淋巴瘤、妇科恶性肿瘤等。近年来,艾迪注射液与ACTE联合治疗原发性肝癌在临床上得到了广泛的应用,但却缺乏对其疗效和安全性的系统评价。为进一步探讨艾迪注射液与TACE联合治疗在原发性肝癌治疗中所发挥的作用,本研究采用文献荟萃(Meta)分析方法,对相关研究结果进行了合并,以评价联合用药的疗效。
1 资料与方法
1.1 文献检索策略
检索范围:维普资讯中文科技期刊数据库(维普)、中国期刊全文数据库(CNKI)、万方数据库(万方)、PubMed、Embase、Cochrane等。检索策略:中文检索词为“艾迪注射液+肝癌”;英文检索词为“aidi injection and liver cancer or hepatic carcinoma or hepatic tumor and ACTE”。检索时间:从建库至2016年7月。
1.2 文献纳入和排除标准
1.2.1 纳入标准:原始资料为已公开发表的文献,原始文献内容为艾迪注射液与TACE联合治疗原发性肝癌的随机对照研究;纳入研究对象为依据临床诊断标准确诊为原发性肝癌的患者,年龄、性别、病程不限;治疗措施,对照组单纯使用TACE,观察组在对照组基础上给予艾迪注射液治疗;结局指标至少应包含以下2种,肿瘤反应、生活质量卡氏(karnofsky,KPS)评分、临床症状改善、存活率、不良反应。
1.2.2 排除标准:综述、评论、动物实验、个案报道,以及非相关性研究;非随机对照研究;诊断标准不明确的研究;干预措施非艾迪注射液+TACE与单纯TACE比较;无相关结局指标或结局指标不足。
1.2.3 主要结局指标:肿瘤反应、KPS评分的变化、临床症状的改善、存活率、不良反应。
1.3 资料提取与文献质量评价
由2位研究者(杨玉雪、文建霞)独立阅读检索所获文献的题目和摘要,剔除明显不符合纳入标准的文献。对潜在符合纳入标准的文献进行全文阅读,依据纳入和排除标准确定是否最终纳入研究,并进行交叉核对。入选资料由该2位研究者分别摘录,资料提取的内容(第一作者、发表年份、样本量、相关结局指标)在资料提取之前讨论决定。文献质量评价按Cochrane评价手册Handbook 4.2.6中随机对照试验质量的标准进行分析[10-11]。评价内容包括:随机化方法、随机化隐藏、盲法、结果数据的完整性、选择性报告研究结果、其他偏倚来源等。结果用3种水平表示:低风险、高风险、不明确。
1.4 统计学方法
釆用Cochrane系统评价方法,通过统计软件RevMan 5.2进行统计学分析。计数资料二分变量及其比值比(odds ratio,OR)均以95%可信区间(confidence intervals,CI)表示。如果检验结果提示不存在统计学异质性(P≥0.1,I2≤50%),则采用固定效应模型进行合并分析;反之,则采用随机效应模型进行合并分析。
2 结果
2.1 文献筛选情况及纳入文献的基本特征
通过检索文献,共获得449篇关于艾迪注射液用于肝癌治疗的相关文献,经过阅读题目、摘要,剔除重复文献239篇及综述、评价、分析类文献51篇;进一步阅读全文后剔除不相关文章140篇,排除原因包括:包含肺癌、结肠癌等非肝癌研究,实验性研究,治疗手段及研究目的与本研究不符。最终纳入文献19篇[12-30],共1 351例研究对象,观察组(艾迪注射液联合TACE)、对照组(单纯TACE)病例数分别为698、653例。文献筛选流程见图1,纳入研究文献的基线信息见表1;纳入文献的基本特征见表1。

图1 文献筛选流程Fig 1 Document selection process
2.2 纳入文献的质量评价
釆用Cochrane系统评价方法,对纳入研究的文献分别进行随机方法、随机化隐藏、盲法、结果数据的完整性、选择性报告研究结果、其他偏倚等的评价,对其结果分别用“低风险”“高风险”“不明确”来表征,见图2。
2.3 Meta分析结果2.3.1 近期疗效:18篇文献[12-16,18-30]均提及近期肿瘤变化情况。各研究间不存在统计学异质性(P=0.32,I2=11%),采用固定效应模型进行Meta分析。结果显示,与单纯TACE比较,艾迪注射液与TACE联合治疗可明显提高原发性肝癌患者的近期有效率(OR=1.93,95%CI=1.51~2.46,P<0.000 01),见图3。
表1 纳入文献的基本特征
Tab 1 General characteristics of included literature
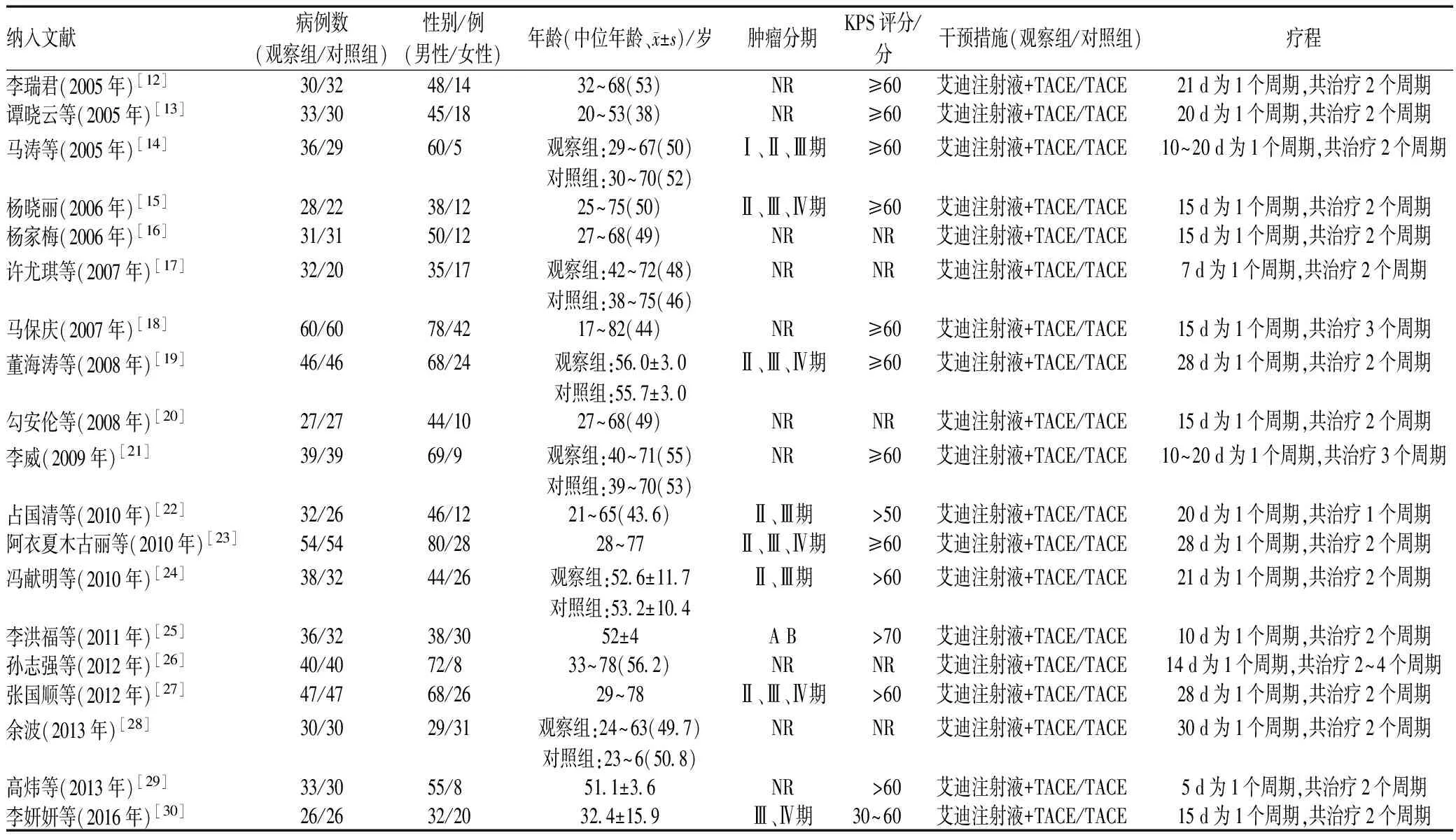
纳入文献病例数(观察组/对照组)性别/例(男性/女性)年龄(中位年龄、 x±s)/岁肿瘤分期KPS评分/分干预措施(观察组/对照组)疗程李瑞君(2005年)[12]30/3248/1432~68(53)NR≥60艾迪注射液+TACE/TACE21d为1个周期,共治疗2个周期谭晓云等(2005年)[13]33/3045/1820~53(38)NR≥60艾迪注射液+TACE/TACE20d为1个周期,共治疗2个周期马涛等(2005年)[14]36/2960/5观察组:29~67(50)对照组:30~70(52)Ⅰ、Ⅱ、Ⅲ期≥60艾迪注射液+TACE/TACE10~20d为1个周期,共治疗2个周期杨晓丽(2006年)[15]28/2238/1225~75(50)Ⅱ、Ⅲ、Ⅳ期≥60艾迪注射液+TACE/TACE15d为1个周期,共治疗2个周期杨家梅(2006年)[16]31/3150/1227~68(49)NRNR艾迪注射液+TACE/TACE15d为1个周期,共治疗2个周期许尤琪等(2007年)[17]32/2035/17观察组:42~72(48)对照组:38~75(46)NRNR艾迪注射液+TACE/TACE7d为1个周期,共治疗2个周期马保庆(2007年)[18]60/6078/4217~82(44)NR≥60艾迪注射液+TACE/TACE15d为1个周期,共治疗3个周期董海涛等(2008年)[19]46/4668/24观察组:56 0±3 0对照组:55 7±3 0Ⅱ、Ⅲ、Ⅳ期≥60艾迪注射液+TACE/TACE28d为1个周期,共治疗2个周期勾安伦等(2008年)[20]27/2744/1027~68(49)NRNR艾迪注射液+TACE/TACE15d为1个周期,共治疗2个周期李威(2009年)[21]39/3969/9观察组:40~71(55)对照组:39~70(53)NR≥60艾迪注射液+TACE/TACE10~20d为1个周期,共治疗3个周期占国清等(2010年)[22]32/2646/1221~65(43 6)Ⅱ、Ⅲ期>50艾迪注射液+TACE/TACE20d为1个周期,共治疗1个周期阿衣夏木古丽等(2010年)[23]54/5480/2828~77Ⅱ、Ⅲ、Ⅳ期≥60艾迪注射液+TACE/TACE28d为1个周期,共治疗2个周期冯献明等(2010年)[24]38/3244/26观察组:52 6±11 7对照组:53 2±10 4Ⅱ、Ⅲ期>60艾迪注射液+TACE/TACE21d为1个周期,共治疗2个周期李洪福等(2011年)[25]36/3238/3052±4AB>70艾迪注射液+TACE/TACE10d为1个周期,共治疗2个周期孙志强等(2012年)[26]40/4072/833~78(56 2)NRNR艾迪注射液+TACE/TACE14d为1个周期,共治疗2~4个周期张国顺等(2012年)[27]47/4768/2629~78Ⅱ、Ⅲ、Ⅳ期>60艾迪注射液+TACE/TACE28d为1个周期,共治疗2个周期余波(2013年)[28]30/3029/31观察组:24~63(49 7)对照组:23~6(50 8)NRNR艾迪注射液+TACE/TACE30d为1个周期,共治疗2个周期高炜等(2013年)[29]33/3055/851 1±3 6NR>60艾迪注射液+TACE/TACE5d为1个周期,共治疗2个周期李妍妍等(2016年)[30]26/2632/2032 4±15 9Ⅲ、Ⅳ期30~60艾迪注射液+TACE/TACE15d为1个周期,共治疗2个周期
注:“NR”表示未报道
Note:“NR” stands for not reported

图2 纳入文献的风险评估Fig 2 Risk assessment of included literature
2.3.2 KPS评分变化及临床症状改善:16篇文献[12-14,16-27,30]提及KPS评分提高情况,各研究间不存在统计学异质性(P=0.92,I2=0%),故采用固定效应模型进行Meta分析。结果显示,与对照组比较,观察组方案可显著提高患者的生活质量改善率(OR=3.47,95%CI=2.70~4.46,P<0.000 01),见图4(A)。11篇文献[14,16-17,19-20,22,24-27,30]提及KPS评分降低情况,各研究间不存在统计学异质性(P=0.73,I2=0%),故采用固定效应模型进行Meta分析。结果显示,与对照组比较,观察组方案可极显著降低患者生活质量下降率(OR=0.29,95%CI=0.20~0.41,P<0.000 01),见图4(B)。5篇文献[12-13,15,17,22]提及临床症状改善情况,各研究间不存在统计学异质性(P=0.92,I2=0%),故采用固定效应模型进行Meta分析。结果显示,与对照组比较,观察组方案可明显改善患者的临床症状(黄疸、肋痛、腹胀、纳差等)(OR=4.85,95%CI=2.79~8.42,P<0.000 01),见图4(C)。
2.3.3 生存率:5篇文献[19-20,22-23,27]提及1年生存率、4篇文献[19,22-23,27]提及2年生存率,各研究均不存在统计学异质性(P=0.86,I2=0%;P=0.99,I2=0%),故采用固定效应模型进行Meta分析。结果显示,观察组患者1年及2年生存率均明显优于对照组,差异均有统计学意义(OR=2.22,95%CI=1.48~3.32,P<0.001;OR=2.01,95%CI=1.22~3.30,P<0.001),见图5。
2.3.4 不良反应:对治疗过程中出现的不良反应进行统计,结果显示,主要不良反应包括发热、胃肠道反应(恶心呕吐、便秘、腹泻)、肝损害、白细胞计数降低、皮疹、肾损害等。3篇文献[13,17,30]比较了发热发生率,Meta分析结果显示,2组的差异无统计学差异(P=0.38),见图6(A),但出现发热的现象偏向于对照组患者,说明艾迪注射液与ATCE的联合应用有降低发热发生率的趋势。10篇文献[13-15,17-19,21,23,27,29]比较了骨髓抑制发生率,各研究间不存在统计学异质性(P=0.28,I2=18%),故采用固定效应模型进行Meta分析。结果显示,与对照组比较,观察组方案可明显降低骨髓抑制发生率(OR=0.40,95%CI=0.29~0.56,P<0.000 01),见图6(A)。5篇文献[17-18,22,29-30]比较了胃肠道反应发生率,Meta分析结果显示,观察组方案可降低胃肠道反应发生率,但与对照组的差异无统计学意义(P=0.41),见图6(B)。3篇文献[17-18,22]比较了肝损害发生率,Meta分析结果显示,与对照组比较,观察组方案可明显缓解TACE所致肝损害(OR=0.27,95%CI=0.11~0.67,P=0.005),见图6(C)。
2.4 发表偏倚评价
对纳入研究的近期疗效和KPS评分改善情况进行倒漏斗图分析,结果显示,近期疗效倒漏斗图对称性较差,表明纳入研究对近期疗效的报道存在发表偏倚可能,见图7(A);KPS评分改善情况倒漏斗图对称性良好,表明纳入研究对KPS评分改善情况的报道存在发表偏倚的可能性较小,见图7(B)。

图3 2组患者近期有效率比较的Meta分析森林图Fig 3 Comparison of meta-analysis forest plot of the short-term effective rate between two groups

A.KPS评分提高;B.KPS评分降低;C.临床症状改善A.increase of KPS;B.decrease of KPS;C.improvement of clinical symptoms图4 2组患者KPS评分变化及临床症状改善比较的Meta分析森林图Fig 4 Comparison of meta-analysis forest plot of changes of KPS score and improvement of clinical symptoms between two groups

图5 2组患者1年及2年生存率比较的Meta分析森林图Fig 5 Comparison of meta-analysis forest plot of one-year and two-year survival rate between two groups

A. 发热及骨髓抑制;B.胃肠道反应;C.肝损害A.fever and myelosuppression;B.gastro-intestinal tract response;C.liver damage图6 2组患者不良反应发生率比较的Meta分析森林图Fig 6 Comparison of meta-analysis forest plot of incidence of adverse drug reactions between two groups
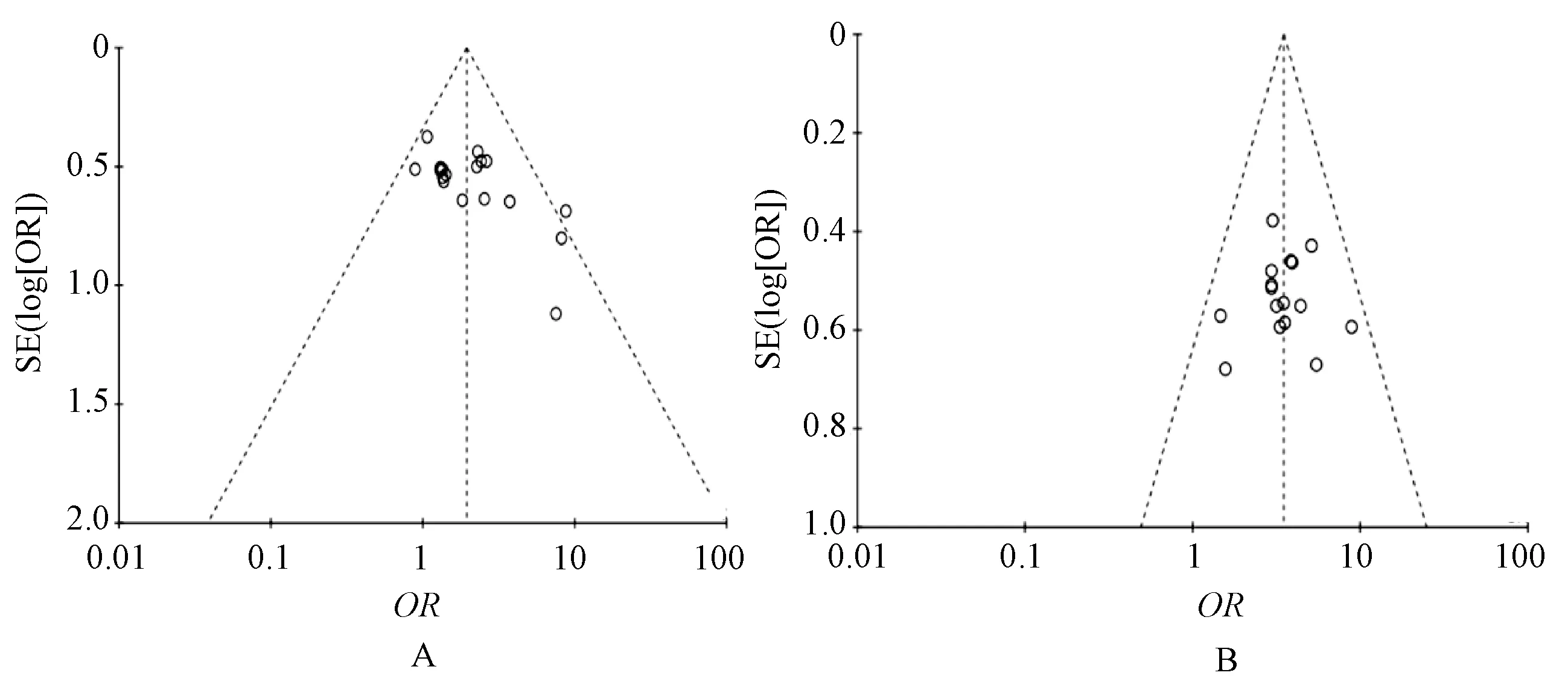
A.近期疗效;B.KPS评分改善情况A.short-term efficacy;B.improvement of KPS score图7 发表偏倚倒漏斗图Fig 7 Funnel plot of publication bias
3 讨论
艾迪注射液组方以斑蝥为君药,斑蝥素为斑蝥的主要成分,也是抗恶性肿瘤的有效成分,其在抑制肿瘤细胞的同时却不降低周围血中的白细胞数量,对机体无明显免疫抑制作用;人参、黄芪、刺五加为佐药,属扶正固本类药物,不仅能诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖、抑制肿瘤血管生成,同时能够提高机体免疫功能[31]。故艾迪注射液具有扶正祛邪的双重功效,在临床上被广泛用于肝癌、肺癌、直肠癌、恶性淋巴瘤和妇科恶性肿瘤等的治疗,也可作为恶性肿瘤患者化疗辅助用药,在提高患者生活质量的同时可减少化疗的不良反应。
本研究采用Meta分析方法对艾迪注射液与TACE联合治疗原发性肝癌的临床疗效进行系统评价,并通过比较观察组与对照组患者不良反应发生率来阐明艾迪注射液在减少TACE所致不良反应方面的作用。本研究纳入19篇文献、1 351例患者(观察组698例,对照组653例)中,观察组患者近期瘤体有效率为53.87%,对照组为42.42%。Meta分析结果显示,艾迪注射液与TACE联合治疗原发性肝癌的有效率明显高于单纯TACE治疗(OR=1.93,95%CI=1.51~2.46,P<0.000 01),其中OR=1.93,可以认为观察组方案对原发性肝癌的有效率是对照组的1.93倍。对KPS评分变化进行Meta分析的结果显示,在TACE基础上联合应用艾迪注射液可明显提高患者的生活质量(OR=4.85,95%CI=2.79~8.42,P<0.000 01),同时能显著降低生活质量下降率(OR=0.29,95%CI=0.20~0.41,P<0.000 01)。临床症状方面,Meta分析结果显示,观察组方案可明显提高临床症状缓解率(OR=3.47,95%CI=2.70~4.46,P<0.000 01),为对照组的3.47倍。随访患者1年及2年生存率的Meta分析结果显示,观察组患者1年及2年生存率明显高于对照组,OR(95%CI)分别为2.22(1.48~3.32)、2.01(1.22~3.30),P均<0.001。不良反应发生率的Meta分析结果显示,艾迪注射液可明显降低TACE所致骨髓抑制及肝损害的发生率(OR=0.40,95%CI=0.29~0.56,P<0.000 1;OR=0.27,95%CI=0.11~0.67,P=0.005),并有降低胃肠道反应及发热发生率的趋势,但2组的差异无统计学意义。
4 结论
本研究遵循循证医学相关研究结果,采用Meta分析方法对收集到的艾迪注射液与TACE联合治疗原发性肝癌的随机对照研究结果进行合并分析,结果表明,与单纯TACE治疗比较,艾迪注射液与TACE联合治疗可明显提高原发性肝癌患者的生活质量,具体表现为:提高近期有效率、改善生活质量及临床症状、提高1年及2年生存率,同时降低不良反应发生率。但本研究因样本量过小而存在一定的局限性,并且因所纳入研究的报道在随机性、隐藏随机化及盲法上存在偏倚,故研究结果存在一定的发表偏倚。因此,今后有必要开展更多高质量的多中心、大样本、前瞻性的随机、双盲临床试验验证。
[1]El-serag HB.Hepatocelluar carcinoma[J].N Engl J Med,2011,365(12):1118-1127.
[2]莫春梅,荣震,胡振斌,等.中医药治疗原发性肝癌介入术后(TACE)综合征研究进展[J].辽宁中医药大学学报,2012,14(11):75-77.
[3]Qin S,Bai Y,Lim HY,et al.Randomized,multicenter,open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia[J].J Clin Oncol,2013,31(28):3501-3508.
[4]陈文卿.中药联合TACE治疗原发性肝癌临床研究Meta分析[D].广州:广州中医药大学,2014.
[5]周滢,周萍.邓中甲教授治疗肝癌经验分析[J].中国实验方剂学杂志,2012,18(2):260-261.
[6]杨秉辉,丛文铭,周晓军,等.原发性肝癌规范化诊治专家共识[J].临床肿瘤学杂志,2009,14(3):259-269.
[7]李勃,许晓莲.肝动脉化疗栓塞联合重组人血管内皮抑制素介入治疗原发性肝细胞癌[J].中国肿瘤,2012,21(6):466-468.
[8]胡正操,陈素梅,卢冠铭,等.艾迪注射液治疗晚期原发性肝癌的近期疗效分析[J].右江医学,2011,39(4):424-425.
[9]杨柳青,秦叔逵,龚新雷,等.索拉非尼治疗国人中晚期原发性肝癌的临床研究[J].中国新药杂志,2013,22(17):2053-2059.
[10] Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary[J].Control Clin Trials,1996,17(1):1-12.
[11] Deeks JJ,Higgins JPT,Altman DG,et al.Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [Z].http://www.cochrane-handbook.org.
[12] 李瑞君.艾迪注射液联合肝动脉介入治疗原发性肝癌疗效观察[J].中原医刊,2005,32(24):69.
[13] 谭晓云,龚红卫.艾迪注射液配合肝动脉化疗及栓塞治疗原发性肝癌临床疗效观察[J].肿瘤防治研究,2005,32(5):313-314.
[14] 马涛,王宁菊.艾迪注射液联合肝动脉介入治疗原发性肝癌的临床研究[J].肿瘤防治研究,2005,12(7):538-540.
[15] 杨晓丽.艾迪注射液联合介入治疗中晚期肝癌28例[J].中医研究,2006,19(7):30-32.
[16] 杨家梅.艾迪注射液配合介入栓塞治疗原发性肝癌[J].医药论坛杂志,2006,27(20):26-27.
[17] 许尤琪,丁蓉,徐建伟,等.艾迪注射液联合介入治疗原发性肝癌32例临床观察[J].时珍国医国药,2007,18(9):2238-2239.
[18] 马保庆.肝动脉化疗栓塞术联合艾迪注射液治疗原发性肝癌[J].中原医刊,2007,34(17):44-45.
[19] 董海涛,贺用和,卢雯平,等.艾迪注射液联合肝动脉介入治疗原发性肝癌33例临床观察[J].中国中医药信息杂志,2007,14(12):62-63.
[20] 勾安伦,吴英宝.艾迪注射液配合介入栓塞治疗肝癌27例[J].江西中医药,2008,39(12):24.
[21] 李威,李大伟.艾迪在肝癌介入治疗中的应用[J].今日科苑,2009(12):277.
[22] 占国清,郑三菊,朱琳,等.艾迪注射液联合肝动脉化疗栓塞治疗原发性中晚期肝癌[J].肿瘤防治研究,2010,37(3):364-365.
[23] 阿衣夏木古丽,柳江.艾迪注射液联合肝动脉灌注栓塞治疗原发性肝癌108例临床观察[J].现代肿瘤医学,2011,19(1):111-114.
[24] 冯献明,付方现,刘俊叶,等.艾迪注射液联合5-氟尿嘧啶加顺铂化疗方案治疗中晚期肝癌[J].新乡医学院学报,2010,27(3):273-275.
[25] 李洪福,李炳华.肝动脉关注栓塞化疗联合艾迪介入治疗中晚期肝癌患者的临床疗效[J].中国实用医刊,2011,39(19):39-40.
[26] 孙志强,刘正丽.艾迪注射液联合肝动脉化疗栓塞治疗中晚期原发性肝癌临床疗效观察[J].中国实用医药,2012,7(33):119.
[27] 张国顺,张文缓,马利转,等.艾迪注射液联合肝动脉介入治疗原发性肝癌的临床研究[J].现代预防医学,2012,39(5):1253-1255.
[28] 余波.艾迪注射液联合肝动脉栓塞化疗治疗原发性肝癌临床观察[J].肝脏,2013,18(7):499-501.
[29] 高炜,徐艳霞,梁华.艾迪注射液联合TACE技术治疗中晚期原发性肝癌的临床观察[J].中国医学创新,2013,10(17):24-25.
[30] 李妍妍,周乐兴,任瑞娟,等.中医药治疗晚期原发性肝癌的临床观察[J].中国现代药物应用,2016,10(6):243-244.
[31] 徐洁,居文政,谈恒山.艾迪注射液药理作用与临床应用研究概况[J].药学与临床研究,2012,20(1):48-52.
Meta-analysis on Aidi Injection Combined with Transcatheter Arterial Chemoembolization in Treatment of Primary Liver CancerΔ
YANG Yuxue1, HE Xuan2, WEN Jianxia1, WU Mingquan3, HUANG Yinqiu3, ZHAO Yanling3, WEI Shizhang3
(1.Pharmacy College, Chengdu University of Traditional Chinese Medicine, Sichuan Chengdu 611137, China; 2.Dept.of Pharmacy, Xindu District Shibantan Public Hospital, Sichuan Chengdu 610511, China; 3.Dept.of Pharmacy, 302 Military Hospital of People’s Liberation Army, Beijing 100039, China)
OBJECTIVE:To systematically review the efficacy and safety of Aidi injection combined with transcatheter arterial chemoemboIization(TACE) in treatment of primary liver cancer. METHODS: VIP data base, CNKI, Wanfang data base, PubMed, Embase and Cochrane were retrieved by computers to collect the RCT s of Aidi injection combined with TACE in treatment of primary liver cancer till Jul. 2016. After two reviewers separately screened literature according to the inclusion and exclusion criteria, extracted data and assessed the quality of the included studies, data were analyzed with RevMan 5.3 software by Cochrane. RESULTS: Totally 19 RCTs were included with 1 351 patients involved. According to Meta-analysis, compared with control group (TACE monotherepy), the total effective rate, living quality, clinical manifestation, one-year and two-years living rate were superior in the observation group (Aidi injection combined with TACE), the difference was statistically significant(P<0.05). As for the adverse drug reactions induced by TACE, Aidi injection combined with TACE can significantly reduce the myelosuppression and the liver injure after treatment; compared with the control group, the difference was statistically significant(P<0.05). However, the relief effects were not obvious in pyrexia and alimentary tract. CONCLUSIONS: Compared with TACE monotherapy, Aidi injection combined with TACE in treatment of primary liver cancer can improve the treatment effects to some extent, improve patients’ life quality and relieve the adverse reactions induced by TACE.
Aidi injection; TACE; Primary liver cancer; Meta-analysis
国家自然科学基金资助项目(No.8157141615)
R979.1
A
1672-2124(2016)12-1588-06
2016-09-07)
*在读硕士研究生。研究方向:临床中药学。E-mail:2691679013@qq.com
#通信作者:主任药师,博士,研究员,博士生导师。研究方向:中药药性理论与配伍。E-mail:zhaoyl2855@126.com
DOI 10.14009/j.issn.1672-2124.2016.12.002

