高压氧联合依达拉奉对大鼠脑梗死区AQP9的影响
宋乃光 孙晶晶(通讯作者) 张耀龙 孙彩悦 薛 建 李海鹏 贺永贵 习瑾琨 张国彬
河北唐山市协和医院 1)急诊科 2)神经内科 3)B超室 唐山 063000 4)河北联合大学培养办公室 唐山 063000
·论著·
高压氧联合依达拉奉对大鼠脑梗死区AQP9的影响
宋乃光1)孙晶晶2)(通讯作者) 张耀龙1)孙彩悦2)薛 建2)李海鹏3)贺永贵4)习瑾琨4)张国彬4)
河北唐山市协和医院 1)急诊科 2)神经内科 3)B超室 唐山 063000 4)河北联合大学培养办公室 唐山 063000
目的 探讨高压氧联合依达拉奉对脑梗死大鼠AQP9表达及脑水肿的影响。方法 建立老年SD大鼠大脑中动脉闭塞(MCAQ)模型,随机分为4组:对照组、依达拉奉组、高压氧组和联合组,每组20只。对各组大鼠进行神经功能评分,检测大鼠脑组织内AQP9基因及蛋白的表达、梗死脑组织的含水量,并进行HE染色,观察病理学变化。结果 各组大鼠神经功能缺损评分比较显示,联合组明显低于对照组、依达拉奉组及高压氧组;RT-PCR及Western blot检测表明,联合组AQP9的mRNA蛋白表达及梗死区脑组织含水量明显低于脑梗死组、依达拉奉组及高压氧组(P<0.05);HE染色结果显示,高压氧组、依达拉奉组较对照组炎性浸润及水肿减轻,联合组比高压氧组、依达拉奉组又有明显缓解。结论 高压氧联合依达拉奉治疗可促进脑梗死大鼠神经功能的恢复。
脑梗死;高压氧;依达拉奉;脑水肿;AQP9
脑梗死是严重威胁人们身体健康的一种脑血管疾病,多见于老年患者,近些年来发病率逐渐上升,发病年龄也逐渐年轻化[1-2]。目前医学界对脑梗死的有效预防及治疗仍是重要的研究课题。多项研究结果均表明,兴奋性氨基酸、自由基、Ca2+超载等在脑组织的缺氧缺血损害中发挥着重要作用[3-5]。依达拉奉作为一种治疗脑梗死的新型自由基清除剂,国内外大量实验及临床研究均证明了其治疗脑梗死的安全性及有效性[6]。随着科学技术的进步,高压氧作为一门独立学科,可对多种疾病产生治疗作用,与其他方法联合应用会具有更好的疗效[7-9]。本实验旨在探讨高压氧联合依达拉奉对脑梗死老年SD大鼠AQP9表达及脑水肿的影响,现报道如下。
1 材料和方法
1.1 材料 (1)设计:随机对照动物实验。(2)时间及地点:2014-01—2015-02,于华北煤炭医学院实验室完成。(3)实验动物:健康老年SD大鼠83只,鼠龄:24个月,雌雄不限,体质量250~600 g,于恒温下饲养,自由饮水和进食,实验前1 d禁食不禁水。本实验中对动物模型的处置方法以动物伦理学为依据。83只老年SD大鼠购自华北煤炭医学院动物实验室,动物质量合格证号:SCXK﹙京﹚2009-0004。主要试剂、仪器及来源见表1。
1.2 实验方法
1.2.1 动物模型的建立和分组:将83只老年SD大鼠以4%异氟醚吸入麻醉,均保留自主呼吸。取颈部正中作一纵行切口,逐层分开,游离右侧的颈总及颈内、颈外动脉,于颈总动脉近端分叉处作一“V”字形切口,将多聚赖氨酸处理过的1.8#鱼线经切口插入右颈内动脉[进线深度(18±0.5 mm)],阻断大脑中动脉起始段的所有血液供应,建立大鼠脑梗死模型。成功的模型标志为大鼠出现右侧Horner征。分组:将83只大脑中动脉阻塞(MCAQ)大鼠模型按随机区组设计分成4组:对照组、依达拉奉组、高压氧组和联合组,每组均为20只。于脑梗死组大鼠尾静脉注射PBS;依达拉奉组静滴依达拉奉30 mg,2次/d;高压氧组进行高压氧治疗1次/d,压力:0.22 MPa,时间:80 min;联合组使用依达拉奉联合高压氧治疗,共治疗21 d。
1.2.2 大鼠mNSS神经行为学功能评分:本实验采取改良神经功能缺损评分内容及标准(mNSS):评分内容包括运动、感觉、反射和平衡4个部分的评分,总分共18分,正常大鼠评分0分,评分越低,说明大鼠的神经行为学功能越好,反之,神经功能障碍越严重。本实验分别对各组大鼠在治疗后的1周、2周及3周进行了mNSS评分,以分值为10~12分的大鼠进入实验。
1.2.3 RT-PCR检测:AQP9-mRNA 的表达:于治疗后10 d分别在各组中随机取5只大鼠的脑梗死组织50 mg,制备匀浆,应用Trizol试剂[10]提取脑梗死组织总的RNA ,应用紫外分光光度仪测定RNA含量,按照M-MLV 试剂盒中步骤,将RNA 反转录为cDNA,再将cDNA 进行PCR,AQP9(305 bp)引物序列:上游5′-CCAGCTGTGATTCCAAAACGGAC-3′,下游5′-TCTAGTCATACTGAAGACAATACCTC-3′;β-actin(175 bp)上游5′-CCATCATGAAGTGTGACGTTG-3′,下游5′-ACAGAGTACTTGCGCTCAGGA-3′。取PCR扩增产物进行电泳,采用凝胶图像分析系统对电泳结果进行光密度分析,计算AQP9产物与β-actin产物的光密度积分比值,作为AQP9-mRNA 的表达。

表1 主要试剂、仪器及来源
1.2.4 Western Blot检测:AQP9-蛋白的表达:于治疗后10 d将上述RT-PCR的提取物离心30 min,取上清为粗体蛋白质,以Bradford法对AQP9-蛋白进行浓度测定。以5%浓缩胶40 V持续衡压1 h,以10%分离胶60 V持续恒压3.5 h,湿转14 V持续恒压14 h,于37 ℃下摇床封闭2 h,再进行3次10 min的洗膜,以1:200 比例将AQP9单克隆抗体稀释溶于TBST 中,室温下培育60 min;采用TBST洗涤缓冲液行3次10 min的洗膜后,置入1:500稀释的辣根酶标记的兔抗鼠抗体。于室温下培育60 min;用TBST行3次10 min的洗膜。通过TBS洗膜10 min后再行DAB显色,以Bio-Rad 凝胶成像分析系统扫描吸光度值,应用Quantity One软件分析,根据β-actin条带与目的条带的吸光面积比值测量蛋白的表达水平。
1.2.5 HE染色:脑梗死模型建立后3 d、10 d,在各组内随机取5只大鼠,水合氯醛麻醉下处死,取梗死处脑组织置于10%多聚甲醛液中,室温下固定24 h。用切片机进行脑组织标本皮层连续冠状切片,片厚3~4 μm,置60 ℃烤箱内恒温4~6 h,使切片紧密黏附,常规脱蜡后蒸馏水洗2 min,伊红染色1~2 min,中性树脂胶封片,于室温下干燥,荧光显微镜观察脑组织病理学形态变化,以证实恢复程度。
1.2.6 应用干湿比重法测量脑组织含水量:将梗死脑组织放置于称重过的铝箔上测得标本质量,用所测得质量减铝箔质量即为脑质量,将以铝箔包好的脑组织置于恒温烤箱内烘干(恒温烤箱温度95 ℃,时间24 h),烘干后取出脑组织,待其自然降温恢复到室温后所测得的质量即为脑干质量,按干湿比重法,求出脑组织含水量。脑组织含水量(%)=(脑湿质量-脑干质量)/脑湿质量×100%。

2 结果
2.1 大鼠神经行为学功能评分比较 于治疗后3周,进行大鼠神经功能缺损评分比较,高压氧组及依达拉奉组的神经功能缺损评分明显低于对照组,而联合组又明显低于高压氧组及依达拉奉组,各组间比较差异有统计学意义(P<0.05)。见表2、图1。

表2 各组大鼠不同时间点的神经功能评分±s)
注:联合组的神经功能缺损评分明显低于其余各组,P<0.05
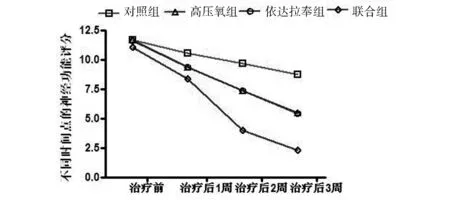
图1 各组大鼠不同时间点的神经功能评分
2.2 RT-PCR检测结果 建立模型后10 d脑梗死周围组织AQP9 mRNA的表达变化:高压氧组、依达拉奉组明显低于对照组,联合组又明显低于高压氧组、依达拉奉组,各组间差异有统计学意义(P<0.05)。见图2。

图2 AQP4-mRNA 的表达
2.3 Western blot检测结果 建立模型后10 d脑梗死周围组织AQP9蛋白的表达变化:高压氧组、依达拉奉组明显低于对照组,联合组又明显低于高压氧组、依达拉奉组,差异有统计学意义(P<0.05)。见图3。

图3 AQP4-mRNA 电泳图
2.4 HE染色观察结果 HE染色后,镜下观察到:对照组病理切片:梗死灶可见许多苍白球样改变、可见开始增生的胶质细胞以及形成的胶质瘢痕,局部出现液化变软病灶,水肿周围脑组织有炎性细胞浸润,脑组织水肿明显。见图4A。高压氧组、依达拉奉组病理切片:水肿、炎性细胞浸润减轻,增生的胶质细胞以及胶质瘢痕开始减轻,软化灶和组织瘢痕小于脑梗死组,但大于联合组。见图4B、C。联合组病理切片显示:炎性细胞浸润显著减轻,胶质瘢痕进一步减少,软化灶消失,苍白球样梗死灶明显减轻,水肿几乎消失。见图4D。

图4 A:可见增生的胶质细胞、胶质瘢痕,局部软化病灶;B、C:增生的胶质细胞以及胶质瘢痕及水肿减轻;D:梗死灶明显减轻,脑组织水肿几乎消失
2.5 各组梗死脑组织的含水量比较 脑梗死组内的大鼠在各时间点的脑组织水肿程度比较,差异无统计学意义(P>0.05),高压氧组、依达拉奉组与对照组在不同时间点脑组织水肿程度比较有差异统计学意义(P<0.05);联合组在各时间点梗死区脑组织水肿程度明显轻于对照组、依达拉奉组及高压氧组,差异有统计学意义(P<0.05)。见表3。

表3 各组在不同时间点大鼠脑组织水肿程度 比较,%)
注:组间比较,P<0.05
3 讨论
脑梗死作为神经学科常见病,具有高病死率、高致残率等特点[11-12],早发现、早治疗具有重要意义[13-16]。神经保护剂在脑梗死早期治疗中是较为有效的一个手段,脑梗死发生后,过度产生的自由基拥有高度的氧化活性,能致使脑细胞发生氧化应激性反应而造成细胞损害甚至死亡[17-22]。依达拉奉作为脑梗死的一种较强的自由基清除剂和神经保护剂,可以通过清除各种自由基、减轻血管内皮细胞的损伤、抑制脂质过氧化、降低脑组织因缺氧及再灌注导致的损害等多种作用机制中发挥神经元保护作用。
高压氧在多种疾病的治疗中具有不同程度的治疗效应,为各类疾病的治疗开拓了广阔的空间,近年报道较多[23-26]。研究表明[27-29],高压氧可通过促进溶栓、减轻炎性反应、提高脑组织氧张力、提高毛细血管间的氧分压梯度、减轻脑梗死灶细胞凋亡、促进氧自由基的清除能力等以上多种途径产生促使脑神经功能恢复的作用[30]。高压氧以其特殊的、无可比拟的供氧形式,能够促使缺氧脑组织的血氧含量迅速增加到正常情况的十几倍,进而快速调整机体氧化-抗氧化系统的平衡。
本研究中将依达拉奉与高压氧联合应用,从对老年SD大鼠的治疗效果中观察到,联合组大鼠神经功能学评分明显优于对照组、依达拉奉组及高压氧组,表明二者联合应用效果大于单独应用;RT-PCR及Western blot检测结果显示,联合组中,AQP9的mRNA及其蛋白表达明显低于脑梗死组、依达拉奉组及高压氧组,表明依达拉奉和高压氧均可降低梗死组织中AQP9的mRNA及蛋白的表达,二者的联合应用使治疗效果更佳;联合组在各时间点梗死区脑组织含水量明显低于对照组、依达拉奉组及高压氧组,高压氧组、依达拉奉组与对照组在不同时间点脑组织含水量比较均差异有统计学意义,提示联合应用对减轻脑水肿的疗效更明显;HE染色结果观察到,大鼠脑水肿周围组织炎性细胞浸润及水肿情况比较,高压氧组、依达拉奉组较对照组减轻,联合组又较高压氧组、依达拉奉组有明显缓解,表明依达拉奉和高压氧对脑组织病理变化都可起到恢复作用,将二者联合应用后其治疗效果更为可观。
综上所述,依达拉奉作为一种新型的脑神经保护剂和自由基清除剂,对脑梗死的疗效确切。高压氧的早期应用能延长梗死灶神经细胞的生存能力,二者联合应用可对老年SD大鼠脑梗死的综合治疗争取时间,可明显减轻脑梗死后的脑组织损害,亦能够更好地促进梗死后脑神经功能的恢复。
[1] 刘启军.依达拉奉治疗脑梗死的疗效观察[J].实用心脑肺血管病杂志,2014,22(11):135-137.
[2] Edaravone Acute Infarction Study Group.Effect of a noval free radical scavenger,edaravone on acute brain infarction.Randomized placebo-controlled,double-blindstudy at multicenters[J].Cerebrovasc Dis,2013,15(3):222-229.
[3] Ansara AJ,Nisly SA,Arif SA,et al.Aspirin dosing for the prevention and treatment of isehemic stroke:an indication-specifi c review of the literature[J].Ann Pharma-cother,2010,44(5):851-862.
[4] Li J,Liu W,Ding S,et al.Hyperbaric oxygen preconditioning induces tolerance against brain ischemia-reperfusion injury by upregulation of antioxidant enzymes in rats[J].Brain Res,2008,19(6):223-229.
[5] 闫海清,依达拉奉治疗脑梗死疗效观察[J].中国医药导报,2009,6(6):160-161.
[6] Goto H,Fujisawa H,Oka F,et al.Neurotoxic effects ofexogenous recombinant Tissue-type plasminogen activator on the normal rat brain[J].J Neurotrauma,2007,24(4):745-752.
[7] 韦廷求.依达拉奉对急性脑出血患者再灌注损伤的临床疗效观察[J].药物评价研究,2012,35(2):124-125.
[8] Zhang N,Komine-Kobaysshi M,Tanaak R,et al.Edaravone reduce early accumulation of oxidative products and sequential inflammatory responses after transient focal ischemia in mice brain[J].Stroke,2005,36(10):2 220-2 225.
[9] Yagi K,Kitazato KT,Uno M,et al.Edaravone,a free radical scavenger,inhibits MMP-9-related brain hemorrhage in rats treated with tissue plasminogen activator[J].Stroke,2009,40(2):626-631.
[10] 杨智,程春凤,黄昕艳,等.Trizol 法提取新生小鼠脑组织总RNA 优化比较[J].中风与神经疾病杂志,2012,29(2):155-156.
[11] 李丽红.加用依达拉奉治疗急性脑梗死的疗效观察[J].中国医药指南,2010,8(15):104-105.
[12] Rafferty M,Walters MR,Dawson J.Anti-Platelet therapy and aspirin resistance clinically and chemically relevant[J].Curr Med Chem,2010,17(36):4 578-4 586.
[13] Terao Y,Ohta H,Oda A,et al.Macrophage infl ammatory protein-3 alpha plays a key role in the infl ammatory cascade in rat focal cerebral ischemia[J].Neurosci Res,2009,64(1):75-82.
[14] Rosenberg GA,Estrada EY,Mobashery S,et al.Effect of Synthetic Matrix Metalloproteinase Inhibitors on Lipopolysaccharide-Induced Blood-Brain Barrier Opening in Rodents:Differences in Response Based on Strains and Solvents[J].Brain Res,2007,1 133(1):186-192.
[15] 王吕成,吴强.依达拉奉治疗急性脑梗死的疗效观察[J].中国社区医师:医学专业,2010,12(19):21-22.
[16] Tait MJ,Saadoun S,Bell BA,et al.Water movements in the brain:role of aquaporins[J].Trends Neurosci,2008,31(1):37-43.
[17] Yemisci M,Gursoy-Ozdemir Y,Vural A,et al.Pericyte contraction induced by oxidative-nitrative stress impairs capillary reflow despite successful opening of an occluded cerebral artery[J].Nature,2009,15(9):1 031-1 037.
[18] Liu W,Hendren J,Qin XJ,et al.Cerebral ischemia with delayed tissue plasminogen activator treatment in a rat model of focal normobaric hyperoxia reduces the neurovascular complications associated[J].Stroke,2009,40(7):2 526-2 531.
[19] 陈传国,王娟,费世早,等.依达拉奉治疗急性脑梗死中文文献临床疗效的Meta 分析[J].安徽医学,2013,34(1):9-12.
[20] Paciaroni M,Caso V,Agnelli G.The concept of ischemic penumbra in acute stroke and therapeutic opportunities[J].Eur Neurol,2009,61(6):321-330.
[21] Vizioli L,Muscari S,Muscari A.The relationship of mean platelet volume with the risk and prognosis of cardiovascular diseases[J].Int J Clin Pract,2009,63(10):1 509-1 515.
[22] Yepes M,Roussel BD,Ali C,et al.Tissue-type plasminogen activator in the ischemic brain:more than a thrombolytic[J].Trends Neurosci,2009,32(1):48-55.
[23] 董利.依达拉奉治疗进展型脑梗死16例疗效观察[J].淮海医药,2010,28(1):59-61.
[24] Badaut J,Brunet JF,Regli L,et al.Aquaporins in the brain:from aqueduct to “multi-duct”[J].Metab Brain Dis,2007,22(324):251-263.
[25] 潘强,陈伟.依达拉奉治疗急性脑梗塞的疗效观察[J].国际医药卫生导报,2010,16(11):1 341-1 342.
[26] Hwang IK,Yoo KY,Li H,et al.Aquaporin 9 changes in pyramidal cells before and is expressed in astrocytes after delayed neuronal death in the ischemic hippocampal CA1 region of the gerbil[J].J Neurosci Res,2007,85(11):2 470-2 479.
[27] Jin R,Yang G,Li G.Inflammatory mechanisms in ischemic stroke:role of inflammatory cells[J].J Leukoc Biol,2010,87(5):779-789.
[28] 李晓红,郑玉敏,万里姝,等.依达拉奉治疗急性脑梗死的临床研究[J].现代药物与临床,2014,29(6):639-643.
[29] Yang DY,Pan HC,Chen CJ,et al.Effects of tissue plasminogen activator on cerebral microvessels of rats during focal cerebral ischemia and reperfusion[J].Neurol Res,2007,29(3):274-282.
[30] Young W,Rapp port ZH,Chalif DJ,et al.Regional brain sodium,potassium,and water changes in the rat middle cerebral artery occlusion model of ischemia[J].Stroke,1987,18(4):751-759.
(收稿2016-02-24)
Effects of hyperbaric oxygen combined with edaravone on AQP9 expression andbrain edema in cerebral infarction rats
SongNaiguang*,SunJingjing,ZhangYaolong,SunCaiyue,XueJian,LiHaipeng,HeYonggui,XiJinkun,ZhangGuobin
*DepartmentofEmergency,theUnionHospitalofTangshanCity,Tangshan063000,China
Objective To investigate the effects of hyperbaric oxygen combined with edaravone on AQP9 expression and brain edema in cerebral infarction rats.Methods After establishing models of middle cerebral artery occlusion (MCAQ)in elder SD rats,we divided all rats into four groups:control group,edaravone group,hyperbaric oxygen group and combined group.The neurological functional scores before and after treatment were calculated in each group.The expressions of AQP9 gene and protein in brain tissues of modeled SD rats,and the water content of brain tissues were detecled.HE staining was used for the observation of pathology.Results In terms of the neurological functional scores,combined group showed less scores than control group,and edaravone group and hyperbaric oxygen group.The detections of RT-PCR and Western blotting indicated that the combined group held significantly lower levels of the expressions of AQP9 and less water contents at each time measured in brain tissues compared with the other three groups (P<0.05).The results of HE staining showed that the combined group got more remission of brain edema and inflammatory cell infiltration than others.Conclusion Hyperbaric oxygen therapy combined with edaravone can promote the recovery of cerebral nerve function.
Cerebral infarction;Hyperbaric oxygen;Edaravone;Brain edema;AQP9
R-332
A
1673-5110(2016)24-0001-04

