ATM-/-小鼠Sertoli细胞对于双链DNA损伤修复的初步研究
李家轩,吴登龙,乐 威,章劲夫.同济大学附属同济医院泌尿外科,上海 00065; .上海交通大学医学院附属同仁医院,上海 0005
ATM-/-小鼠Sertoli细胞对于双链DNA损伤修复的初步研究
李家轩1,吴登龙1,乐 威1,章劲夫2
1.同济大学附属同济医院泌尿外科,上海 200065; 2.上海交通大学医学院附属同仁医院,上海 200051
目的研究ATM基因移除小鼠Sertoli细胞对于DNA双链断裂(DSB)损伤的修复作用。方法将30只4~5周龄C57小鼠随机分为ATM敲除小鼠(n=15)和对照组(n=15),各组又分为无照射和0.1 Gy电离辐射45 min、2 h、48 h组,观察处死后睾丸组织DAPI、γ-H2Ax免疫荧光染色情况。结果ATM-/-小鼠Sertoli细胞相对于ATM+/+小鼠生殖细胞对DSB损伤修复效率降低。结论ATM-/-小鼠Sertoli细胞对于DSB损伤修复效率下降。
Sertoli细胞;ATM;DNA双链断裂;DNA损伤
DNA损伤广泛存在于细胞的各项生理活动中。根据损伤DNA链壮结构的不同,可分为DNA单链断裂与DNA双链断裂(DSB)。其中,DNA双链断裂是一种更为严重的细胞DNA损伤[1]。细胞损伤主要通过非同源性末端接合(NHEJ)、同源性重组(HR)两种途径修复。共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)主要作用于HR途径[2],是HR修复途径上游的重要基因。Sertoli细胞位于睾丸精曲小管,属于生精系统内部的支持细胞,以旁分泌的形式分泌多种因子,直接调控精原干细胞的自我更新、精母细胞的减数分裂,在生精过程中发挥重要调控作用[3]。目前发现,在DSB发生时,Sertoli细胞中可以检测到ATM,但敲除ATM之后,Sertoli细胞仍可进行DSB修复[4]。ATM对于Sertoli细胞修复DSB损伤是否有影响目前尚不明确。本实验利用电离辐射造成DSB损伤,通过细胞染色观察ATM敲除C57小鼠的DSB及修复情况,旨在研究ATM蛋白在Sertoli细胞DSB损伤修复的作用。
1 材料与方法
1.1 实验材料
动物:4~5周龄C57、ATM-/-雄性小鼠各15只(同济大学干细胞研究中心提供)。荧光染色抗体:DAPI购自Santa cruz公司,γ-H2Ax购自Abcam公司。NIKON共聚焦显微型,同济大学干细胞研究中心提供。
1.2 实验方法
1.2.1 处理小鼠
将ATM(A组)与C57(C组)小鼠分别随机分为5组(A0、A1、A2、A3、A4;C0、C1、C2、C3、C4),予0.1Gy照射后,将A1与C1、A2与C2、A3与C3、A4与C4按注射后45 min、2 h、24 h、48 h时间节点脱颈处死,取睾丸组织。
1.2.2 免疫荧光染色
睾丸组织脱水处理后,被固定于4%多聚甲醇中,包埋冰冻,以20µm厚度切割。冰冻切片予2%牛血清蛋白处理后,分别滴加或γ-H2Ax(1:500)一抗。后予DAPI染色。
1.2.3 数据统计分析
每只小鼠随机选取1000细胞,统计DAPI(+)γ-H2Ax(+)点,并行双总体t检验(α=0.05)。数据处理软件为IBM SPSS 19.0,图像由GraphPad Prism 5绘制。
2 结果
如图1、2,对照组、ATM-/-组均表现为r-H2Ax(+);C57小鼠生殖细胞随时间进行DSB修复。无低剂量X-ray照射时,ATM-/-小鼠Sertoli细胞DSB程度高于C57组(图3);照射后,ATM-/-小鼠和C57组Sertoli细胞γ-H2Ax Foci点均随时间下降,但ATM-/-小鼠Sertoli细胞γ-H2Ax Foci点则较高(图4,P<0.05)。表明,ATM-/-小鼠组Sertoli细胞DSB修复效率低于正常C57组。
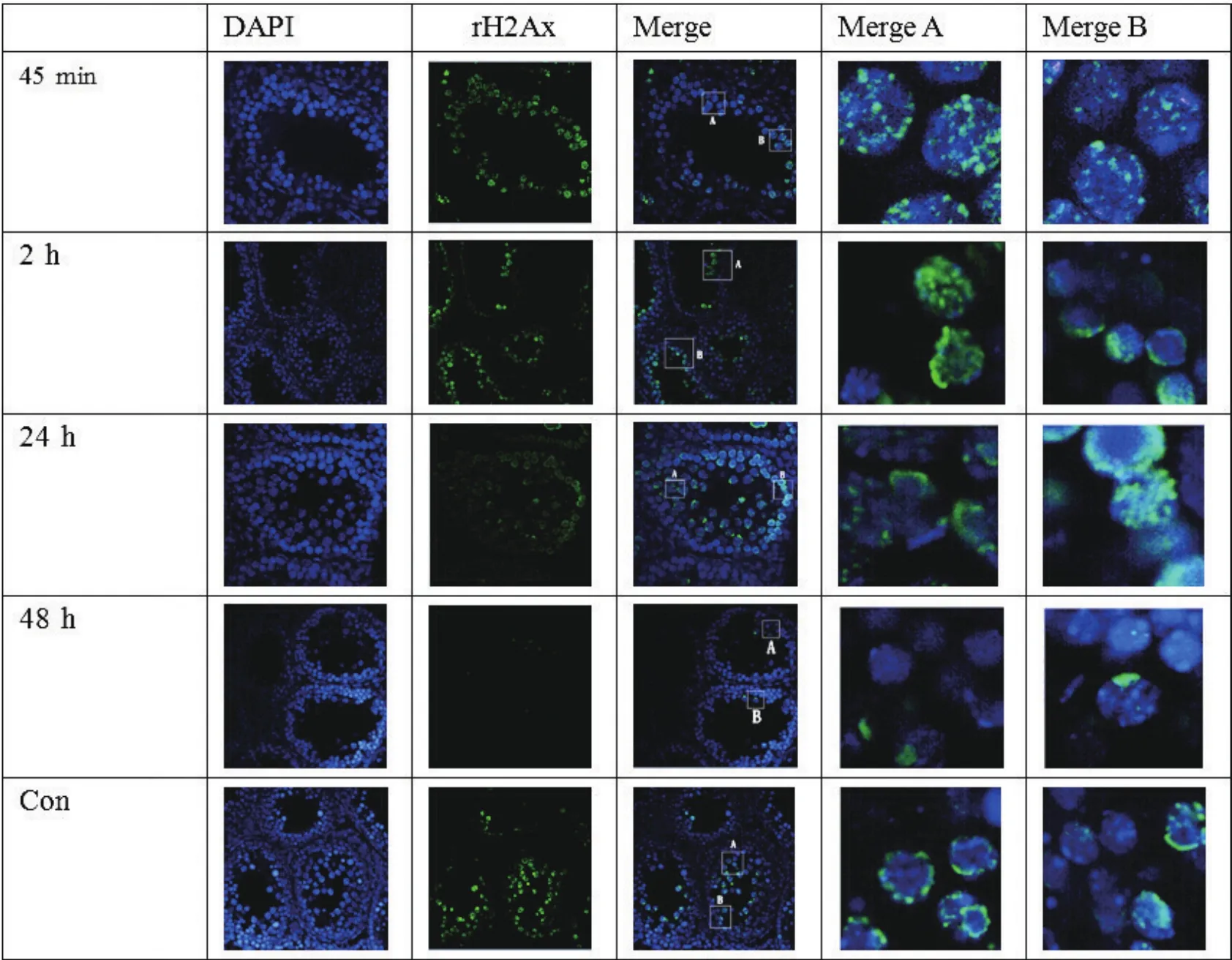
图1 低剂量(0.1Gy)照射后A组小鼠睾丸γ-H2Ax表达(×400)Fig.1 Expression of γ-H2Ax in testis tissues in group A after low dose(0.1Gy)irradiation(×400)
3 讨论
DNA损伤是细胞生理过程中的常见损伤,可由射线、化学试剂、细菌分泌物等多种因素引起。而DNA双链断裂(DSB)是DNA损伤中最为严重的情况[5]。机体对于DSB主要有两种应答修复途径:1)HR修复途径:主要作用于细胞G2期,利用细胞内染色体两两对应的特性,用对应染色体DNA序列做模板来回复断裂序列;2)NHEJ途径:主要作用于细胞G1/S期,利用修复蛋白拉近断裂末端,以DNA粘合酶来粘合断裂带。不同的细胞经由不同的途径进行修复,并产生不同的结局入修复、变异、周期停滞、凋亡等[6]。

图2 低剂量X-ray照射后,C组小鼠睾丸γ-H2Ax表达(×400)Fig.2 Expression of γ-H2Ax in testis tissues in group C after low dose X-ray irradiation(×400)
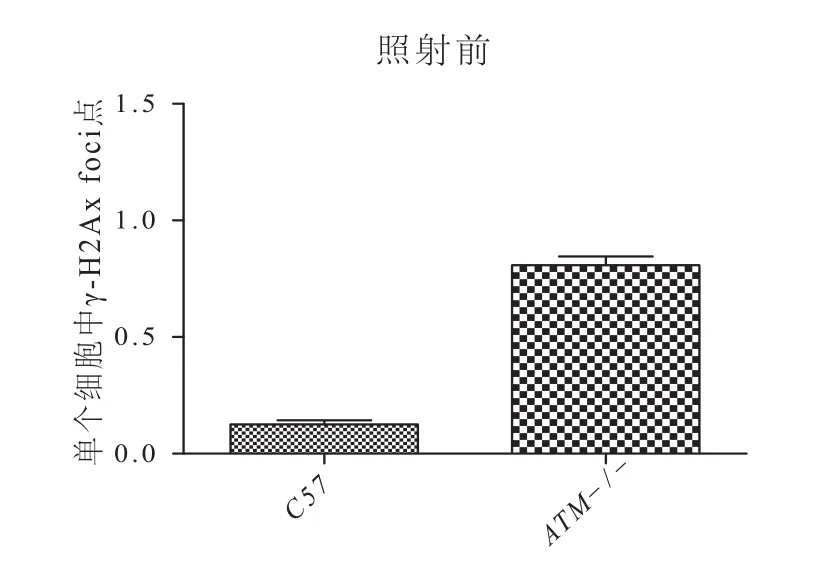
图3 无照射时ATM-/-小鼠Sertoli细胞内γ-H2Ax点情况Fig.3 γ-H2Ax foci in ATM-/-mice Sertoli cells without irradiation

图4 照射后两组小鼠γ-H2Ax Foci点Fig.4 γ-H2Ax foci in both groups after irradiation
γ-H2Ax是一种在DSB损伤应答早期即出现的信号蛋白。当DSB出现时,组蛋白H2出现于DNA断端并被磷酸化成γ-H2Ax,并以此来召集ATM蛋白,激活响应的修复通路。因此,γ-H2Ax被广泛用评估DSB损伤程度[7]。
Sertoli细胞位于睾丸精曲小管中,主要分泌GDNF、FGF2等因子,支持并调控精原干细胞。在维持生精微环境中起重要作用[8]。在DSB出现后,Sertoli细胞如何进行应答修复,目前机制尚不明确[9]。
ATM基因广泛表达于全身各种细胞中,其编码的ATM蛋白作用于HR修复途径。以往研究发现,敲除ATM后,小鼠睾丸内即出现生精障碍和“唯支持细胞综合征”(Sertoli cell-only syndrome):曲精小管中精原干细胞消失,仅存在sertoli细胞[10]。本实验使用ATM-/-小鼠,通过统计ATM-/-小鼠出现DSB后γ-H2Ax表达情况,验证ATM在Sertoli细胞DSB应答中的作用。
在照射(0.1 Gy电离辐射)后急性期内(45 min),ATM-/-Sertoli细胞与C57小鼠生殖细胞均表达r-H2Ax。ATM-/-小鼠中γ-H2Ax的foci点数量和密度多于C57小鼠,提示ATM-/-基础DSB严重,且受IR后修复效能降低。表明ATM是Sertoli细胞重要的DSB修复蛋白。随时间延长,ATM-/-或C57小鼠睾丸γ-H2Ax的foci点均逐渐减少,但ATM-/-小鼠γ-H2Ax的foci点消除慢于C57小鼠生殖细胞。说明即使敲除ATM,Sertoli细胞仍能进行DSB修复,但修复已受到影响,即敲除ATM后Sertoli细胞DSB修复效率降低。这表明,Sertoli细胞DSB损伤修复主要依靠HR途径;而最后的缓慢修复现象亦提示,NHEJ途径可能参与Sertoli细胞DSB损伤修复,但不是主要途径。ATM-/-小鼠Sertoli细胞出现DSB后,应答修复功能受损,DSB累积,功能受影响,干扰了生精微环境,甚至影响生精过程。这可能是生殖细胞缺失、减少的主要原因之一。
本实验表明,ATM基因参与了Sertoli细胞的DSB应答;ATM缺失会造成Sertoli细胞DSB修复功能下降。而Sertoli细胞仍有其他DSB修复途径。但Sertoli细胞DSB修复的具体通路如何,DSB损伤对Sertoli细胞分泌物(GDNF、FGF2)是否有影响,还需进行深入的研究。
[1] Takubo K,Ohmura M,Azuma M,et al.Stem cell defects in ATM-deficient undifferentiated spermatogonia through DNA damage-induced cell-cycle arrest[J].Cell Stem Cell,2008,2(2):170-182.
[2] Podhorecka M.Gamma H2AX in the recognition of DNA double-strand breaks[J].Postepy Hig Med Dosw(Online),2009,63(2):92-98.
[3] Chen SR,Liu YX.Regulation of spermatogonial stem cell self-renewal and spermatocyte meiosis by Sertoli cell signaling [J].Reproduction,2015,149(4):R159-167.
[4] Hai Y,Hou J,Liu Y,et al.The roles and regulation of Sertoli cells in fate determinations of spermatogonial stem cells and permatogenesis[J].Semin Cell Dev Biol,2014,29(5):66-75.
[5] Geert H,Henk B,Christoph H,et al.Ataxia telangiectasia mutated expression and activation in the testis[J].Biol Reprod,2004,70(4):1206-1212.
[6] Lee J,Shinohara M,Inoue K,et al.Akt mediates self-renewal division of mouse spermatogonial stem cells[J].Development,2007,134(10):1853-1859.
[7] Rübe CE,Zhang S,Miebach N,et al.Protecting the heritable genome:DNA damage response mechanisms in spermatogonial stem cells[J].DNA Repair(Amst),2011,10(2):159-68
[8] Dufour JM,Rajotte RV,Korbutt GS,et al.Harnessing the immunomodulatory properties ofSertolicells to enable xenotransplantation in type I diabetes[J].Immunol Invest,2003,32(4):275-297.
[9] Driesche S,Sharpe RM,Saunders PT,et al.Regulation of the germ stem cell niche as the foundation for adult spermatogenesis:a role for miRNAs?[J].Semin Cell Dev Biol,2014,29(5):76-83.
[10] Oatley JM,Avarbock MR,Telaranta AI,et al.Identifying genes important for spermatogonial stem cell self-renewal and survival [J].Proc Natl Acad Sci USA,2006,103(25):9524-9529.
Repair of DNA double-strand break in ATM-/-mice Sertoli cells
LI Jiaxuan1,WU Denglong1,LE Wei1,ZHANG Jinfu2
1.Department of Urology,Tongji Hospital,Tongji University School of Medicine,Shanghai 200065,China;2.Tongren Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai 200051,China
ObjectiveTo study the repair of DNA double-strand break(DSB)in ATM-/- mice sertoli cells.MethodsThirty C57 mice aged 4 to 5 weeks were randomly divided into ATM-/-mice group(n=15)and control group(n=15),and each group was randomly subdivided into 0.1 Gy ionizing irradiation 0 min,45 min,2 hr and 48 hr groups. The immunofluorescence staining of DAPI and γ-H2Ax in testis tissues after sacrifice was examined.ResultsATM-/-mice sertoli cells had a lower efficiency in repair of DSB than ATM+/+mice germ cells.ConclusionThe efficiency of DSB repair in ATM-/-mice sertoli cells is decreased.
Sertoli cell;ATM;DNA double-strand break;DNA damage
R698+.2
A
2095-378X(2016)01-0012-04
10.3969/j.issn.2095-378X.2016.01.004
2015-12-30)
李家轩(1989—),男,硕士研究生,研究男科方向
吴登龙,电子邮箱:Wudenglong@163.com

