不同程度病变宫颈组织miR-424表达水平及其临床意义
栾 磊 关淑芬 朱 越 杨可欣
(齐齐哈尔医学院附属第一医院妇科,黑龙江 齐齐哈尔 161041)
不同程度病变宫颈组织miR-424表达水平及其临床意义
栾 磊 关淑芬 朱 越 杨可欣
(齐齐哈尔医学院附属第一医院妇科,黑龙江 齐齐哈尔 161041)
目的探讨微小RNA(miR)-424在宫颈上皮内瘤变(CIN)和宫颈癌患者宫颈组织中的表达情况及其临床意义。方法齐齐哈尔医学院附属第一医院就诊并最终获得宫颈组织病理学诊断的40~69岁女性患者,收集宫颈组织;采用实时荧光定量PCR检测不同病变程度宫颈组织中miR-424的相对表达水平并进行比较。结果共收集129例不同程度病变患者的正常和病变宫颈组织样本(CIN Ⅰ组25例,CIN Ⅱ组30例,CIN Ⅲ组28例,宫颈癌组46例)。不同病变程度宫颈组织中miR-424的表达差异有统计学意义(F=47.009,P=0.000),且随着病变程度的增加,miR-424的表达水平呈下降趋势。miR-424高表达所占比例与宫颈组织病变程度相关(χ2=8.377,P=0.039),而与人乳头瘤病毒(HPV)感染情况不相关。结论miR-424在不同病变宫颈的表达水平存在差异,随着宫颈病变程度的加重,其表达水平呈降低趋势,并且宫颈病变程度影响miR-424的表达水平。
微小RNA(miR)-424;宫颈组织
微小RNA(miRNA)是一种短链非编码的小分子RNA,通过与靶基因转录生成mRNA的特异性结合来发挥基因表达的转录后调控作用,从而参与细胞增殖、分化、凋亡等生物过程〔1〕。研究〔2〕表明,miR-424在高级别宫颈上皮内瘤变(CIN)和浸润性宫颈癌的宫颈脱落细胞中的相对表达水平显著低于低级别CIN和正常宫颈脱落细胞中的表达。许君芬等〔3〕对正常宫颈和宫颈癌组织的miRNA表达谱分析结果显示,miR-424是表达下降最明显的miRNA。本研究拟分析miR-424在不同病变程度宫颈组织中的表达及其与各临床参数间的关系。
1 资料与方法
1.1临床资料 选取2013年7月至2015年12月来齐齐哈尔医学院附属第一医院就诊并最终获得宫颈组织病理学诊断的40~69岁女性患者129例,收集病变部分宫颈组织及其病变周围正常宫颈组织用于miRNA检测。组织标本取出后立即放入液氮中并置于-80℃冰箱中保存,直至RNA提取。排除标准:①既往已被确诊为CIN、宫颈癌或其他恶性肿瘤者;②既往行宫颈部分或全部切除而致的宫颈不完整者;③孕妇均知情同意。宫颈组织的病理学诊断是通过手术切除或宫颈活检获取的宫颈组织经过石蜡切片的苏木素-伊红(HE)染色,诊断依据2003年国际肿瘤研究机构出版(IARC)的乳房和女性生殖器官肿瘤的病理和遗传学相关依据进行诊断〔4〕。当研究对象同时存在多级别宫颈病变时按最高级别入组。CIN Ⅰ组25例,CINⅡ组30例,CINⅢ组28例,宫颈癌组46例。平均年龄分别为(49.61±4.55)岁、(52.03±5.36)岁、(50.54±5.91)岁、(51.86±6.25)岁。4组年龄分布差异无统计学意义(F=2.210,P>0.05),具有可比性。本研究经我院医学伦理委员会批准。
1.2实验步骤 ①总RNA提取:取出冷冻的病变宫颈组织及病变周围正常宫颈组织进行匀浆,采用Trizol法提取宫颈组织中的总RNA〔5〕;然后向提取出的RNA沉淀中加入10 μl焦炭酸二乙酯(DEPC)水(日本TaKaRa公司),于冰上静置30 min以充分溶解RNA,置于-80℃冰箱保存备用。②逆转录合成cDNA:向200 μl的灭菌管中加入0.5 μg上述步骤提取的总RNA和适量DEPC水,使总体积为6.8 μl,70℃在PCR仪器上预变性10 min保持4℃;向上述完成预变性的灭菌管中继续加入以下试剂:逆转录酶(日本TaKaRa公司)0.8 ml,逆转录缓冲试剂(日本TaKaRa公司)2.0 ml,RNA酶抑制剂(日本TaKaRa公司)0.2 ml,各基因RT引物0.2 ml,使总体积为10 μl;在PCR仪(美国BioRAD公司)中完成逆转录反应,反应程序:16℃ 30 min,42℃ 30 min,85℃ 5 min,4℃ forever。③实时荧光定量PCR:向96孔板(美国Axygen公司)中加入qPCR反应体系(上、下游引物各0.4 μl,2×SRBR Premix Taq 10 μl,Rox reference Dye 2 0.4 μl,3H2O 7.8 μl,cDNA模板1.0 μl),使总体积为20 μl;反应程序:95℃ 30 s,(95℃ 5 s + 60℃ 30 s)×40 个循环,其中,SRBR Premix Ex Taq试剂盒来源于日本TaKaRa公司。U6上游引物:5′-AACGCTTCACGAATTTGCGT-3′,下游引物:5′-CTCGCTTCGGCAGCACA-5′;miR-424上游引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTCA AA-3′,下游引物:5′-CGAAGCAGCAGCAATTCATG-3′。
1.3结果判读 采用7900HT快速实时系统自带的SDS软件进行结果分析。用2-△Ct代表miRNA的相对表达水平,其中△Ct=Ct(miRNA)-Ct(U6),以U6作为对照。数值越大表示检测的miRNA的相对表达水平越高,越小表示相对表达水平越低。
1.4统计学方法 应用SPSS17.0软件行方差分析、χ2检验。
2 结 果
2.1miR-424在宫颈组织中的表达 除CIN Ⅰ组外,CIN Ⅱ组、CIN Ⅲ组和宫颈癌3组正常宫颈组织与病变组织中miR-424表达水平均有统计学意义(P<0.05),且病变组织中miR-424的表达水平均低于正常组织。在正常宫颈组织中miR-424的表达在各组间的差异均无统计学意义(P>0.05)。而在病变宫颈组织中miR-424表达水平在CIN Ⅰ组与CIN Ⅱ组、CIN Ⅲ组与宫颈癌组差异显著(P<0.05),而CINⅡ组与CINⅢ组差异无统计学意义(P>0.05)。见表1。
2.2Spearman相关分析 miR-424在CIN Ⅰ、CIN Ⅱ、CIN Ⅲ和宫颈癌中的表达具有相关性(r=-0.784,P<0.05),且随着宫颈病变程度的加重,miR-424的相对表达水平显著性降低。
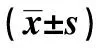
表1 各组正常、病变宫颈组织miR-424表达情况
2.3miR-424相对表达水平与不同程度宫颈病变患者临床资料的关系 不同程度病变宫颈组织中病变组织/正常组织比值≥0.5为miR-424高表达;<0.5为低表达〔5〕。在CIN Ⅰ、CIN Ⅱ、CIN Ⅲ和宫颈癌4组宫颈组织中,miR-424低表达所占比例分别为52.0%(13例)、63.3%(19例)、75.0%(21例)、82.6%(36例)。miR-424的表达情况与宫颈病变程度显著相关(χ2=8.377,P=0.039)。此外,miR-424的表达情况与患者人乳头瘤病毒(HPV)感染情况不相关(χ2=2.553,P=0.110),其中HPV+97例,低表达72例;HPV-32例,低表达19例。
3 讨 论
宫颈癌的发病过程漫长,一般按顺序要经历HPV感染、不同程度的CIN,最后发展为宫颈癌,该过程平均需要5~20年。由于宫颈易于暴露和取材,结合宫颈癌的高发生率和较漫长的发病过程,监测宫颈不同程度病变的生物标志物(如miRNA)的发现可为宫颈癌的早发现、早治疗提供依据。
miRNA是广泛存在的由内源基因编码的长度约为22个核苷酸的非编码小RNA,主要参与基因转录后的表达调控。它通过与靶mRNA分子的3′-UTR特异性互补结合,在转录后水平调控靶基因的表达,从而参与机体细胞的增殖、分化、凋亡等多种重要的生物学过程〔6〕。miRNA的异常表达广泛参与多种肿瘤相关基因的调控,它通过对体内促癌或抑癌基因表达的调控来发挥作用。
目前研究显示miR-424在胃癌〔7〕、结直肠癌〔8〕、原发性肝细胞癌〔9〕、前列腺癌〔10〕等癌组织中的表达异常,提示miR-424可能参与恶性肿瘤的发生发展。Cheung 等〔11〕采用RT-PCR实验技术在高级别宫颈上皮内瘤变和正常宫颈组织中的202个miRNAs进行表达谱分析,结果发现了12个高度差异表达的miRNAs,其中包括miR-424,并且它在宫颈鳞状细胞癌和正常宫颈组织中的表达也存在差异。许君芬〔12〕研究发现miR-424在宫颈癌组织中的表达较宫颈正常组织显著下调。以上研究提示miR-424在宫颈癌及其癌前病变组织中差异表达。本研究结果与Cheung等〔11,12〕研究结果一致,即miR-424在宫颈癌组织中的表达下调。以上结果提示miR-424可作为一个潜在的生物标志物,用于宫颈病变的检测。
1Lu J,Clark AG.Impact of microRNA regulation on variation in human gene expression〔J〕.Genome Res,2012;22(7):1243-54.
2田其芳.宫颈脱落细胞microRNA检测在宫颈癌筛查中的作用〔D〕.杭州:浙江大学,2014.
3许君芬,李 阳,王芬芬,等.miR-424在不同宫颈病变中的表达及其调节宫颈癌细胞生物学行为的研究〔C〕.杭州:2011年浙江省妇产科学学术年会暨“妇产科常见疾病的临床研究新进展”学习班论文汇编,2011:1.
4李素萍,王兴武,宋 宝,等.宫颈癌组织miR-199b表达及其临床意义的初步分析〔J〕.中华肿瘤防治杂志,2012;19(17):1335-8.
5陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析〔J〕.中国肿瘤,2016;25(1):1-8.
6Bartel DP.MicroRNAs:target recognition and regulatory function〔J〕.Cell,2009;136(2):215-33.
7Wei S,Li Q,Li Z,etal.miR-424-5p promotes proliferation of gastric cancer by targeting Smad3 through TGF-β signaling pathway〔J〕.Oncotarget,2016;7(46):75185
8Jepsen RK,Novotny GW,Klarskov LL,etal.Intra-tumor heterogeneity of microRNA-92a,microRNA-375 and microRNA-424 in colorectal cancer〔J〕.Exp Mol Pathol,2016;100(1):125-31.
9Yang H,Zheng W,Shuai X,etal.MicroRNA-424 inhibits Akt3/E2F3 axis and tumor growth in hepatocellular carcinoma〔J〕.Oncotarget,2015;6(29):27736-50.
10Banyard J,Chung I,Wilson AM,etal.Regulation of epithelial plasticity by miR-424 and miR-200 in a new prostate cancer metastasis model〔J〕.Sci Rep,2013;3(17):3151.
11Cheung TH,Man KN,Yu MY,etal.Dysregulated microRNAs in the pathogenesis and progression of cervical neoplasm〔J〕.Cell Cycle,2012;11(15):2876-84.
12许君芬.miR-424及其参与的Cul2/E2F1/miR-424调控环路在宫颈癌发生发展中的作用和机制研究〔D〕.杭州:浙江大学,2014.
〔2017-02-25修回〕
(编辑 袁左鸣)
栾 磊(1978-),女,副主任医师,主要从事妇科医疗研究。
R737.33
A
1005-9202(2017)17-4313-03;doi:10.3969/j.issn.1005-9202.2017.17.069

