黑果腺肋花楸酵素的抗氧化活性研究
黄 海,王 莹,郭云瑕,陶文靖,贾惜文,徐 艳
(1.钦州学院食品工程学院,广西钦州 535011;2.广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011; 3.青岛农业大学食品科学与工程学院,山东青岛 266109)
黑果腺肋花楸酵素的抗氧化活性研究
黄 海1,2,王 莹3,郭云瑕3,陶文靖3,贾惜文3,徐 艳3
(1.钦州学院食品工程学院,广西钦州 535011;2.广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011; 3.青岛农业大学食品科学与工程学院,山东青岛 266109)
以黑果腺肋花楸(简称黑果)为原料,利用植物乳杆菌发酵制备黑果酵素,探讨了黑果酵素发酵过程中总酚含量和体外抗氧化活性的变化及其对D-半乳糖致衰小鼠的抗氧化作用。结果表明,酵素发酵12 d后总酚含量、清除超氧阴离子能力、清除DPPH自由基能力较未发酵前分别提高了2.42、1.69、0.088倍,体外抗氧化活性显著增强(p<0.05);与模型组、未发酵组相比,黑果发酵组小鼠体重增加量、免疫器官指数、血清和肝脏中T-SOD、CAT活力、对羟自由基的清除能力显著提高(p<0.05),MDA的含量显著下降(p<0.05)。综上可知,黑果腺肋花楸酵素具有抗氧化作用。
黑果腺肋花楸,发酵,抗氧化
黑果腺肋花楸(Aroniamelanocarpa),又叫野樱莓,不老莓,原产于美国东北部地区[1],是一种集食用、药用、观赏、生态价值于一体的蔷薇科落叶灌木[2]。黑果的果实中含有花青素、黄酮、多酚、维生素、矿物元素等[3]。据Li J[4]等人研究,黑果的多酚含量是已知水果中最高的。目前欧美国家对黑果有较多的研究,有结果发现黑果提取物具有缓解小鼠糖尿病、高血压、抑制脂肪酶活等作用,并可以对肠道内胆固醇起到很好的调节效果[5-8];发现黑果中的多酚与VE有协同抗氧化作用[9],但黑果果汁在单独存放时易变质,使的抗氧化活性逐渐降低[10]。如何开发黑果产品并使其自身抗氧化活性在加工过程中不被破坏,是一个亟待解决的问题。
酵素是目前非常流行的一种新型保健食品。据报道酵素在发酵过程中会产生各种对人体有益的酶,同时能够将大分子转变成小分子营养物质,具有多种生理活性[11]。本文以黑果为原料,利用植物乳杆菌进行发酵得到黑果酵素。并通过建立D-半乳糖诱导的亚急性致衰小鼠模型,研究了该酵素的抗氧化作用,以期为其在食品及医药领域的应用提供依据。
1 材料与方法
1.1 材料与仪器
黑果腺肋花楸 开原市绿动园林苗木繁育基地;植物乳杆菌 无锡拜弗德生物科技有限公司;黄糖 佛山市南海叶氏恒发糖制品有限公司;雄性昆明种清洁级小鼠 体重(20±2) g,8周龄,青岛大任富城畜牧有限公司,合格证号SCXKL(鲁)20140007;D-半乳糖 国药集团化学试剂有限公司;MDA、T-SOD、GSH-Px、CAT、羟自由基试剂盒以及蛋白质定量(考马斯亮蓝法)试剂盒 南京建成生物工程研究所;基础饲料 山东鲁抗医药股份有限公司;其余试剂 均为国产分析纯。
酵素发酵罐 青岛也能家居用品有限公司;DU-800型紫外分光光度计 美国贝克曼公司;TGL-16M高速台式冷冻离心机 湖南湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 黑果酵素的制备 取清洗干净的黑果自然晾干,将其破碎,加入等质量切碎黄糖,在无菌条件下按1%(w/w)接种量接入植物乳杆菌,混匀后密闭发酵15 d,过滤除去固体残渣,在15 ℃条件下恒温发酵1年即得酵素。将酵素离心后置于4 ℃冰箱冷藏待测备用[12]。
1.2.2 黑果酵素发酵过程的指标测定
1.2.2.1 体外抗氧化活性测定 DPPH自由基清除能力、超氧阴离子清除能力测定方法参照文献[13-15]。
1.2.2.2 总酚含量测定 参照文献[16],采用Folin-Ciocalteau体系进行测定。
1.2.3 小鼠的分组及饲喂 选取50只昆明种SPF级雄性小鼠,随机分5组,分别为正常组、模型组、VC阳性对照组、黑果未发酵组和黑果发酵组,每组10只。
正常组、模型组小鼠按15 mL/(kg·d bw)灌胃生理盐水,VC阳性对照组按100 mg/(kg·d bw)灌胃VC,并使其灌胃量与正常组、模型组相同,黑果未发酵组与发酵组按15 mL/(kg·d bw)的量分别灌胃黑果未发酵的自流汁与酵素。除正常组外,其他组按100 mg/(kg·d bw)皮下注射D-半乳糖,正常组注射等体积的生理盐水。
小鼠饲养温度为18~22 ℃,自然光照,自由进食和饮水。每日定时灌胃、皮下注射一次,连续饲喂7周,记录小鼠体重增加量。
1.2.4 小鼠血清和肝脏的制备 血清的制备:在最后一次灌胃、皮下注射小鼠后,将小鼠禁食12 h,称重。摘除眼球取血致死,加入抗凝剂抗凝血,静置3 h后,血样在4 ℃下3000 r/min离心10 min,收集上清液,即为血清样品[17]。
肝脏组织匀浆的制备:解剖小鼠,迅速取出肝脏、胸腺、脾脏,用生理盐水清洗,用滤纸吸干,记录胸腺、脾脏重量。并将肝脏研磨,以制备10%匀浆液,在4 ℃下4000 r/min离心10 min后除去细胞碎片,取上清液备用。
1.2.5 抗氧化活性的测定 小鼠的体内抗氧化活性测定包括血清和肝脏对羟自由基的清除率,T-SOD、GSH-Px、CAT酶活力及MDA含量确定。测定方法按照试剂盒方法操作。
1.2.6 免疫器官指数测定 免疫器官指数的计算式为:
1.3 数据处理
2 结果与分析
2.1 黑果酵素发酵过程中体外抗氧化指标变化
2.1.1 黑果酵素发酵过程中总酚含量的变化 参照1.2.2.2方法测定总酚含量变化,结果见图1。

图1 总酚含量变化曲线Fig.1 The curve of total phenols content 注:不同字母代表有显著差异(p<0.05);图2、图3同。
从图1可以看出,随着发酵时间的增加,黑果酵素中总酚含量显著增加,发酵12 d时总酚含量达到1.85 mg/g,之后趋于稳定。黑果酵素发酵12 d后总酚含量较发酵前提高了2.42倍。
2.1.2 黑果酵素对超氧阴离子自由基清除能力的变化 参照1.2.2.1方法测定黑果酵素对超氧阴离子自由基的清除率,结果见图2。

图2 超氧阴离子自由基清除能力的变化曲线Fig.2 The curves of superoxide anion free radical scavenging ability
从图2可以看出,随着发酵时间的增加黑果酵素对超氧阴离子自由基清除能力逐渐增强,发酵15 d时发酵液对超氧阴离子的清除能力达到58.3%,较发酵前提高了1.69倍。本实验以0.5 mg/mL的VC作为阳性对照,其对超氧阴离子的清除率为55.1%,小于发酵后的黑果酵素,说明黑果酵素具有很好的清除超氧阴离子自由基的能力。
2.1.3 黑果酵素对DPPH自由基清除能力的变化 参照1.2.2.1方法测定黑果酵素对DPPH自由基的清除率,结果见图3。

图3 DPPH自由基清除能力Fig.3 The curves of DPPH scavenging ability
从图3可以看出,在发酵初期,随着发酵时间的增加,黑果酵素对DPPH自由基的清除能力显著增强。发酵12 d时发酵液对DPPH自由基的清除能力达到98.4%,较发酵前提高了0.088倍。本实验以0.75 mg/mL的VC作为对照,其对DPPH的清除率为92.45%,小于发酵后的黑果酵素,说明黑果酵素具有很好的清除DPPH自由基的能力。
2.2 黑果酵素对小鼠体重、脾脏、胸腺指数的影响
从表1可以看出,各组小鼠体重均有增长,但模型组小鼠体重增长量显著小于正常组和VC阳性对照组,说明模型组小鼠衰老速度明显高于其他组,建模成功。比较免疫器官指数指标发现,黑果发酵组与未发酵组明显高于模型组,且黑果发酵组高于未发酵组,说明黑果酵素具有潜在增强小鼠免疫力的作用。
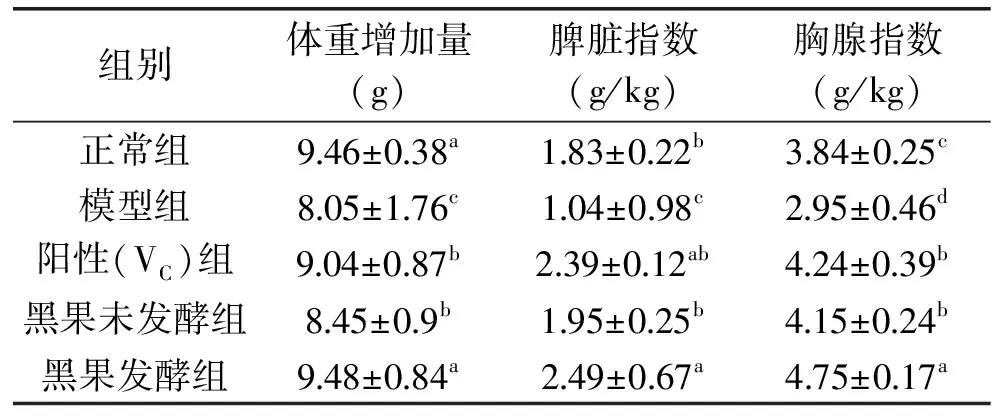
表1 小鼠体重、脾脏、胸腺指数的对比
注:同列不同小写字母代表差异显著(p<0.05),表2~表6同。
2.3 黑果酵素对小鼠血清和肝脏MDA含量的影响
从表2可以看出,模型组小鼠血清、肝脏中MDA含量较正常组小鼠显著升高。与模型组相比,黑果未发酵组与黑果发酵组小鼠MDA含量均有降低,且发酵组的效果显著好于未发酵组,因为发酵组可使小鼠血清中MDA含量回归到正常水平,使肝脏中MDA含量显著低于正常组,说明黑果酵素能够显著降低小鼠体内MDA含量。

表2 小鼠血清和肝脏MDA含量
2.4 黑果酵素对小鼠血清和肝脏清除羟能力的影响
从表3可以看出,模型组小鼠血清、肝脏对羟自由基的清除能力要显著低于其他组,黑果发酵组与黑果未发酵组较模型组相比,清除羟自由基的能力均有显著提高,且发酵组显著高于未发酵组,说明黑果酵素可以提高小鼠机体清除羟自由基的能力,起到抗氧化的效果。

表3 小鼠血清和肝脏清除羟自由基能力
2.5 黑果酵素对小鼠血清和肝脏T-SOD活力的影响
从表4看出,模型组小鼠血清、肝脏中T-SOD活力较正常组小鼠显著降低。与模型组相比,黑果未发酵组与黑果发酵组小鼠血清和肝脏中T-SOD酶活力较模型组显著增强,并且发酵组小鼠的T-SOD酶活力较未发酵组显著提高。

表4 小鼠血清和肝脏T-SOD活力
2.6 黑果酵素对小鼠血清和肝脏GSH-Px活力的影响
从表5看出,模型组小鼠血清、肝脏中GSH-Px活力较正常组小鼠显著降低。与模型组相比黑果发酵组小鼠血清和肝脏中GSH-Px活力显著升高,说明黑果酵素具有提高小鼠体内GSH-Px活力的作用。
2.7 黑果酵素对小鼠血清和肝脏CAT活力的影响
从表6看出,模型组小鼠血清和肝脏中CAT活力较正常组小鼠显著降低,黑果未发酵组与黑果发酵组小鼠血清和肝脏中CAT活力较模型组显著提高,且发酵组酶活力要高于未发酵组。说明黑果可以提高小鼠CAT活力,且发酵后提高CAT活力效果更佳。

表5 小鼠血清和肝脏GSH-Px活力

表6 小鼠血清和肝脏CAT活力
3 结论
3.1 对模型组小鼠连续7周注射D-半乳糖后,与空白组相比,小鼠血清与肝脏中MDA含量显著升高,清除羟自由基能力、CAT、T-SOD、GSH-Px活力显著下降,说明D-半乳糖诱导的致衰老模型构建成功。
3.2 黑果酵素发酵12 d后具有良好的体外抗氧化能力,能有效清除DPPH、超氧阴离子,并且总酚含量显著增加。黑果发酵组小鼠的免疫器官指数较模型组、未发酵组均显著升高,血清和肝脏中T-SOD、GSH-Px、CAT活力显著提高,MDA的含量显著下降,且对羟自由基的清除能力显著增强,说明黑果酵素可以起到抗氧化、延缓衰老的效果。本文可为黑果酵素抗氧化机理的研究提供一定的参考,但关于黑果酵素的抗氧化机理还有待进一步研究。
[1]刘芳芳,鲁亚星,于帅,等.黑果腺肋花楸花青素的提取工艺及其稳定性[J].延边大学农学学报,2015,37(3):196-201.
[2]韩文忠,马兴华.黑果腺肋花楸的生物学特性和应用价值[J].辽宁林业科技,2005(4):40-42.
[3]玄永浩,金英善.黑果腺肋花楸化学成分及药理活性研究进展[J].现代农业科技,2009(20):101-102,104.
[4]Li J,Deng Y,Yuan CH,et al. Antioxidant and Quinone Reductase-Inducing Constituents ofBlackChokeberry(Aroniamelanocarpa)Fruits[J]. Journal of Agricultural and Food
Chemistry,2012,60(46):11551-11559.
[6]Worsztynowicz P,Napieraa M,Biaas W,et al. Pancreaticα-amylase and lipase inhibitory activity of polyphenolic compounds present in the extract ofBlackChokeberry(AroniamelanocarpaL.)[J]. Process Biochemistry,2014,49(9):1457-1463.
[7]Ciocoiu M,Badescu L,Miron A,et al. The involvement of a polyphenol-rich extract ofBlackChokeberryin oxidative stress on experimental arterial hypertension[J]. Evidence-Based Complementary and Alternative Medicine,2013,2013:1-8.
[8]Kim B,Park Y,Wegner CJ,et al. Polyphenol-richBlackChokeberry(Aroniamelanocarpa)extract regulates the expression of genes critical for intestinal cholesterol flux in Caco-2 cells[J]. The Journal of Nutritional Biochemistry,2013, 24(9):1564-1570.
[9]Graversen HB,Becker EM,Skibsted LH,et al. Antioxidant synergism between fruit juice andα-tocopherol. A comparison between high phenolicBlackChokeberry(Aroniamelanocarpa)and high ascorbic blackcurrant(Ribes nigrum)[J]. European Food Research and Technology,2008,226(4):737-743.
[10]Hwang SJ,Yoon WB,Lee O,et al. Radical-scavenging-linked antioxidant activities of extracts from blaBlackChokeberryand blueberry cultivated in Korea[J]. Food Chemistry,2014,146(1):71-77.
[11]陈宏运,崔红燕,吴彬彬,等. 植物发酵液对D-半乳糖致衰老模型小鼠的抗氧化活性研究[J]. 现代食品科技,2015(8):7-11,17.
[12]艾学东,胡丽娜. 水果植物复合酵素饮料的研制[J]. 食品与发酵科技,2015(2):105-108.
[13]Li YH,Jiang B,Zhang T,et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate[J]. Food Chemistry,2008,106(2):444-450.
[14]杨明琰,张晓琦,沈俭,等.超氧化物歧化酶两种邻苯三酚自氧化测定活力方法的比较[J].微生物学杂志,2006,26(3):40-42.
[15]文镜,贺素华,杨育颖,等. 保健食品清除自由基作用的体外测定方法和原理[J].食品科学,2004,5(11):190-194.
[16]蒋增良,毛建卫,黄俊,等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报,2014(10):29-34.
[17]王莹. 岩藻聚糖硫酸酯酶产生菌的筛选、酶学性质研究及酶解产物抗氧化活性预测系统的建立[D].青岛:中国海洋大学,2013.
Antioxidant activity ofAroniamelanocarpaenzyme
HUANG Hai1,2,WANG Ying3,GUO Yun-xia3,TAO Wen-jing3,JIA Xi-wen3,XU Yan3
(1.College of Food Engineering,Qinzhou University,Qinzhou 535011,China; 2.Guangxi Colleges and Universities Key Laboratory of Development and High-value Utilization of Beibu Gulf Seafood Resource,Qinzhou 535011,China; 3.Qingdao Agricultural University,College of Food Science and Enginnering,Qingdao 266109,China)
TheAroniamelanocarpaenzyme was fermented by Lactobacillus,the changes of total phenols,antioxidant activities during fermentation process and anti-aging effect were investigated by the aging mice induced by D-galactose. The result showed that comparing with before fermentation,with the increase of fermentation time the content of total phenols,superoxide anion scavenging activity and DPPH·scavenging activity increased 2.42,1.69,0.088 times,theinvitroantioxidant activity ofAroniamelanocarpaenzyme was significantly enhanced(p<0.05). Compared with the model group and unfermented group,the index of body weight and immune organs,activities of T-SOD,CAT,scavenging ratio of ·OH radicals in plasma and liver of fermented group were significantly increased(p<0.05). In addition,the content of MDA significantly reduced(p<0.05). The results showed that theAroniamelanocarpaenzyme had anti-oxidant effect on aging model mice.
Aroniamelanocarpa;fermentation;anti-oxidant
2016-05-20
黄海(1977-),男,博士,副教授,研究方向:从事食品科学方面的研究,E-mail:1240578407@qq.com。
广西高校中青年教师基础能力提升项目(KY2016YB493)。
TS218
A
1002-0306(2016)22-0336-04
10.13386/j.issn1002-0306.2016.22.057

