响应面法优化灰枣中黄酮提取工艺研究
梁鹏举,姜建辉,*,秦少伟,康 雷
(1.塔里木大学生命科学学院,新疆阿拉尔 843300;2.南疆化工重点实验室,新疆阿拉尔 843300)
响应面法优化灰枣中黄酮提取工艺研究
梁鹏举1,2,姜建辉1,2,*,秦少伟1,2,康 雷1,2
(1.塔里木大学生命科学学院,新疆阿拉尔 843300;2.南疆化工重点实验室,新疆阿拉尔 843300)
以提取时间、提取温度、料液比、乙醇体积分数为实验因素,在单因素基础上,应用Box-Behnken实验设计和响应面分析法优化灰枣中黄酮提取工艺。确定灰枣中黄酮最佳提取工艺条件为:提取时间30 min,提取温度40 ℃,料液比1∶29(g∶mL),乙醇体积分数70%,实际提取量为3.266 mg/g。实际提取值与模型预测值之间的RSD为0.38%,实际优化的工艺条件与理论预测拟合程度高。
新疆灰枣,响应面,黄酮,提取
灰枣又名羌枣,为鼠李科枣属植物的成熟果实,是中国唯一在树上自然吊干的红枣。灰枣得名是因为羌枣在成熟变红之前,通体发灰,好似挂了一层霜,所以得名“灰枣”。灰枣的栽培起源于河南新郑,有2700余年栽培历史,后大面积栽培种植于新疆等地[1]。灰枣具有增强人体免疫力、增强肌力、保护肝脏、抗过敏、镇静安神、健脾益胃、补气养血的作用[2-4]。Guangpu Liu等[5]以甲醇为红枣多糖提取溶剂,进行了黄河滩枣多糖保肝作用的研究;Huanxia Zhao等[6]以乙醇为提取溶剂,进行了7个不同品种的中国红枣酚类化合物抗氧化活性的研究;赵志永等[7]研究了新疆骏枣中总黄酮的提取,乙醇多次浸提,用响应面法优化其提取工艺,得到骏枣总黄酮的平均提取量为2.32 mg/g;Xiaohong Kou等[8]在不同品种红枣生物活性成分及抗氧化能力的研究中,以80%甲醇为溶剂,用超声辅助的方法提取了不同品种红枣中的总黄酮,其中灰枣总黄酮含量在0.67±0.06 mg RE/g FW之间;Sheng Guo等[9]以甲醇为溶剂,超声辅助的方法提取并进行了Z.jujuba和Z.jujubavar. spinosa两种红枣叶子中三萜酸、皂苷和黄酮的定性定量研究分析。近年新疆灰枣资源化利用渐成热点,但关于灰枣总黄酮含量的提取及测定鲜见报道。
本文以乙醇为溶剂,利用超声波辅助法提取灰枣中的总黄酮,对灰枣黄酮的超声波辅助乙醇提取工艺参数进行了探索,利用单因素和响应面对超声辅助乙醇提取工艺进行优化,旨在为灰枣产业的综合发展和高价值加工利用提供技术支持。
1 材料与方法
1.1 材料与仪器
新疆灰枣 采购于新疆阿拉尔市果园,灰枣阴干去皮去核、粉碎过筛(40目),收集灰枣粉末备用;芦丁对照品 纯度≥95%,上海蓝季科技发展有限公司;石油醚、氢氧化钠 分析纯,天津市致远化学试剂有限公司;硝酸铝 分析纯,北京市实验科学仪器厂;亚硝酸钠 分析纯,上海试剂一厂;无水乙醇 分析纯,天津市光复科技发展有限公司;浓硫酸 分析纯,汕头市西陇化工厂。
电热鼓风干燥箱 上海一恒科学仪器有限公司;标准检验筛 上虞市仪器设备厂;AL104电子分析天平 0.0001 g,上海恒平科学仪器有限公司;KQ-400 KED数控超声波清洗器 超声功率400 W,昆山市超声仪器有限公司;循环水式真空泵 巩义市予华仪器有限责任公司;UT-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 提取灰枣总黄酮的工艺流程 灰枣→60 ℃干燥→机械剥离法去皮、核→粉碎40目过筛→超声波辅助乙醇提取→减压过滤→滤液离心→上清液定容→制备得到待测液。
将灰枣阴干,去皮、去核,粉碎并过40目筛,得灰枣干粉。每次准确称取过筛后的灰枣粉末1 g,将其转入到250 mL的圆底烧瓶中,按实验工艺流程分别设定不同的提取时间、配制不同的料液比以及不同比例的乙醇用量、不同提取温度,逐步对灰枣中黄酮进行提取,得黄酮提取液。
1.2.2 灰枣总黄酮含量测定
1.2.2.1 绘制芦丁标准曲线 配制浓度为0.1 mg/mL的芦丁标准溶液,确定对照品溶液在波长为510 nm处具有最大吸收[6]。分别配制浓度为0.01、0.02、0.03、0.04、0.05 mg/mL芦丁溶液[10],用双光束紫外可见分光光度计在波长为510 nm处测定不同溶液的吸收度值。以纵坐标为吸光度A,横坐标为芦丁质量浓度C(mg/mL)绘制标准曲线,并做回归处理,得回归线方程为y=8.6000x+0.0102,R2=0.9992。
1.2.2.2 总黄酮提取量的计算 样品溶液测定将所得提取液定容于25 mL的容量瓶中得样品溶液,分别准确移取样品溶液2.00 mL于10 mL容量瓶中,按标准曲线的测定方法测定所制备实验样品溶液的吸光度,再对照所绘制标准曲线查得对应的黄酮浓度,依据下式计算灰枣总黄酮量。
总黄酮提取量(mg/g)=CV1V0/V2W
其中:C-标准曲线查得的黄酮浓度(mg/mL);V0-灰枣黄酮初次提取液经定容后的体积(mL);V1-实验样品溶液测定时定容后的体积(mL);V2-实验样品溶液测定时的体积(mL);W-灰枣粉末质量(g)。
1.2.3 超声辅助提取灰枣中总黄酮
1.2.3.1 单因素实验 以提取时间(min)、提取温度(℃)、料液比(g:mL)、乙醇体积分数(%)为考察因素,以灰枣中总黄酮得率为指标,确定响应面实验因素水平。
提取时间:准确称取灰枣粉末1 g,将其置于圆底烧瓶中,按照1.2.1中实验工艺对材料预处理。固定提取温度30 ℃、料液比1∶20、乙醇体积分数90%,分别在提取时间为10、20、30、40、50 min的条件下进行超声辅助提取。
提取温度:确定最优的提取时间,固定料液比1∶20、乙醇体积分数90%,分别在温度为20、30、40、50、60 ℃条件下超声辅助提取。
料液比:确定最优的提取时间、提取温度,固定乙醇体积分数90%,分别在料液比为1∶5、1∶10、1∶20、1∶30、1∶40(g∶mL)条件下超声辅助提取。
乙醇体积分数:确定最优的提取时间、温度和料液比,分别在乙醇体积分数为50%、60%、70%、80%、90%条件下超声辅助提取。
1.2.3.2 灰枣总黄酮提取的响应面实验设计 采用Design-Expert软件处理数据[11],根据单因素实验结果,提取时间(A)、提取温度(B)、料液比(C)、乙醇体积分数(D)为实验因素,以黄酮提取量为响应值,进行实验的设计,响应面因素水平见表1。

表1 响应面实验设计因素水平
1.2.4 灰枣总黄酮提取重复性实验 为验证通过实验选定的最佳提取工艺重复性[12],分别准确称取6份灰枣粉末1 g,以上述过程选定的最佳提取工艺参数条件下分别进行6次平行实验,并显色及测定。
1.2.5 数据处理 以黄酮提取率为考察指标,用Design Expert V 8. 0软件对实验结果进行统计分析,应用响应面方法(Response Surface Methodology,RSM)对结果进行数模分析并优化。
2 结果与分析
2.1 单因素实验
2.1.1 提取时间 由图1可知,超声辅助提取时间为30 min时所得灰枣黄酮提取量最大,当超声辅助时间继续延长后灰枣总黄酮提取量反而下降。这表明超声时间对灰枣总黄酮提取具有明显影响,可能由于超声时间过长,致使提取过程中超声波强大的空化作用导致溶液中杂质含量增加及黄酮类物质结构被破坏,因而黄酮提取量出现下降。超声辅助提取灰枣总黄酮的最佳提取时间确定为30 min。

图1 超声辅助提取时间对提取效果的影响Fig.1 Effect of ultrasonic time on extraction of effect for flavones
2.1.2 提取温度 由图2可知,随着超声辅助提取温度从20 ℃升高到40 ℃,灰枣黄酮的提取量逐渐增加,且呈线性关系,当超声辅助提取温度达40 ℃时灰枣总黄酮提取量最高,再增高超声辅助提取温度,灰枣总黄酮的提取量呈下降趋势,这说明超声辅助提取温度对灰枣总黄酮提取量影响显著,过高的温度会导致可溶性蛋白质溶出变性,影响灰枣细胞的破裂[11],进而阻碍灰枣总黄酮从其细胞的溶出,使灰枣黄酮提取量呈下降趋势。超声辅助灰枣黄酮提取最佳温度确定为40 ℃。

图2 超声辅助提取温度对提取效果的影响Fig.2 Effect of ultrasonic temperature on extraction of effect for flavones
2.1.3 料液比 由图3可知,随着料液比的逐渐增大,灰枣黄酮提取量从料液比1∶5到1∶10范围内增加量变化明显,料液比继续增大,灰枣黄酮提取量持续增高,总黄酮的溶出速度也变大,料液比达1∶30时超声辅助灰枣黄酮提取量为最大,当料液比继续增大灰枣黄酮提取量下降。这表明当料液比高达一定值时总黄酮充分溶出,若持续增大料液比,灰枣总黄酮的提取量已基本趋于稳定,黄酮类物质在提取液中趋于饱和[12]。超声辅助提取灰枣黄酮的最佳料液比确定为1∶30。

图3 超声辅助提取料液比对提取效果的影响Fig.3 Effect of liquid to solid ratio with ultrasonic on extraction of effect for flavones
2.1.4 95%乙醇体积分数 由图4可知,随着乙醇和水互溶单相体系中乙醇体积分数从50%、60%到70%,灰枣总黄酮提取量基本以线性关系随乙醇体积分数的增加而增大,在体系中乙醇体积分数达70%时,灰枣黄酮提取量达最大,体系中乙醇体积分数为80%时,灰枣黄酮提取量明显下降,乙醇体积分数高达90%时灰枣黄酮提取量呈最低。乙醇和水都为极性溶剂,两者配比体积分数不断变化时,所形成溶液的极性也会不同,在超声辅助提取灰枣黄酮时70%乙醇和水的体积比所形成溶液的极性最有利用灰枣中黄酮类化合物的溶出,乙醇体积分数过大时会增加灰枣中一些脂溶性物质溶出,对黄酮类物质的溶出造成影响[13],灰枣黄酮提取量下降。超声辅助提取灰枣总黄酮选用乙醇体积分数占70%时黄酮溶出量最高。
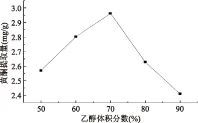
图4 超声辅助提取乙醇体积分数对提取效果的影响Fig.4 Effect of the volume fraction of ethanol with ultrasonic on extraction of effect for flavones
2.2 超声辅助灰枣黄酮最佳提取工艺研究
按照Box-Behnken组合设计[14],根据单因素实验结果选取提取时间(A)、提取温度(B)、料液比(C)和乙醇体积分数(D)作为自变量,以新疆灰枣黄酮提取量为响应值进行响应面实验。表2为实验方案的设计和结果,表3为方差分析结果。
2.2.1响应曲面分析 对表2结果进行统计分析,得二次回归方程模型为:Y=-8.70567+0.099032A+0.11330B+0.059298C+0.19684D-1.45000E-004AB+7.25000E-005AC+2.175000E-004BC+9.425000E-004BD+3.75000E-005CD-1.07858E-003A2-1.80483E-003B2-1.29858E-003C2-1.67733E-003D2

表2 响应面实验设计和结果

表3 回归方程方差分析

响应曲面倾斜度大说明交互作用大,反之则小。由响应面图(图6)及p值的分析可得,两两因素间对响应值均有一定的交互作用[15],其中提取时间-温度、提取时间-料液比、提取时间-体积分数、提取温度-料液比、料液比-体积分数交互作用不显著,提取温度-体积分数(BD)的交互作用对灰枣黄酮的提取量影响较为显著[13]。

图6 各因素交互作用影响灰枣黄酮提取量的响应面图Fig.6 The response surface graphshowing the effects ofvarious factors on the extraction yield of Zizyphus jujube cv. Huizao flavonoids
通过Design-Expert软件分析得到乙醇溶液提取灰枣黄酮的最优工艺条件为提取时间29.56 min,提取温度40.00 ℃,料液比1∶28.84(g∶mL),乙醇体积分数69.22%,理论提取量3.259 mg/g。结合实际实验条件,确定灰枣黄酮最佳提取条件为:提取时间30 min,提取温度40 ℃,料液比1∶29(g∶mL),乙醇体积分数70%,经5次平行实验,测得灰枣的实际提取量为3.266 mg/g,理论提取量与实际提取量间的RSD值为0.38%,相差较小。回归线分析表明,此方法合理可行。
2.2.2 重复性实验 按选定的最优条件进行6次平行实验,在吸光度为0.292 A时,灰枣黄酮的平均提取量达3.265 mg/g,RSD为0.52%(n=6),表明用此工艺提取灰枣中总黄酮,重复性显示良好。通过实验研究表明灰枣中总黄酮的含量高于骏枣[7]。
3 结论
本实验研究了灰枣中黄酮类化合物的提取工艺,通过单因素实验和响应面实验得灰枣中总黄酮超声辅助提取最佳工艺条件为:提取时间30 min,提取温度40 ℃,料液比1∶29(g∶mL),乙醇体积分数70%,该条件下实际提取量为3.266 mg/g。建立的实验模型拟合度高,可用于其它方法对灰枣中总黄酮提取工艺的优化筛选。
[1]张娜,蒲云峰,姜冰,等. 阿克苏灰枣营养及挥发性成分分析[J]. 食品工业科技,2012,33(3):358-360.
[2]CF Chen,JF Lee,D Wang,et al. Water extract of Zizyphus jujube attenuates ischemia/reperfusion induced liver injury in rats(PP106)[J]. Transplantation Proceedings,2010,42(3):741-743.
[3]Jin-wei Li,Shao-dong Ding,Xiao-lin Ding. Comparison of antioxidant capacities of extracts from five cultivars of Chinese jujube[J]. Process Biochemistry,2005,40(11):3607-3613.
[4]Xiangchun Shen,Yuping Tang,Ruihui Yang,et al. The protective effect ofZizyphusjujubefruit on carbon tetrachloride induced hepatic injury in mice by antioxidative activities[J]. Journal of Ethnopharmacology,2009,122(3):555-560.
[5]Guangpu Liu,Xinquan Liu,Yongchun Zhang,et al. Hepatoprotective effects of polysaccharides extracted fromZizyphusjujubecv. Huanghetanzao[J]. International Journal of Biological Macromolecules,2015,76:169-175.
[6]Huanxia Zhao,Haisheng Zhang,Shufang Yang. Phenolic compounds and its antioxidant activities in ethanolic extracts from seven cultivars of Chinese jujube[J]. Food Science and Human Wellness,2014,3:183-190.
[7]赵志永,蒲彬,贺玉凤,等. 响应面法优化新疆红枣总黄酮乙醇提取工艺[J]. 中国酿造,2012,31(1):88-90.
[8]Xiaohong Kou,Qiong Chen,Xianhua Li,et al. Quantitative assessment of bioactive compounds and the antioxidant activity of 15 jujube cultivars[J]. Food Chemistry,2015,173:1037-1044.
[9]Sheng Guo,Jin-ao Duan,Yuping Tang,et al. Simultaneous qualitative and quantitative analysis of triterpenic acids,saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDA-MS/ELSD[J]. Journal of Pharmaceutical and Biomedical Analysis,2011,56:264-270.
[10]高丹丹,郭鹏辉,祁高展,等. 响应面法优化薄荷全草总黄酮的提取工艺[J]. 食品工业科技,2015,36(2):299-303,322.
[11]姜建辉,赵俭波,王贵云. 银合欢叶黄酮的提取工艺[J]. 食品研究与开发,2014,35(7):40-42,91.
[12]史高峰,王红玉,王国英,等. 甜叶菊渣中总黄酮的提取工艺优选[J]. 中国实验方剂学杂志,2012,18(22):62-64.
[13]林建原,季丽红. 响应面优化银杏叶中黄酮的提取工艺[J]. 中国食品学报,2013,13(2):83-90.
[14]姜建辉,赵俭波,兰亚刚. 响应面法优化巴旦木多糖提取工艺研究[J]. 食品科技,2015,40(11):166-171.
[15]李尚谦,张斌,郭辉,等. 响应面法优化杨梅叶中黄酮提取工艺的研究[J]. 食品工业,2015,36(2):108-111.
Optimization of extraction technique of flavonoids fromZizyphusjujubecv. Huizao by response surface methodology
LIANG Peng-ju1,2,JIANG Jian-hui1,2,*,QING Shao-wei1,2,KANG Lei1,2
(1.College of Life Sciences,Tarim University,Alar 843300,China; 2.Key Laboratory of Chemical Engineering in South Xinjiang,Alar 843300,China)
To optimize the ethanol extraction of total flavonoids fromZizyphusjujubecv. Huizao,the effects of extraction times of ultrasonic,temperature,liquid to solid ratio,the volume fraction of ethanol and their interaction on the extraction yield of jujube flavonoids were studied with Box-Behnken,on the basis of single factor tests. The optimum extraction conditions were obtained as follows:extraction time 30 min,extraction temperature 40 ℃,the ratio of solid to liquid 1∶29(g∶mL),the volume fraction of ethanol 70%.Under the optimal conditions,the extraction rate of total flavonoids fromZizyphusjujubecv.huizao was 3.266 mg/g,which RSD for 0.38% agreed well with the predictive value. The optimized conditions for flavonoids extraction fromZizyphusjujubecv. Huizao were reliable.
Zizyphusjujubecv. Huizao in xinjiang;response surface methodology;flavonoids;extraction
2016-04-18
梁鹏举(1984-),男,硕士,讲师,研究方向:天然产物化学,E-mail:1251851363@qq.com。
*通讯作者:姜建辉(1978-),男,硕士,副教授,研究方向:天然有机化学,E-mail:xjjjh78@163.com。
国家自然基金(21562035)资助项目。
TS201.1
B
1002-0306(2016)22-0264-06
10.13386/j.issn1002-0306.2016.22.043

