双重DPO-PCR检测副溶血弧菌和霍乱弧菌
魏 霜,马新华,汪天杰,龙 阳,纪 强,任 娇,吴希阳
(1.汕头出入境检验检疫局,广东汕头 515041;2.暨南大学理工学院食品科学与工程系,广东广州 510632;3.湛江出入境检验检疫局,广东湛江 524022;4.广州出入境检验检疫局,广东广州 510632)
双重DPO-PCR检测副溶血弧菌和霍乱弧菌
魏 霜1,2,马新华3,汪天杰4,龙 阳3,纪 强1,任 娇1,吴希阳2,*
(1.汕头出入境检验检疫局,广东汕头 515041;2.暨南大学理工学院食品科学与工程系,广东广州 510632;3.湛江出入境检验检疫局,广东湛江 524022;4.广州出入境检验检疫局,广东广州 510632)
根据副溶血弧菌collagenase基因和霍乱弧菌ompW基因,分别设计特异性DPO(dual priming oligonucleotide)引物,建立一种快速检测这两种弧菌的多重DPO-PCR方法,并对其特异性和灵敏度进行了评价。结果显示,设计的DPO引物特异性较强,副溶血弧菌和霍乱弧菌DNA可分别扩增出307 bp与463 bp的特异性条带,检测灵敏度均达0.1 ng/μL。该检测方法对退火温度不敏感。利用该方法对69株疑似弧菌菌株进行鉴定,结果与生理生化鉴定结果一致。该方法特异性强、灵敏度高,适合于对食品、水产品等中副溶血弧菌和霍乱弧菌的进行快速筛检。
副溶血弧菌,霍乱弧菌,多重DPO-PCR
传统检测方法特异性差、灵敏度低并且耗时长、操作繁琐、满足不了快速检测的需求。PCR技术具有快速、特异性强和灵敏度高等特点,是目前食源性致病菌检测主要采用的检测技术之一[10]。在此基础上,DNA探针技术[11]、普通多重PCR(Multiplex PCR)[12]、多重荧光定量PCR(Multiplex real-time PCR)[13]、PCR结合变性高效液相色谱(DHPLC)[14]等检测方法也已建立起来,但是这些方法有些对引物设计的要求很高,而且需要优化退火温度,有些则需依赖较昂贵的仪器设备,难以在实验室推广。因此,寻求一种能快速、灵敏、特异的同时检测这两种病原菌的技术十分重要。
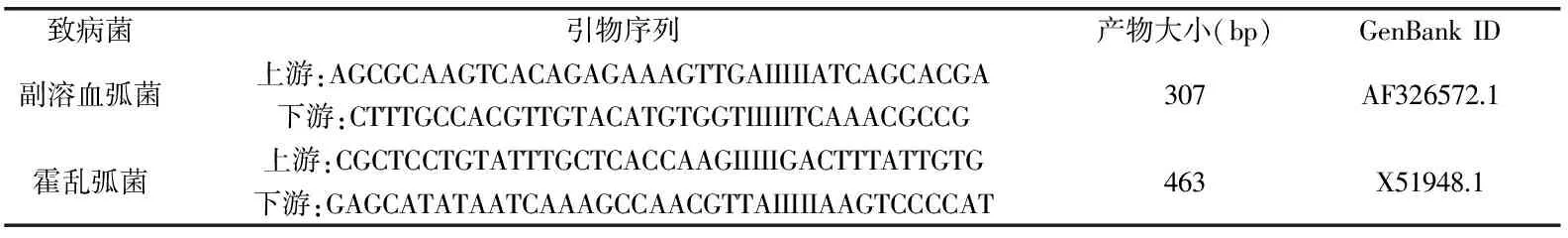
表1 引物序列
由于多重PCR可同时检测多种致病菌,在提高检测效率的同时又能降低检测成本,因此被广泛应用于食品、水产品等产品中的多种食源性致病菌检测。但传统的多重PCR体系中,由于多对引物之间存在干扰、各引物的退火温度存在差异、引物与模板的错配,容易造成灵敏度下降与非特异性扩增等问题,限制了多重PCR技术的应用。
近年来研究发现一种新型PCR引物设计方法,即双启动寡核苷酸引物(dual-priming oligonucleotide,DPO)[15]。DPO引物技术的主要原理为其引物包含两个独立的区域,5′端序列由18~25个碱基组成,3′端序列由6~12个碱基用来引导PCR反应的特异性延伸,这两段独立的特异性区域利用寡聚次黄嘌呤(Inosine,I)进行连接,由于次黄嘌呤的退火温度低,在退火时寡聚次黄嘌呤形成类似泡状的结构,从而使5′和3′区域形成两个独立功能的双特异性引物结构,研究表明5′和3′引物区域中任何有3个及以上碱基的错配,PCR反应将不能进行,而且因为其构造的特殊性,引物自身以及引物之间能够生成的二级结构较少,并且对于退火温度具有不敏感的特性。该技术的优点主要在于它对退火温度等影响普通多重PCR的关键因素不敏感,适用范围广[16],而且该技术特异性强,扩增效率高,为多重PCR技术的应用提供了新的前景。目前该技术已经广泛应用于病原菌检测中,据报道DPO-PCR技术已建立了创伤弧菌[17]、产肠毒素大肠杆菌[18]、肠出血性大肠杆菌O157∶H7[19]、志贺氏菌[20]等的检测方法。本研究旨在建立一种多重DPO-PCR方法来同时检测副溶血弧菌和霍乱弧菌,为口岸实验室快速鉴定这两种病原菌提供参考。
1 材料与方法
1.1 材料与仪器
河流弧菌(Vibriofluvialis)、拟态弧菌(V.mimicus)、鳗弧菌(V.anguillarum)、哈维氏弧菌(V.harveyi)、梅氏弧菌(V.metschnikovi) 保存于汕头出入境检验检疫局;副溶血弧菌(V.parahaemolyticus,ATCC17802)、溶藻弧菌(V.alginolyticus,ATCC17749)、霍乱弧菌(V.cholerae,ATCC14035)、创伤弧菌(V.vulnificus,ATCC27562)、大肠杆菌(Escherichiacoli,ATCC8739)、单增李斯特菌(Listeriamonocytogenes,ATCC19111)、金黄色葡萄球菌(Staphylococcusaureus,ATCC43300) 保存于暨南大学食品科学与工程系;2012年6月,采集3个湖泊水样(暨南大学石牌校区明湖)、9个水产养殖水样和9个贝壳类水产品(石牌市场) 共计21个样本;胰蛋白胨大豆肉汤(Tryptic Soy Broth,TSB)培养基、脑心浸液(Brian Heart Infusion,BHI)液体培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(Thiosulfate citrate bile salts sucrose agar culture medium,TCBS)培养基 美国BD公司;DNA提取试剂盒、细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;多重PCR反应试剂盒(Multiplex PCR Assay Kit) TaKaRa公司;DNA Marker DL2000,大连宝生物公司;PCR引物 生工生物工程(上海)股份有限公司合成。
Veriti96 PCR扩增仪 美国ABI公司;ND-1000微量紫外分光光度计 Nano Drop公司;600SI电泳仪 上海博彩生物科技有限公司;GBOX-F3凝胶成像系统 GENE公司。
1.2 实验方法
1.2.1 基因组DNA的提取 挑取上述弧菌单菌落,接种于3% NaCl的胰蛋白胨大豆肉汤培养基中;挑取上述非弧菌单菌落,接种于脑心浸液液体培养基中,37 ℃下振荡培养过夜。参照DNA提取试剂盒说明操作,分别提取1.1中12种菌株的基因组DNA。提取后取1 μL基因组DNA样品用微量紫外分光光度计测定基因组DNA的浓度和纯度,并保存于-20 ℃待用。
教师一句评价性鼓励的话,调整了课堂探究气氛,成为了孩子学习的新动力,使他在原有基础上不断进步,用自己的勤奋创造一片属于自己的真正舞台。
1.2.2 引物设计 参考DPO引物设计方法和要求[16],根据副溶血弧菌collagenase基因序列和霍乱弧菌ompW基因序列,设计检测副溶血弧菌和霍乱弧菌的多重DPO-PCR引物组合(引物序列中的I为次黄嘌呤)(表1)。引物由生工生物工程(上海)股份有限公司合成。
1.2.3 双重DPO-PCR体系 参考多重PCR反应试剂盒说明书的反应体系,Mix 2溶液25 μL、Mix 1溶液0.25 μL、各引物终浓度均为0.4 μmol/L、DNA模板1.0 μL,ddH2O调节最终体积至50 μL。反应条件为94 ℃ 1 min;94 ℃ 30 s,60 ℃ 90 s,72 ℃ 90 s,40个循环;72 ℃ 10 min。PCR扩增产物经2.0%琼脂糖电泳后,用凝胶成像系统观察并拍照。
1.2.4 双重DPO-PCR体系退火温度敏感性实验 按照1.2.3多重DPO-PCR反应体系,将反应条件中的退火温度范围设定为45~65 ℃,5 ℃为1个梯度共五个梯度,以副溶血弧菌和霍乱弧菌的基因组DNA混合物为模板进行退火温度敏感性实验,产物经2.0%琼脂糖凝胶电泳观察结果,讨论不同退火温度下多重DPO-PCR体系的稳定性。
1.2.5 双重DPO-PCR体系的特异性评价 按照1.2.3多重DPO-PCR反应体系,以1.2.1中提取的12个供试菌株的基因组DNA为模板,同时以水为模板做阴性对照,以副溶血弧菌和霍乱弧菌的基因组DNA混合物为模板做阳性对照,对所建立的双重DPO-PCR反应体系的特异性进行评价。
1.2.6 双重DPO-PCR体系的灵敏度评价 按照1.2.1方法分别提取副溶血弧菌和霍乱弧菌的基因组DNA。用生物学分光光度计标定浓度为100 ng/μL,再按10倍梯度稀释为10、1、0.1、0.01、0.001 ng/μL的模板浓度,共六个模板浓度,分别取1 μL作为模板进行灵敏度实验。
1.2.7 双重DPO-PCR体系检测实际样品 采集9个养殖水样、3个湖泊水样品、9个贝壳样品共计21个样本,将样品接种于3% NaCl碱性蛋白胨水中,培养8 h后在TCBS培养基上划线分离得到疑似弧菌单菌落,并挑取该单菌落接种于含3% NaCl的TSB培养基中,按照1.2.1的方法来提取基因组DNA,然后利用已建立的多重DPO-PCR体系来鉴定分离得到的疑似弧菌菌株,同时对该菌株进行API生理生化实验[21],将两种方法得到的结果进行比较分析。
2 结果与分析
2.1 两种弧菌的双重DPO-PCR检测方法建立
调整了双重DPO-PCR体系中引物浓度,确定引物终浓度均为0.2 μmol/L,建立了副溶血弧菌和霍乱弧菌的双重DPO-PCR检测方法,结果如图1所示,双重DPO-PCR检测结果与单重DPO-PCR检测结果一致,则琼脂糖凝胶电泳检测在307 bp和463 bp处有特异性条带。

图1 双重DPO-PCR和单重DPO-PCR的结果Fig.1 Results of the multiplex DPO-PCR and single DPO-PCR注:M:Marker DL 2000;1:阴性对照;2:副溶血弧菌、霍乱弧菌;3:副溶血弧菌;4:霍乱弧菌。
2.2 双重DPO-PCR退火温度敏感性实验
由图2可知,在本研究DPO-PCR退火温度敏感性实验中,退火温度设定在45~65 ℃五个梯度,利用双重DPO-PCR检测体系均能高效扩增出目的基因即副溶血弧菌、霍乱弧菌,不同退火温度点对扩增结果影响不明显,表明所建立的双重DPO-PCR检测方法退火温度范围较宽并且对退火温度不敏感,弥补了常规双重PCR扩增结果易受退火温度变化的影响较大、扩增效果较差的缺陷。

图2 双重DPO-PCR退火温度敏感性实验Fig.2 Tm Sensitivity test of the multiplex DPO-PCR注:M:Marker DL 2000;1~5:退火温度依次为45、50、55、60、65 ℃。
2.3 双重DPO-PCR体系的特异性评价
DPO引物poly I的氢键结合力弱,扩增过程中,若DPO引物的5′或3′端有3个以上碱基发生错配,引物就会与模板脱离,从而不能正常发生反应,这大大增强了引物的特异性;同时DPO引物自身及引物间难形成二级结构[16]。本实验以副溶血弧菌collagenase基因和霍乱弧菌外膜蛋白ompW为靶基因建立的双重DPO-PCR检测方法对12种供试菌株DNA检测结果见图3,结果显示以副溶血弧菌和霍乱弧菌的基因组DNA混合物为模板的阳性对照、副溶血弧菌基因组DNA为模板及霍乱弧菌基因组DNA为模板的样品中顺利检出副溶血弧菌和霍乱弧菌特异性条带,而其它10种非目标菌及阴性对照均未出现目的条带,证明该方法能够准确地扩增出目标菌,且与其他菌株无交叉反应及非特异性扩增,表明所建立的双重DPO-PCR检测方法特异性强。

图3 多重DPO-PCR特异性实验Fig.3 Specificity test of the multiplex DPO-PCR注:M:Marker DL 2000;1:阴性对照;2:副溶血弧菌、霍乱弧菌;3:副溶血弧菌;4:霍乱弧菌;5:溶藻弧菌;6:创伤弧菌;7:拟态弧菌;8:梅氏弧菌;9:河流弧菌;10:哈维氏弧菌;11:鳗弧菌;12:大肠杆菌;13:金黄色葡萄球菌;14:单增李斯特菌。
2.4 双重DPO-PCR体系的灵敏度评价
灵敏度评价实验结果见图4,DNA模板含量在100、10、1、0.1 ng/μL时均可扩增出2条目的条带,且呈依次减弱,当模板量降到0.1 ng/μL以下时未能扩增到目的条带。检测体系对混合模板中副溶血弧菌和霍乱弧菌的DNA灵敏度较高,能大大增强该技术在不同实验室的可推广性。

图4 灵敏度实验Fig.4 Sensitivity test of the multiplex DPO-PCR 注:M:Marker DL 2000;1~6:2种病原菌DNA模板量从左到右依次为100、10、1、0.1、0.01、0.001 ng/μL。
2.5 双重DPO-PCR体系对实际样品的检测
1.2.7中的21个样品共分离到69个疑似弧菌菌落,其中有27个绿色菌落、42个黄色菌落。 API生理生化鉴定结果显示,24个绿色菌落为副溶血弧菌(V.parahaemolyticus),22个黄色菌落为溶藻弧菌(V.alginolyticus),1个黄色菌落为创伤弧菌(V.vulnificus),并没有分离到霍乱弧菌(V.cholerae)[21]。利用建立好的多重DPO-PCR体系对上述69个疑似弧菌菌落进行PCR鉴定,结果与前期的API生理生化实验结果一致。
3 结论
建立了两种病原弧菌副溶血弧菌和霍乱弧菌的双重DPO-PCR检测方法,该方法具有特异性强、灵敏度高、适用范围广的优点,适用于食品中这2种病原弧菌的快速筛检,具有较强的实用价值。同时今后还可以将多重DPO-PCR检测技术应用到更多的致病菌检测上,以更好的保障食品、水产品的安全,特别是对沿海地区,更能够有效的降低微生物中毒的发生。
[1]安秀华,林喜斌.上海市市售水产品中副溶血性弧菌的分离、鉴定及耐药性研究[J].中国人兽共患病学报,2009,25(7):657-659.
[2]方伟,黎微,柯昌文,等. 2006-2008年广东省水产品和食物中毒患者副溶血性弧菌分离株血清分型研究[J].中国食品卫生杂志,2009,21(4):352-356.
[3]张晓君,陈翠珍,阎斌伦,等.凡纳滨对虾病原副溶血弧菌的表型及分子特征[J].海洋与湖沼,2009,40(5):654-661.
[4]阎斌伦,秦国民,暴增海,等.三疣梭子蟹病原副溶血弧菌的分离与鉴定[J].海洋通报,2010,29(5):560-566.
[5]杨鸢劼,俞菊华,陈辉,等.暗纹东方鲀非O1霍乱弧菌的鉴定及毒力基因检测[J].水产学报,2006,30(4):525-530.
[6]Rabbani G H,Greenough W H. Food as a vehicle of transmission of cholera[J].Journal of Diarrhoeal Disease Research,1999,17(1):1-9.
[7]Boyd E F,Moyerk E,Shi L,et al.Infectious CTXPhi and the Vibrio pathogenicity island prophage in Vibrio mimicus:evidence for recent horizontal transfer betweenV.mimicusandV.cholerae[J]. Infection and Immunity,2000,68(3):1507-1513.
[8]邴旭文,阎斌伦,张晓君,等. 泥鳅病原霍乱弧菌的表型与分子鉴定[J].海洋与湖沼,2009,40(6):692-698.
[9]李红玉,梁卓智,林君仪.霍乱弧菌和副溶血弧菌混合感染一例[J].中华医学检验杂志,1990,22(3):144.
[10]温灿,顾小松,王荣智. 副溶血弧菌检测方法研究进展[J].福建农业学报,2015,30(7):709-717.
[11]Nordstrom J L,DePaola A. Improved recovery of pathogenic Vibrio parahaemolyticus from oysters using colony hybridization following enrichment[J].Microbiol Methods,2003,52(2):273-277.
[12]贺晓龙.霍乱弧菌及副溶血弧菌复合PCR检测方法的建立[J].青海大学学报,2006,24(2):59-61.
[13]扈庆华,郑薇薇,石晓路,等.双重实时PCR快速同时检测霍乱弧菌和副溶血弧菌[J].中华微生物学和免疫学杂志,2004,24(12):1004-1007.
[14]王玉平.变性高效液相色谱法同时检测5种食源性致病菌[J].现代预防医学,2009,36(18):3520-3523.
[15]Chun J Y,Kim K J,Hwang I T,et al. Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene[J].Nucleic Acids Res,2007,35(6):e40.
[16]张娜,乾义柯,魏霜,等. 两种向日葵检疫性真菌病害的多重DPO-PCR检测方法[J].植物检疫,2015,6(29):35-38.
[17]李丹丹,徐义刚,王昱,等.创伤弧菌DPO-PCR检测方法的建立[J].食品科技,2015,40(11):287-290.
[18]徐义刚,李丹丹,刘忠梅,等.产肠毒性大肠杆菌 DPO-PCR检测方法的建立与应用[J].中国生物工程杂志,2013,33(11):75-80.
[19]徐义刚,李丹丹,崔丽春,等.应用DPO-PCR技术检测肠出血性大肠杆菌O157∶H7[J].食品科学,2014,35(8):160-164.
[20]徐义刚,李丹丹,刘忠梅,等.应用DPO-PCR方法特异性检测志贺氏菌[J].中国畜牧兽医,2014,41(3):28-31.
[21]魏霜,冼钰茵,赵晖,等.多重PCR检测四种食源性病原弧菌[J].中国农业科学,2013,46(8):1682-1686.
Multiplex DPO-PCR for the detection ofVibrioparahaemolyticusandVibriocholerae
WEI Shuang1,2,MA Xin-hua3,WANG Tian-jie4,LONG Yang3,JI Qiang1,REN Jiao1,WU Xi-yang2,*
(1.Shantou Entry-Exit Inspection and Quarantine Bureau,Shantou 515041,China; 2.Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China; 3.Zhanjiang Entry-Exit Inspection and Quarantine Bureau,Zhanjiang 524022,China; 4.Guangzhou Entry-Exit Inspection and Quarantine Bureau,Guangzhou 510623,China)
Based on collagenase gene sequences ofVibrioparahaemolyticusand ompW gene sequences ofV.cholerae,designed two pairs of DPO(dual priming oligonucleotide)primers. A multiplex DPO-PCR method had been developed for the detection ofV.parahaemolyticusandV.choleraesimultaneously. The specificity and sensitivity of the method had been tested. The result showed that the DPO primers were of high specificity. Amplified fragments 307 bp forV.parahaemolyticusand 463 bp forV.choleraewere obtained,the sensitivity of the method was 0.1 ng/μL forV.parahaemolyticusandV.cholerae. The multiplex DPO-PCR was not sensitive to the annealing temperature. The multiplex DPO-PCR was validated with 69 suspicious vibrio strains and the results was consistent with physiological and biochemical experiments. The multiplex DPO-PCR method proved to be strong specificity,high sensitivity. This method was suitable for the detection ofV.parahaemolyticusandV.cholerain food,aquatic products,etc.
Vibrioparahaemolyticus;Vibriocholerae;multiplex DPO-PCR
2016-05-27
魏霜(1988-),男,硕士,农艺师,研究方向:病原微生物检测,E-mail:weishuang2008@hotmail.com。
*通讯作者:吴希阳(1966-),男,博士,教授,研究方向:病原微生物检测,E-mail:tkentwu@jnu.edu.cn。
湛江市科技计划项目(2014C01007);广东出入境检验检疫局科技计划项目(2015GDK27);广东省科技计划项目-国际科技合作领域(2015A050502030)。
TS201.7
A
1002-0306(2016)22-0080-04
10.13386/j.issn1002-0306.2016.22.007

