一种基于赖氨酸聚酯氨新型载药纳米水凝胶接枝真丝缝合线的抗菌性能
崔海春,伍丽丽 ,吴德群, c,俞建勇
(东华大学 a. 纺织学院; b. 纺织面料技术教育部重点实验室;c. 产业用纺织品教育部工程研究中心; d.研究院,上海 201620)
一种基于赖氨酸聚酯氨新型载药纳米水凝胶接枝真丝缝合线的抗菌性能
崔海春a, b,伍丽丽a, b,吴德群a, b, c,俞建勇d
(东华大学 a. 纺织学院; b. 纺织面料技术教育部重点实验室;c. 产业用纺织品教育部工程研究中心; d.研究院,上海 201620)
真丝缝合线因其优良的天然物理特性而作为一种常用的外科手术缝合线,但缝合线的结构缝隙容易藏匿细菌,其蛋白质的特性易吸附细菌,导致毛细血管作用下细菌对伤口的渗透,使得手术部位感染(SSIs)的发生率居高不下. 以一种新型生物相容性好、可降解的赖氨酸聚酯氨纳米水凝胶作为抗菌剂的载体,通过化学接枝的方法将载药纳米水凝胶均匀地接枝在真丝缝合线的表面,确保真丝缝合线长效缓释药物而具有抗菌功能.选取金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)对接枝处理的真丝缝合线进行抑菌带宽度、抗菌持久性等抗菌性能试验. 结果表明,接枝了载药纳米水凝胶的真丝缝合线具有优异的长效缓释抗菌效果.
载药纳米水凝胶; 真丝缝合线; 化学接枝; 抗菌性能
近年来,具有生物可降解功能的纳米聚合物作为药物载体已经被广泛应用于医疗领域. 由于自身的3维多孔网络状结构以及高含水特性,纳米尺寸聚合水凝胶与一般纳米聚合物相比,其在一定类型的载药功能方面具有更加优异的特点[1].
真丝缝合线作为一种天然蛋白质材料,因其良好的力学性能在外科手术中使用广泛[2]. 但缝合线的编织结构以及动物蛋白性质为细菌的生长提供了良好的生长环境,同时伤口组织的缝合线会产生毛细血管作用,导致细菌在缝合线表面黏附以及定植,从而形成很难治愈的生物膜[3]. 因此,制备具有良好抗菌性能的缝合线具有重要的临床意义.
选用三氯生作为抗菌药物以及新型赖氨酸聚酯氨纳米水凝胶作为药物载体[4],将含有氨基自由基的纳米水凝胶接枝在具有羧基的真丝缝合线的表面,从而使得传统的真丝缝合线具有长效抗菌的功能.
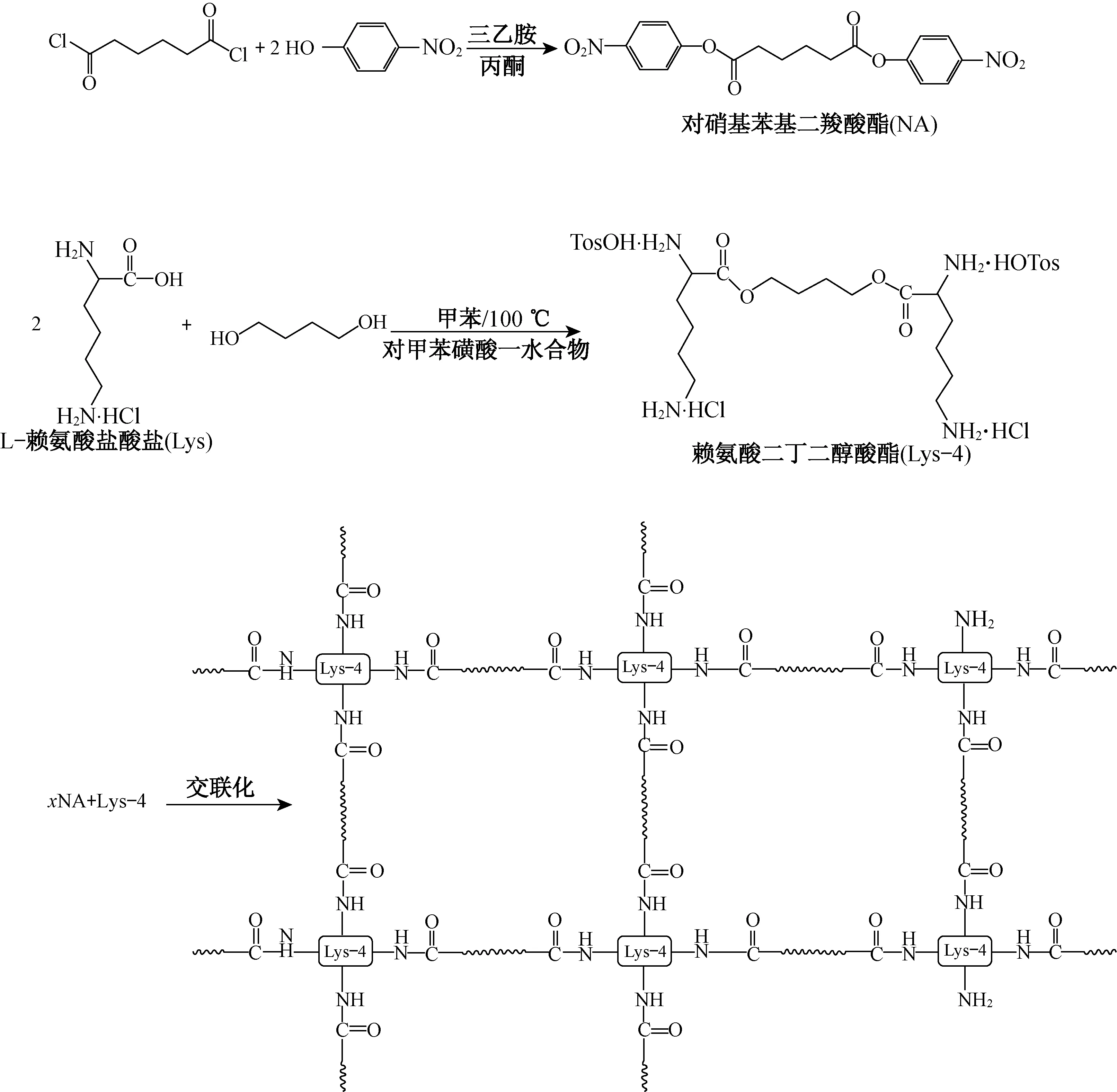
图1 赖氨酸二丁二醇酯、对硝基苯基二羧酸酯以及赖氨酸聚酯氨水凝胶的合成Fig.1 Chemical synthesis of Lys4 monomer, di-p-nitrophenyl monomer and Lys4 based macrogels
1 试验部分
1.1 试验原料
L-赖氨酸盐酸盐(Lys);对甲苯磺酸一水合物(TosOH·H2O)购自美国 Sigma-Aldrich 公司,分析纯;己二酰氯(C7H8Cl2O2);1,4-丁二醇购自美国Acros Organics;对硝基苯酚;三乙胺(Et3N,AR);甲苯(C7H8,AR);乙酸乙酯(EA,AR);丙酮(C3H6O,AR);N,N’-二甲基乙酰胺(DMAc);异丙醇;胰蛋白酶;1-(3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐(EDC,BR); N-羟基丁二酰亚胺(NHS,BR);医用真丝缝合线3-0购自杭州爱普医疗器械有限公司.
二羧酸酯(NA)的制备
按2∶1的摩尔比准确称取85.12 g赖氨酸与20.00 g 1,4-丁二醇,将两者一起混合放入1 L的单层玻璃反应釜中,加入适量的对甲苯磺酸单水合物以及甲苯,在125 ℃的条件下反应24 h,待反应完全后将甲苯倒出继续加入异丙醇500 mL在70 ℃下溶解. 等待反应产物完全溶解后将溶液在-19 ℃下低温保存12 h,待产物完全结晶后倒出上清液,对结晶产物连续抽真空直至产物中的异丙醇被完全抽走,收集得到赖氨酸二丁二醇酯[5]. 准确称量60.41 g己二酰氯、110.00 g对硝基苯酚、71.88 g三乙胺以及600 mL丙酮,先后将对硝基苯酚、三乙胺以及450 mL丙酮加入1 L圆底烧瓶,常温下采用磁力搅拌器充分混合. 在-78 ℃磁力搅拌混合液的条件下,用恒压滴液漏斗逐滴滴入溶于150 mL丙酮的乙二酰氯溶液,充分反应4~6 h. 待反应充分后将产物倒入2 L大烧杯中反复用纯水抽滤清洗,待产物中的杂质完全去除时进一步对产物进行真空干燥,去除产物中含有的水分并将对硝基苯基己二酸酯单体收集储存.
1.3 载药赖氨酸聚酯氨水凝胶的制备
对硝基苯基己二酸酯单体和赖氨酸二丁二醇酯按1.5∶1和2∶1的摩尔比溶于DMAc中,得到混合溶液,在45~50 ℃条件下将单体溶解,然后加入溶解有抗菌剂三氯生的三乙胺溶液,在60~80 ℃条件下反应0.5~1 h,清洗产物,得到抗菌性水凝胶4-Lys-4(1.5∶1) DL和4-Lys-4(2∶1) DL[6]. 合成方程式和配方分别如图1和表1所示.

表1 赖氨酸聚酯氨纳米水凝胶的制备配方
注:DL代表载药水凝胶.
1.4 抗菌纳米水凝胶的制备
胰蛋白酶溶于磷酸盐缓冲溶液中,得到酶浓度为0.1 mg/mL的降解液,然后在37 ℃条件下对抗菌性水凝胶水浴降解7 d.采用相对分子质量为10万的透析袋对得到的降解液进行透析,去除抗菌纳米粒子溶液中的杂质. 冷冻干燥纳米粒子溶液,得到抗菌功能的纳米粒子.
1.5 抗菌真丝缝合线的制备
按摩尔比为1∶1称取EDC和NHS,配成EDC质量浓度为0.1 g/mL的2-(N-吗啡啉)乙磺酸(MES)缓冲液4 mL,在0 ℃环境下,将真丝长度为4 cm缝合线浸没在MES缓冲液中且磁力搅拌条件下表面活化6 h,缓冲液pH值=5.5[7].
称取抗菌纳米凝胶分散在去离子水中,制成2 g/L的纳米粒子溶液1 mL.
接枝前使用0.45 μm的无针式过滤器过滤纳米粒子溶液,然后将纳米粒子溶液加入4 mL MES缓冲液中,在0 ℃条件下磁力搅拌进行化学接枝,24 h后使用去离子水洗去真丝缝合线表面未接枝上的抗菌纳米粒子等杂质,常温干燥制得具有长效缓释抗菌性能的真丝缝合线.
1.6 抗菌性能测试
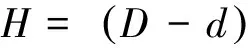
1.7 抗张强力性能测试
选用温州大荣纺织仪器有限公司生产的YG(B)026G型医用纺织品强力仪作为真丝缝合线的强力测试仪器. 在恒温恒湿条件下,试样的拉伸初始隔距为125 mm,拉伸速度为300 mm/min[9].每种试样测试4次,取平均值.
2 结果与分析
2.1 水凝胶红外光谱分析
采用红外光谱分析鉴别水凝胶的特征峰[10].水
凝胶 4-Lys-4(1.5∶1) 以及4-Lys-4(2∶1) 的红外光谱图如图2所示.从图2可以看出,4-Lys-4水凝胶在1 739 cm-1(C=O对称伸缩振动)、1 629 cm-1(酰胺键I弯曲振动)以及1 550 cm-1(酰胺键II弯曲振动)处有特征吸收峰[4]. 通过以上分析可知,确认制备了水凝胶4-Lys-4(1.5∶1) 以及4-Lys-4(2∶1).
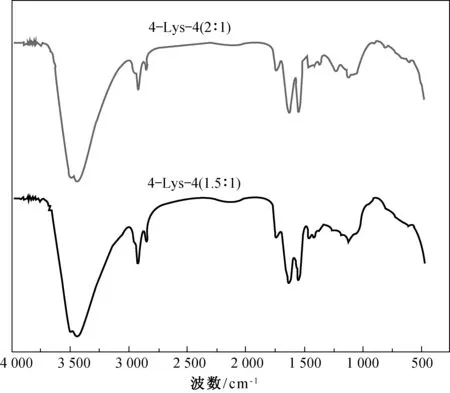
图2 纳米水凝胶4Lys4(1.5∶1) 和 4Lys4(2∶1)的红外光谱 Fig.2 FTIR spectra of the lysine based nanogel 4Lys4(1.5∶1) and 4Lys4(2∶1)
2.2 水凝胶表面形貌分析
4-Lys-4 (1.5∶1)和4-Lys-4 (2∶1) 干凝胶的扫描电子显微镜(SEM)图如图3所示. 从图3可以看出,水凝胶4-Lys-4具有丰富的3D网络状多空结构,并且随着NA与Lys-4摩尔比的增加,水凝胶的交联密度增加、孔径变小.
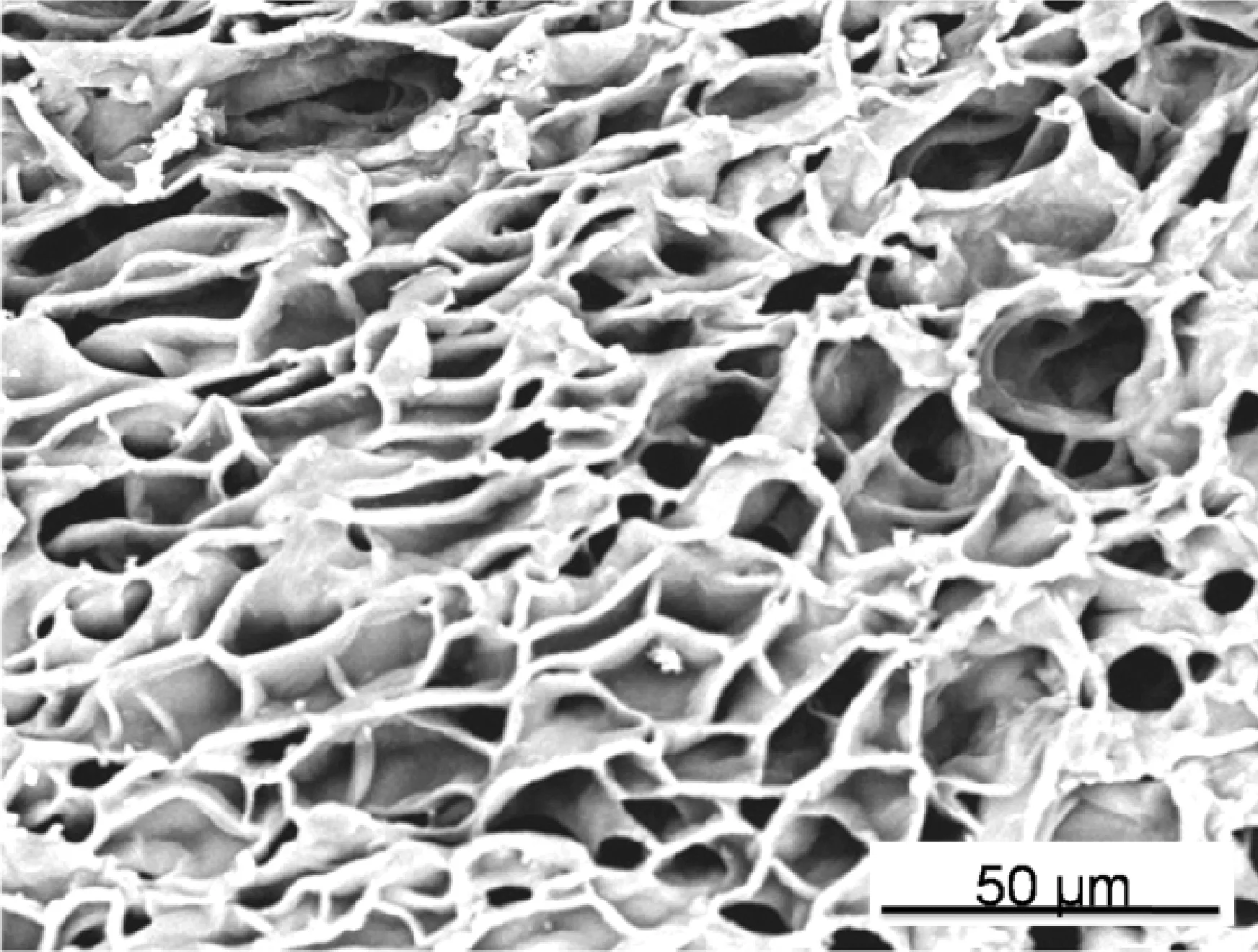
(a) 4Lys4(1.5∶1)

(b) 4Lys4(2∶1)

2.3 水凝胶的溶胀分析
4-Lys-4 (1.5∶1)和4-Lys-4 (2∶1)水凝胶的溶胀速率曲线[11]如图4所示. 从图4可以看出,随着NA用量的增加,凝胶的溶胀速率以及平衡溶胀率均下降,符合亲水性水凝胶的溶胀性状. 由于随着NA与Lys-4摩尔比的增大,合成的水凝胶的交联密度增大、孔径减小,从而使水凝胶的溶胀能力降低.

图4 25 °C条件下赖氨酸聚酯氨纳米水凝胶在去离子水中的溶胀曲线 Fig.4 Swelling kinetics of the Lys4 based nanogels in distilled water at 25 °C
2.4 载药纳米水凝胶粒径分析
胰蛋白酶生物降解7 d后赖氨酸基4-Lys-4纳米水凝胶的透射电子显微镜(TEM)图如图5所示.在相同生物降解条件下,水凝胶降解的快慢取决于酰胺键的交联密度以及水凝胶的亲疏水性[4].纳米水凝胶4-Lys-4(2∶1)比4-Lys-4(1.5∶1)的交联密度大、孔径小,因而在相同降解条件下,其降解速率比4-Lys-4(1.5∶1)慢.从图5可以得出预载药对纳米凝胶得到的粒径以及形貌没有明显影响.纳米水凝胶4-Lys-4(2∶1)和4-Lys-4 (1.5∶1) 的平均粒径分别为230和190 nm.


(a) 4-Lys-4(1.5∶1) (b) 4-Lys-4(1.5∶1)DL


(c) 4-Lys-4(2∶1) (d) 4-Lys-4(2∶1)DL


2.5 抗菌缝合线结构分析
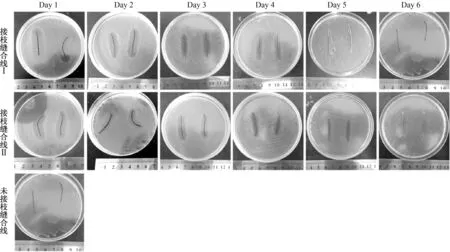
通过SEM观察和分析未接枝处理和经化学接枝处理过的真丝缝合线的表面形态变化,结果如图6所示. 由图6(a)可以看出,未经接枝前缝合线的直径约为500 μm,表面纤维光滑且纤维之间存在大量的缝隙.由图6(b)和6(c)可以看出,两种接枝缝合线的纤维表面和缝隙都接有抗菌纳米凝胶.
2.6 抗菌性能测试
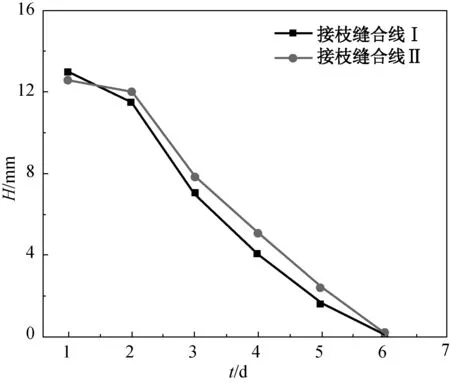
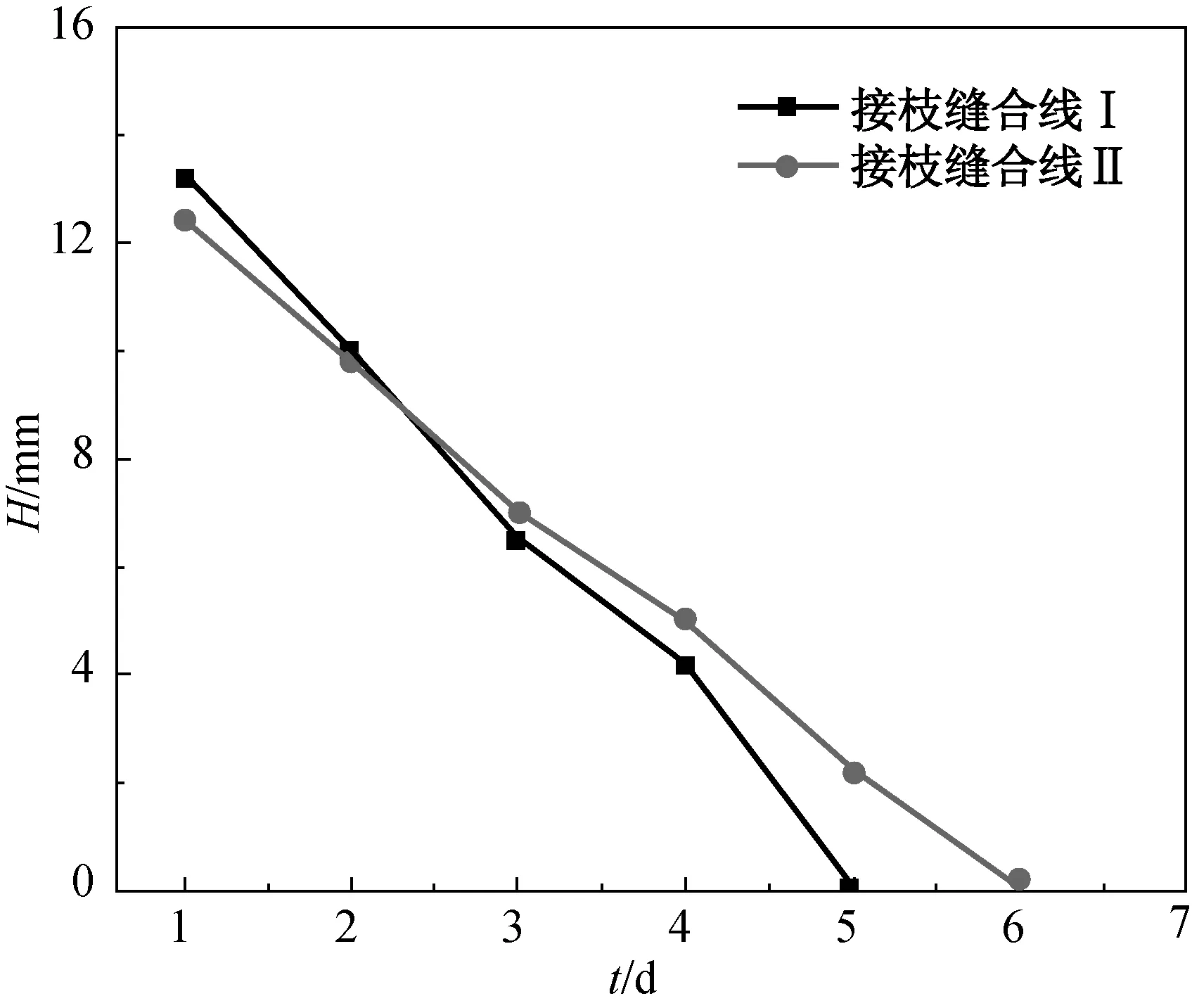
两种新制得的抗菌真丝缝合线对金黄色葡萄球菌的抗菌性能测试结果如图7所示.由图7可知:两种真丝缝合线的抗菌性持续5 d,第5 d虽无明显抑菌带,但缝合线下无细菌生长;同等条件下接枝缝合线 Ⅱ(接枝4-Lys-4 (2 ∶ 1) DL纳米水凝胶的缝合线)的抑菌性能比缝合线 Ⅰ(接枝4-Lys-4 (1.5 ∶ 1) DL纳米水凝胶的缝合线)的抑菌性能好. 抗菌真丝缝合线对大肠肝菌的抗菌性能测试结果如图8所示. 由图8可知,接枝缝合线 Ⅰ 和 Ⅱ 的抗菌性持续分别为5和6 d;接枝缝合线 Ⅱ 的抗菌性能较接枝缝合线 Ⅰ 好. 综上可得,在相同条件下纳米水凝胶4-Lys-4 (2 ∶ 1)的抗菌性能好于4-Lys-4 (1.5 ∶ 1).



(a) 未接枝 (b) 接枝4-Lys-4 (1.5 ∶ 1) DL (c) 接枝4-Lys-4 (2 ∶ 1) DL
(a)
(b)
(b)
图8 两种抗菌真丝缝合线对大肠杆菌抑菌圈宽度
Fig.8 Zone of inhibition of two antibacterial silk sutures against E.coli
2.7 抗张强力性能测试
真丝缝合线接枝前后的抗张强力测试结果如表2所示. 由表2可知,化学接枝后真丝缝合线的平均抗张强力略小于接枝前真丝缝合线,但都大于国家标准要求的最低强力9.41 N.
表2 接枝前后真丝缝合线的抗张强力平均值
Table 2 Mean tensile strength values of silk sutures before and after grafting

N
3 结 语
本文以赖氨酸盐酸盐、己二酰氯为原料,合成赖氨酸聚酯氨水凝胶为药物载体,在同等条件下由不同NA与Lys-4的摩尔比制得两种不同的抗菌纳米凝胶. 利用纳米凝胶表面的羧基自由基将载药纳米凝胶接枝在具有氨基的真丝缝合线表面,并对接枝后的真丝缝合线进行抗菌性能测试. 测试结果表明,接枝处理后的真丝缝合线具有优良的抗菌性能,同时基本保留了原有的物理性能. 随着NA与Lys-4摩尔比的增加,使得合成的水凝胶交联密度变大、载药能力加强,接枝4-Lys-4(2 ∶ 1) DL纳米水凝胶的缝合线的抑菌性能要好于接枝4-Lys-4(1.5 ∶ 1) DL纳米水凝胶的缝合线.
[1] GU Z, YAN M, HU B L, et al. Protein Nanocapsule weaved with enzymatically degradable polymeric network[J]. Nano Letters, 2009, 9 (12):4533-4538.
[2] EDMISTON C E, SEABROOK G R, GOHEEN M P, et al. Bacterial adherence to surgical sutures: Can antibacterial-coated sutures reduce the risk of microbial contamination[J]. Journal of the American College of Surgeons, 2006, 203 (4):481-489.
[3] GEIGER D, DEBUS E S, ZIEGLER U E, et al. Capillary activity of surgical sutures and suture-dependent bacterial transport: A qualitative study[J]. Surgical Infections, 2005, 6 (4):377-383.
[4] WU D, WU J, QIN X H, et al. From macro to micro to nano: Development of a novel lysine based hydrogel platform and the enzyme triggered self-assembly of macro hydrogel into nanogel[J]. Journal of Materials Chemistry B, 2015,3 (11): 2286-2294.
[5] WU J, YAMMANOUCHI D, LIU B, et al. Biodegradable arginine-based poly(ether ester amide)s as a non-viral DNA delivery vector and their structure-function study[J]. Journal of Materials Chemistry, 2012, 22 (36):18983-18991.
[6] WU J, WU D, MUTSCHLER M A, et al. Cationic hybrid hydrogels from amino-acid-based poly(ester amide): Fabrication, characterization, and biological properties[J]. Advanced Functional Materials, 2012, 22 (18):3815-3823.
[7] 胡志伟. 以EDC/NHS为交联剂的丝素蛋白基大孔微载体的制备与研究[D]. 广州:南方医科大学基础医学院,2011:66-70.
[8] 纺织品抗菌性能的评价—第1部分:琼脂平皿扩散法: GB-Y-20944.1—2007 [S].
[9] 陈晓洁,王璐,侯丹丹,等.医用缝合线摩擦性能测试装置及测试方法: CN 103926195[P].2014-07-16.
[10] 袁天军,王家俊,者为,等. 近红外光谱法的应用及相关标准综述[J]. 中国农学通报,2013,29(20):190-196.
[11] WU D Q, WU, J,CHU C C. A novel family of biodegradable hybrid hydrogels from arginine-based poly(ester amide) and hyaluronic acid precursors[J]. Soft Matter, 2013, 9 (15):3965-3975.
A Novel Lysine Based Drug Loading Nanogel Carrier Grafted Silk Sutures Against Pathogens
CUIHai-chuna,b,WULi-lia,b,WUDe-quna,b,c,YUJian-yongd
(a. College of Textiles;b. Key Laboratory of Textile Science & Technology, Ministry of Education; c. Engineering Research Center of Technical Textiles, Ministry of Education;d. Research Institute, Donghua University,Shanghai 201620,China)
Silk sutures can be commonly used in surgeries for its nature and physical properties. However, silk sutures also could cause challenging surgical site infections, due to the suture structure cracks easily hiding bacteria and the adsorption capillary effects resulting in bacteria permeating wounds. Through the methods of chemical grafting, a new type of biocompatibility, biodegradable lysine drug-loading nanogels were grafted on the surface of silk suture, to ensure that the silk suture has long-term slow-release antibacterial function. Antimicrobial tests against gram negative bacteria Escherichia coli (ATC 25922) and gram positive bacteria Staphylococcus aureus (ATC 25923) were then carried out to compare the efficacy and drug release assay. The results reveal that the grafting sutures have excellent sustained antibacterial efficacy.
drug loading nanogels; silk suture; chemical grafting; antibacterial performance
1671-0444 (2016)06
2015-09-10
中央高校基础研究基金资助项目;浦江人才计划资助项目(14PJ1400300)
崔海春(1989—),男,安徽蚌埠人,硕士研究生,研究方向为新型抗菌手术缝合线. E-mail: haichuncui@163.com 吴德群(联系人),男,副教授,E-mail: dqwu@dhu.edu.cn
TS 141.8
A

