超滤法去除重组腺相关病毒中内毒素的应用
唐明青, 张文豪,2, 侯莹, 成志云,郭思佳, 王立振, 刘慧, 许瑞安
(1. 华侨大学 生物医学学院, 福建 泉州 362021;2. 福建医科大学 基础医学院, 福建 福州 350108)

超滤法去除重组腺相关病毒中内毒素的应用
唐明青1, 张文豪1,2, 侯莹1, 成志云1,郭思佳1, 王立振1, 刘慧1, 许瑞安1
(1. 华侨大学 生物医学学院, 福建 泉州 362021;2. 福建医科大学 基础医学院, 福建 福州 350108)
为探讨超滤法在重组腺相关病毒精制中的可行性,采用不同截留分子量的超滤管对重组腺相关病毒样品rAAV9-Kal进行超滤处理.利用鲎试剂盒和qPCR法定量检测截留液和滤过液中的内毒素和病毒含量,评价超滤技术对样品中内毒素的去除效果.结果表明:在乙二胺四乙酸二钠和脱氧胆酸钠的预处理下,30 kD的超滤管对样品的回收率及内毒素去除率分别为0.912 2,0.870 6.因此,在单一超滤条件下,30 kD的超滤管是重组腺相关病毒样品超滤纯化的最佳选择. 关键词: 重组腺相关病毒; 超滤; 截留分子量; 内毒素; 纯化
重组腺相关病毒(rAAV)属于微小病毒科的单链DNA病毒,具有天然非致病性、免疫原性低、宿主范围广、可转染分裂细胞和非分裂细胞及介导外源基因长期表达等特性,是最有前景的基因治疗载体之一[1].目前,基于rAAV的基因治疗药物Glybera已率先在欧盟上市[2].内毒素(ET)是由革兰氏阴性菌细胞壁裂解释放的脂多糖类物质,极微量(1~5 ng·kg-1)的内毒素作用于机体内的内生致热原生成细胞即可导致机体发热,大剂量可引起血液循环障碍和内毒素休克[3].在rAAV制备过程中,一个重要的质控指标就是内毒素,尤其是应用于临床的rAAV,内毒素安全限量为小于83.35 μkat·L-1[4].目前常用的内毒素去除手段如活性炭吸附法、阴离子交换层析法和TritonX-114液相萃取法普遍存在选择性低的问题,而高选择性的亲和膜色谱法又存在配基选择、介质合成困难、过程繁琐、技术要求高的限制[5].超滤技术是通过膜表面的微孔结构对物质进行选择性分离,从而实现大、小分子的分离、浓缩、净化的目的.虽然内毒素单体的相对分子质量仅为10~20 kD,但由于内毒素通常以聚合态形式存在,其相对分子质量可以高达1 000 kD以上.因此,超滤技术非常适合在小分子量产品中进行内毒素的去除工作,如注射制剂及工程疫苗内毒素的去除[6],但其在rAAV这种超大分子量产品(大于10 000 kD)中的内毒素去除效应却未见相关报道.为探讨在rAAV制备中应用超滤管进行rAAV浓缩与清除内毒素的可行性,本文研究采用不同截留分子量(molecular weight cut off,MWCO)的超滤管,对实验室制备的携带人组织激肽释放酶结合蛋白基因(Kal)的rAAV9-Kal样品进行超滤离心处理,收集滤过液和截留液进行内毒素及病毒基因组(viral genome,VG)定量检测和衣壳蛋白定性表征,以综合评价超滤管对rAAV浓缩与内毒素去除效果.
1 材料与方法
1.1 试剂耗材
rAAV9-Kal样品由分子药物教育部工程研究中心下辖的rAAV中试车间提供;Amicon Ultra-4超滤管(厦门市鹭隆生物公司);快速银染试剂盒(海门市碧云天生物技术研究所);显色基质鲎试剂盒(厦门市鲎试剂实验厂有限公司);SYBR Select Master Mix(上海市英潍捷基贸易有限公司);定量PCR引物(南京市金斯瑞生物科技有限公司);小鼠抗VP1/VP2/VP3单克隆抗体和兔抗小鼠IgG单克隆抗体(上海市英潍捷基贸易有限公司);ECL化学发光试剂盒(厦门市鹭隆生物公司).
1.2 Realtime PCR引物设计
根据GenBank中人Kallistatin基因序列(L19684.1),使用Primer 5.0软件设计引物序列为
Kal-S: 5′-GCTGTCTGAGTCCGATGTCC-3′,
Kal-AS: 5′-TGTCGTAGAAGTTGGTGTGG-3′,扩增产物长度191 bp.
1.3 超滤离心
取rAAV9-Kal(2.5×1012VG·L-1)4 mL,分别加于MWCO为3,10,30,50,100 kD的Amicon Ultra-4超滤管中,以7 500g,4 ℃,离心15 min收集截留液和滤过液.
1.4 内毒素检测
按照2010版《中华人民共和国药典》吸光度法内毒素检测要求及显色基质鲎试剂盒使用说明进行标准曲线绘制、可靠性试验、干扰实验及内毒素测定.提前配制显色基质溶液、偶氮化试剂1、偶氮化试剂2、偶氮化试剂3,用内毒素检查用水配制活性浓度为0.10,0.25,0.50,16.67 μkat·L-1细菌内毒素标准液.按标示量,加细菌内毒素检查用水于鲎试剂中,并轻轻振摇使其溶解完全.
在装有100 μL加内毒素检查用水、内毒素标准液或经超滤处理后的待测rAAV9-Kal样品(截留液和滤过液)的无热原试管中,加入100 μL鲎试剂溶液,混匀,在37 ℃温育10 min.接着,加入100 μL显色基质溶液,混匀,再次在37 ℃温育6 min.温育结束,依次加入500 μL偶氮化试剂1、偶氮化试剂2、偶氮化试剂3,每次加完试剂后均混匀,并在加入偶氮化试剂3混匀后室温静置5 min,于545 nm波长处测吸光度值,每个检测反应设3个平行管.
1.5 定量检测
分别取2 μL的截留液及超滤液、10 μL的2×SYBR Select Master Mix、0.5 μL的引物Kal-S及Kal-AS,7 μL的纯水,在StepOne Plus定量PCR仪上运行.95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环.最后,进行相对定量计算,即
1.6 病毒鉴定
配制质量分数为10%的分离胶和质量分数为4.5%的浓缩胶,分别取截留液及超滤液25 μL,加入5 μL蛋白上样缓冲液.煮沸变性5 min,每孔上样28 μL,60 V恒压电泳分离;电泳结束后进行PVDF膜转膜,条件为250 mA,2 h;随后小鼠抗VP1/VP2/VP3单克隆抗体4℃孵育过夜,兔抗小鼠IgG单克隆抗体室温孵育2 h,ECL显色,置于凝胶成像系统中显影、定影.
1.7 统计学分析
采用SPSS21.0统计学软件进行数据统计分析,不同实验组间病毒及内毒素水平用x表示.
2 实验结果
2.1 rAAV9-Kal的回收率
收集不同规格超滤管超滤后的滤过液(3kD-P,10kD-P,30kD-P,50kD-P,100kD-P)、截留液(3kD-R,10kD-R,30kD-R,50kD-R,100kD-R)、原液(rAAV9-Kal)并统一稀释至4 mL初始体积,通过qPCR仪进行滴度相对定量.在统一体积条件下,定量计算rAAV9-Kal的回收效率,如表1所示.
由表1可知:MWCO为3,10,30,50,100 kD的超滤管对rAAV9-Kal进行超滤(7 500g,4 ℃,15 min)后的产品回收率分别为0.957 0,0.941 3,0.919 9,0.842 0,0.642 5.鉴于前3者对产品的损伤率均小于10%,因此,单纯考虑产品回收率时,在实际rAAV超滤中,以选择MWCO为3,10,30 kD的超滤管为佳.

表1 rAAV9-Kal的回收率测定Tab.1 Recovery rate of rAAV9-Kal samples
2.2 rAAV9-Kal的内毒素去除率
超滤管超滤后,收集不同规格的滤过液、截留液、原液,并统一稀释至4 mL的初始体积,通过鲎试剂盒测定各自内毒素活力,发现超滤前样品的内毒素活力为31.006 nkat·mL-1,经MWCO为3,10,30,50,100 kD的超滤管超滤后截留液的内毒素活力分别为30.173,30.006,28.893,24.005,17.504 μkat·L-1,其对应的截留率分别为0.998 7,0.987 7,0.982 263,0.944 1,0.785 8,0.573 0,而滤过液的内毒素活力分别为1.000,3.501,4.501,6.001,10.169 nkat·mL-1,其对应的滤过率分别为0.032 8,0.114 6,0.147 3,0.196 5,0.332 9,如图1所示.
图1中:管号1~10分别为3k-R,10k-R,30k-R,50k-R,100k-R,30k-P,10k-P,50k-P,100k-P,3k-P.由图1可知:内毒素的滤过率虽然随着MWCO增大而增大,但基本不能透过MWCO小于30 kD的超滤管,去除效率并不理想,超滤工艺有待进一步优化.

(a) 内毒素检测实验 (b) 内毒素活力统计图1 rAAV9-Kal的内毒素检测Fig.1 Endotoxin analysis of rAAV9-Kal samples
2.3 超滤工艺的优化及效果
用质量浓度为0.2 mg·mL-1的乙二胺四乙酸二钠(EDTA)和质量浓度为5 mg·mL-1的脱氧胆酸钠(DOC)预处理rAAV9-Kal样品30 min(冰浴搅拌),再用3,10,30 kD的超滤管进行超滤处理,分析滤过液和截留液中rAAV9-Kal的滴度及内毒素的活力变化.结果发现,样品预处理后,超滤管对rAAV9-Kal的滤过性有轻微增加,但对内毒素的滤过性则有显著性增大.
rAAV9-Kal回收率及内毒素去除率测定,如表2所示.由表2可知:3,10,30 kD的超滤管对样品的回收率分别为0.953 0,0.938 5和0.9122,对内毒素的去除率分别为0.772 3,0.831 4和0.870 6.综合考虑超滤时间、回收率、内毒素去除率等因素,30 kD超滤管可以作为rAAV9-Kal样品超滤纯化的基本选择.其纯化效果还可以通过进一步优化样品预处理的条件实现进一步优化.
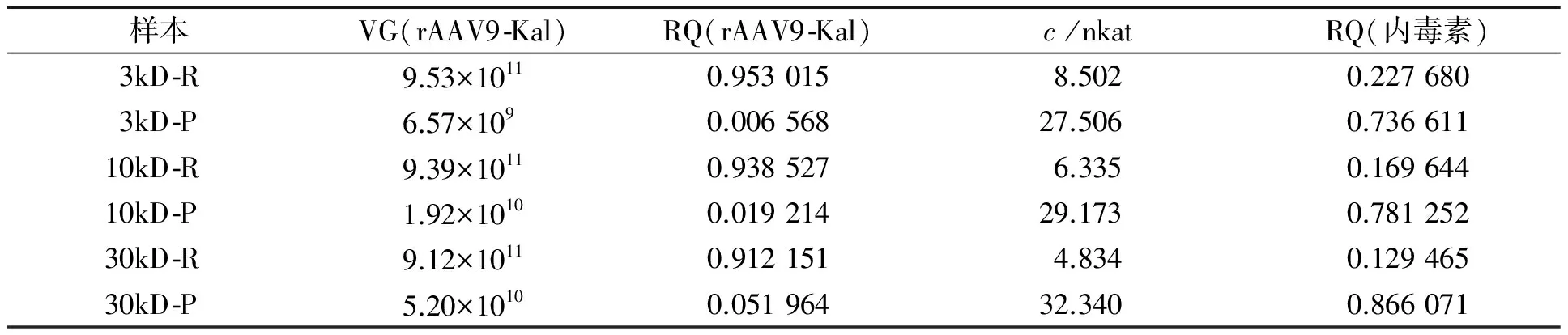
表2 rAAV9-Kal回收率及内毒素去除率测定Tab.2 Recovery rate of rAAV9-Kal and removal rate of endotoxin in samples

图2 rAAV9-Kal的衣壳蛋白检测Fig.2 Capsid protein analysis of rAAV9-Kal samples
2.4 超滤纯化后rAAV的鉴定
收集不同规格超滤管超滤后的滤过液、截留液、原液并统一稀释至4 mL初始体积,通过WB对各组分进行定性鉴定,如图2所示.图2 中:泳道1~3分别为3kD-R,10kD-R,30kD-R.由图2可知:在超滤条件优化后,MWCO为3,10,30 kD的超滤管超滤后截留液中rAAV9-Kal的目的条带完整(VP1,VP2,VP3)且比例正确(1∶1∶10);优化后的超滤处理并不影响回收对象rAAV9-Kal的物理性质.
3 讨论
超滤离心的原理是以特定孔径的微孔滤膜为过滤介质,在一定的离心力作用下,使待处理液体经过超滤管,迫使小分子物质和溶剂经过膜面进入下部的收集管,而大分子物质被截留从而达到浓缩和分离的目的[7].由于此类方法操作简便,对设备要求不高,加上超滤管经再生处理后可重复使用,在注射制剂中内毒素的去除上已初见成效,但尚未有关其在rAAV产品纯化与内毒素去除方面的研究报道.
通过选用不同截留分子量的超滤管对rAAV9-Kal样品进行超滤离心处理,以期获得一种能够实现产品纯化与内毒素去除的超滤条件.实验结果表明:在7 500g,4 ℃,15 min 超滤条件下,MWCO小于30 kD的超滤管对rAAV样品具有较高的回收率,最低为0.919 9,但此时内毒素去除率并不理想,最高仅为0.017 8,超滤工艺有待进一步优化.
通过对内毒素自身性质的分析可以发现,内毒素具有化学异源性,来源不同的内毒素形态和相对分子质量均不确定,相对分子质量变化范围可从几千到几万,而且在水溶液中存在多种分散形态,如胶束和缔合体,尤其是缔合体的分子质量可达1 000 kD,直径达10 nm[8].
由于rAAV是经过氯化铯梯度离心后的半成品,此时样品中所含内毒素的分子量及物理尺寸与分离对象rAAV极为相似,因此,样品中残留的内毒素主要以缔合体形式存在[9],进而可能导致本实验中内毒素与rAAV样品的分离效果差.其次,内毒素在Ga2+等二价阳离子的存在下极容易聚合,而rAAV在制备过程中正好需要使用一定质量浓度的GaCl2及MgCl2.因此,在超滤优化中尝试采用去污剂DOC及螯合剂EDTA预处理样品,以实现将聚合态内毒素解聚,从而降低其分子量.最终优化后超滤效果表明:样品预处理后,超滤管对rAAV9-Kal的滤过性有轻微增加,但对内毒素的滤过性则有显著性增大.30 kD的超滤管对样品的回收率及内毒素去除率分别为0.912 2和0.870 6,优化效果明显,可以作为rAAV9-Kal样品超滤纯化的基本选择.
4 结束语
虽然建立了rAAV超滤纯化的初步工艺,但鉴于不同超滤材质的超滤效果存在明显差异[10-11],离心型和泵驱动型超滤装置在膜分离动力学方面存在差异[12],溶液中蛋白质量浓度和去污剂的质量分数都可能影响到实际的内毒素清除效果[13].在接下来的研究中,将重点开展相关条件的系统优化,以求实现rAAV样品纯化与内毒素清除的快捷、简单化,为规模化临床级rAAV的制备奠定基础.
[1] 肖桂清,杨会勇,刁勇.重组腺相关病毒质量控制的qPCR技术研究进展[J].华侨大学学报(自然科学版),2014,35(2):191-195.
[2] MORRISON C.$1-million price tag set for Glybera gene therapy[J].Nature Biotechnology,2015,33(3):217-218.
[3] ROURKE K S,MAYER C A,MACFARLANE P M.A critical postnatal period of heightened vulnerability to lipopolysaccharide[J].Respiratory Physiology and Neurobiology,2016,232:26-34.
[4] WRIGHT J F,ZELENAIA O.Vector characterization methods for quality control testing of recombinant adeno-associated viruses[J].Methods in Molecular Biology,2011,737(1):247-249.
[5] MAGALHAES P O,LOPES A M,MAZZOLA P G,etal.Methods of endotoxin removal from biological preparations: A review[J].Journal of Pharmaceutical Sciences,2007,10(3):388-404.
[6] HASHEMI H,POUYANFARD S,BANDEHPOUR M,etal.Efficient endotoxin removal from T7 phage preparations by a mild detergent treatment followed by ultrafiltration[J].Aacta Virologica,2013,57(3):373-374.
[7] CLEVER M,JORDT F,KNAUF R,etal.Process water production from river water by ultrafiltration and reverse osmosis[J].Desalination,2000,131(1/2/3):325-336.
[8] KULP A,KUEHN M J.Biological functions and biogenesis of secreted bacterial outer membrane vesicles[J].Annual Review of Microbiology,2010,64(1):163-184.
[9] 许瑞安,唐明青,刁勇,等.腺相关病毒: 从病毒到临床[M].北京:科学出版社,2015:1-8.
[10] NESTOLA P,MARTINS D L,PEIXOTO C,etal.Evaluation of novel large cut-off ultrafiltration membranes for adenovirus serotype 5 (Ad5) concentration[J].PLoS One,2014,9(12):e115802.
[11] 刘芸,周骏,王冬英,等.混合材质超滤膜去除丹参滴注液中细菌内毒素的应用研究[J].南京中医药大学学报,2011,27(6):558-560.
[12] MATTIASSION B.Isolation and purification of proteins[M].New York:Marcel Dekker Inc,2003:194-204.
[13] JANG H,KIM H S,MOON S C,etal.Effects of protein concentration and detergent on endotoxin reduction by ultrafiltration[J].BMB Reports,2009,42(7):462-466.
(责任编辑: 陈志贤 英文审校: 刘源岗)
Removal of Endotoxin From Recombinant Adeno-Associated Virus by Ultrafiltration
TANG Mingqing1, ZHANG Wenhao1,2, HOU Ying1,CHENG Zhiyun1, GUO Sijia1, WANG Lizhen1,LIU Hui1, XU Ruian1
(1. School of Biomedical Sciences, Huaqiao University, Quanzhou 362021, China;2. School of Basic Medical Sciences, Fujian Medical University, Fuzhou 350108, China)
To explore the possibility of ultrafiltration technology used in recombinant adeno-associated virus purification, the recombinant adeno-associated virus sample termed rAAV9-Kal was first treated by different molecular weights cut off ultrafiltration devices, then the endotoxin and virus in the retentates and filtrates were assayed with quantitative tachypleus amebocyte lysate regents and real-time PCR respectively, and last the effects of ultrafiltration on endotoxin removal were evaluated. The results showed that the recovery rate and endotoxin removal rate of sample were 0.912 2 and 0.870 6 respectively, under the treatment of EDTA, DOC and 30 kD ultrafiltration devices. Therefore, the 30 kD should be the most suitable ultrafiltration device for sample ultrafiltration and endotoxin removal. Keywords: recombinant adeno-associated virus; ultrafiltration; molecular weights cut off; endotoxin; purification
10.11830/ISSN.1000-5013.201701012
2016-06-29
唐明青(1982-),男,副教授,博士,主要从事AAV基因治疗的研究.E-mail:Tangmingqing2222@163.com
国家自然科学基金资助项目(2012AA020810); 福建省中青年教师教育科研项目(JA14020); 华侨大学科研基金资助项目(14BS111)
Q 93
A
1000-5013(2017)01-0064-05

