H6P2Mo15W3O62改性MOF-508金属有机框架对水中亚甲基蓝的吸附
龚文朋,陈竹青,马海芹,田超强,杨水金
(湖北师范大学化学化工学院,先进材料研究所,污染物分析与资源化技术湖北省重点实验室, 湖北 黄石 435002)
H6P2Mo15W3O62改性MOF-508金属有机框架对水中亚甲基蓝的吸附
龚文朋,陈竹青,马海芹,田超强,杨水金
(湖北师范大学化学化工学院,先进材料研究所,污染物分析与资源化技术湖北省重点实验室, 湖北 黄石 435002)
采用溶剂热法,在合成金属有机骨架MOF-508的过程中引入活性组分H6P2Mo15W3O62,制备出一种新型吸附剂H6P2Mo15W3O62/MOF-508,利用FT-IR、XRD、TG、BET、SEM对其结构进行分析,进而研究其亚甲基蓝的吸附性能.研究结果表明,H6P2Mo15W3O62/MOF-508对亚甲基蓝有很好的吸附性能,在20 ℃和溶液的pH=2的条件下的吸附量达277.78 mg/g.等温吸附模型符合Langmuir等温吸附型,拟二级动力学能较好描述吸附的过程.H6P2Mo15W3O62/MOF-508对亚甲基蓝的吸附是自发和放热的过程.
金属有机框架;H6P2Mo15W3O62;吸附;分离;亚甲基蓝
0 引言
在纺织行业生产中,产生大量染料的工业废水,这些染料废水即使浓度低,毒性也非常大,会引起人体“致癌、致畸、致突变”作用[1].随着染料行业的发展,染料朝着抗热、抗生物氧化及抗光解发展,使得染料废水的处理成为国内外废水处理的难点之一[2].
目前染料废水的处理方法有吸附法,高级氧化工艺,絮凝,生物处理,膜过滤和光催化[2-4].吸附法一直是最重要的水处理方法之一,被人们广泛应用于各种给水或废水处理中[5].因此,高性能的吸附剂成为了研究热点.近年新发展起来的金属有机框架材料由于具有高比表面积、可调的孔型孔径、抗溶剂性、有序孔结构等特点,所以在金属有机骨架化合物处理有机染料废水中,开展选择性吸附、分离方向的研究前景广阔[6],目前金属有机骨架材料吸附废水中有机染料的有MOF-235、MIL-100、MIL-101、MIL-53、ZIF-8和UIO-66等[7].单一的MOF材料所包含的吸附活性位点毕竟有限,所以这是制约金属有机骨架用于液相吸附和分离的重要因素.
MOF-508由Zn2+与对苯二甲酸先配位形成具有扭曲方格的一维平面,再与4,4′-联吡啶相连形成具有简单立方结构的三维体[8].本文中采用溶剂热法,将H6P2Mo15W3O62修饰MOF-508增加其吸附活性位点,构筑一例三维孔道结构的金属有机骨架复合材料H6P2Mo15W3O62/MOF-508.研究表明对亚甲基蓝吸附和分离效果较好,但对阴离子染料吸附和分离效果较差.H6P2Mo15W3O62/MOF-508可作为一种新型的吸附剂去除阳离子染料是一个较好的选择.
1 实验部分
1.1 试剂及仪器 对苯二甲酸(H2BDC),分析纯,天津市光复精细化工研究所;4,4′-联吡啶(4,4′-Bipy),分析纯,上海山浦化工有限公司;硝酸锌〔Zn(NO3)2·6H2O〕,分析纯,天津市天力化学试剂有限公司;无水乙醇,分析纯,国药集团;N,N-二甲基甲酰胺(DMF),分析纯,国药集团;亚甲基蓝、甲基橙,分析纯,上海试剂三厂;H6P2Mo15W3O62(参照[9]自制);二次蒸馏水(自制);

1.2 三维金属有机骨架复合材料H6P2Mo15W3O62/MOF-508的制备 取0.140 7 g Zn(NO3)2·6H2O (0.473 mmol)、0.075 g H2BDC(0.473 mmol)、0.036 9 g的4,4′-Bipy(0.236 5 mmol)及0.25 g H6P2Mo15-W3O62(0.081 9 mmol)于反应釜中,向其中加入乙醇和DMF各20 mL,室温搅拌30 min,然后将反应釜转移至恒温干燥烘箱反应24 h,反应温度为90 ℃.反应结束后冷却至室温,得到的晶体用DMF和正己烷交替洗涤.将洗好的吸附剂在60、120 ℃温度下各真空干燥12 h得到H6P2Mo15W3O62/MOF-508.
1.3 三维金属有机骨架复合材料H6P2Mo15W3O62/MOF-508吸附亚甲基蓝溶液在亚甲基蓝溶液中加入一定量的金属有机骨架复合材料H6P2Mo15W3O62/MOF-508进行吸附实验,探讨MB初始pH、温度对吸附的影响.吸附液经高速离心后测定吸光度,由MB标准曲线和下列公式计算其吸附量.
式中:Co和Ct为MB初始和平衡时的质量浓度(mg/L);V分别为溶液体积(L);m吸附剂质量(g)和qt平衡吸附量(mg/g).
2 结果与讨论
2.1 三维金属有机骨架复合材料H6P2Mo15W3O62/MOF-508的表征

2.1.2 XRD分析 图2是H6P2Mo15W3O62,MOF-508和H6P2Mo15W3O62/MOF-508的XRD图谱.
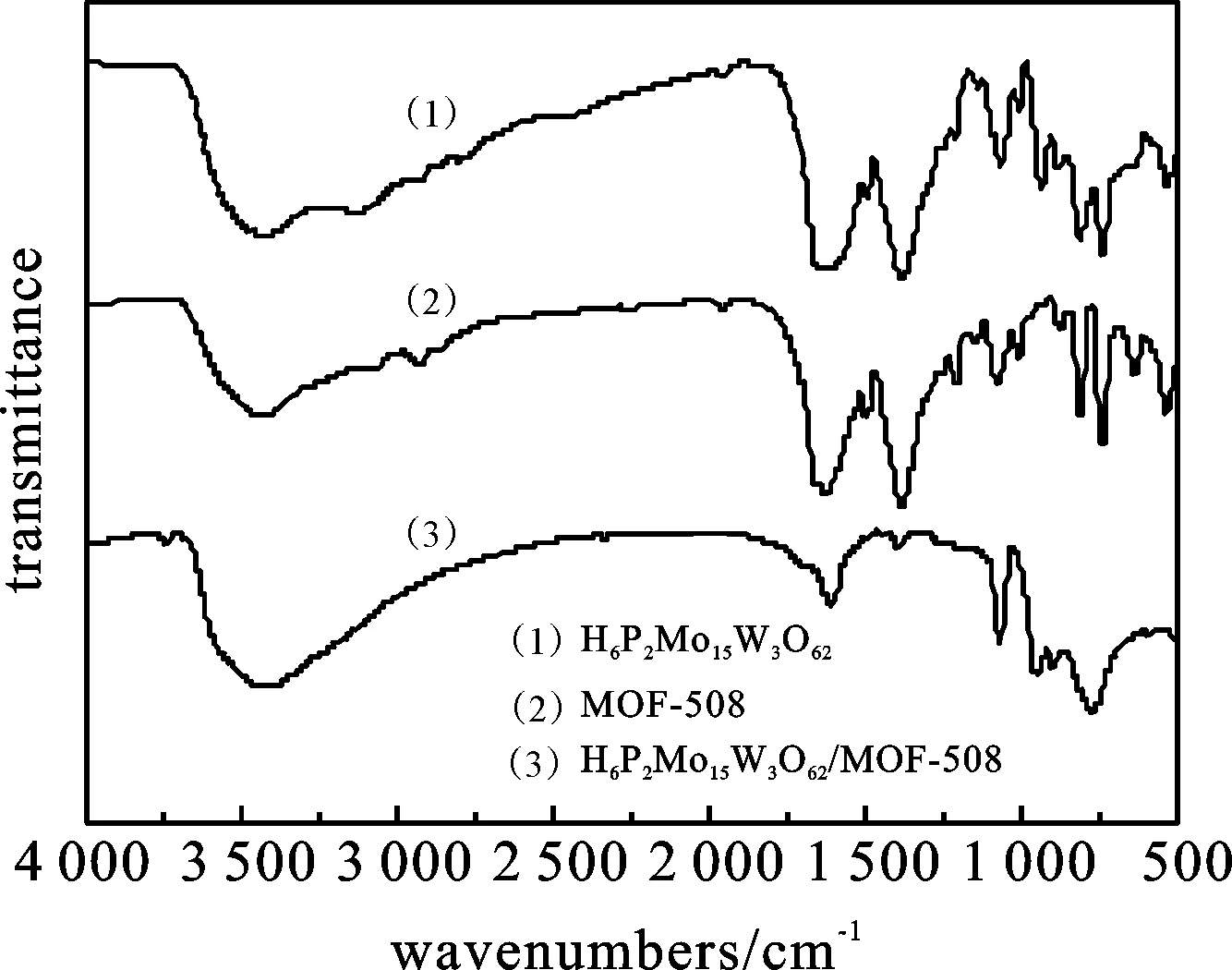
图1 H6P2Mo15W3O62,MOF-508,H6P2Mo15W3O62/MOF-508的红外光谱
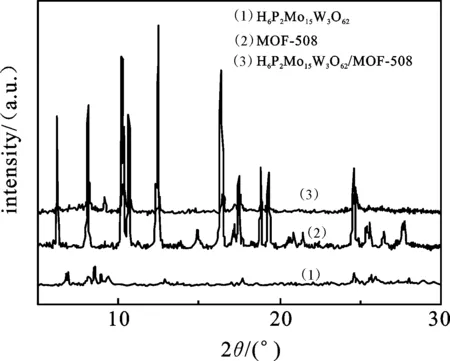
图2 H6P2Mo15W3O62,MOF-508,H6P2Mo15W3O62/ MOF-508的XRD图

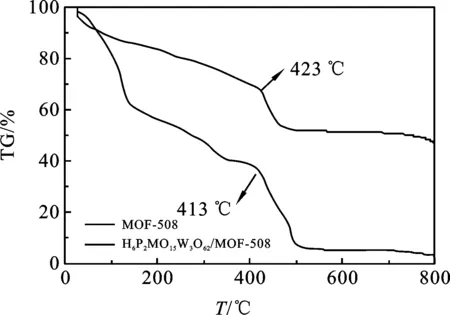
图3 MOF-508,H6P2Mo15W3O62 /MOF-508的
2.1.3 热重分析 图3是MOF-508,H6P2Mo15W3O62/MOF-508的TG图.由图3所示的MOF-508和H6P2Mo15W3O62/MOF-508的热重曲线表明:随着温度的升高,这两种物质的热分解过程都分为3个阶段.从23到114 ℃,两者都发生大量快速的失重,归因于物理吸附水的失去.第二阶段是一个缓慢的失重过程,可以认为失去的是MOF-508和H6P2Mo15-W3O62/MOF-508的结晶水.最后一阶段,两者结构都坍塌,相对于MOF-508来说,H6P2Mo15W3O62/MOF-508在这一阶段需要的温度423 ℃要高于MOF-508的413 ℃,说明H6P2-Mo15W3O62负载在MOF-508骨架内或分散在MOF-508的孔道中,提高了吸附剂的热稳定性.

表1 MOF-508和H6P2Mo15W3O62/MOF-508的结构参数
2.1.4 BET分析 由表1可知,MOF-508经过H6P2Mo15W3O62改性后由微孔材料转变为介孔材料, H6P2Mo15W3O62/MOF-508的比表面积和孔体积相对于纯骨架MOF-508而言减小非常多,从而进一步证实了H6P2Mo15-W3O62负载在MOF-508骨架内或分散在MOF-508的孔道中.经过H6P2Mo15W3O62对MOF-508的修饰后,使得MOF-508内部的小孔相互作用,导致孔径增大,比孔容减少,比表面积变小,增加了增加其吸附活性位点.

图4 H6P2Mo15W3O62 (a,b)、MOF-508(c)和H6P2Mo15W3O62/MOF-508(d)的
2.1.5 SEM分析 图4是H6P2Mo15W3O62,MOF-508和H6P2Mo15W3O62/MOF-508的SEM图.由图4a可知,H6P2Mo15W3O62外部形态呈表面粗糙、似破非破状大小不一的多孔球状结构.图4b为在高倍数下H6P2Mo15W3O62的形貌,呈现表面多孔的球体状,这似乎与H6P2Mo15W3O62易被掺杂改性的特性有关.MOF-508为长方体,其长、宽、高分别约为170、40、20 μm(4c),H6P2Mo15W3O62负载于MOF-508后,形貌发生改变,复合物H6P2Mo15W3O62/MOF-508(4d)形貌发生改变,呈现表面多孔的规则的结构.
2.2 H6P2Mo15W3O62/MOF-508吸附亚甲基蓝的研究
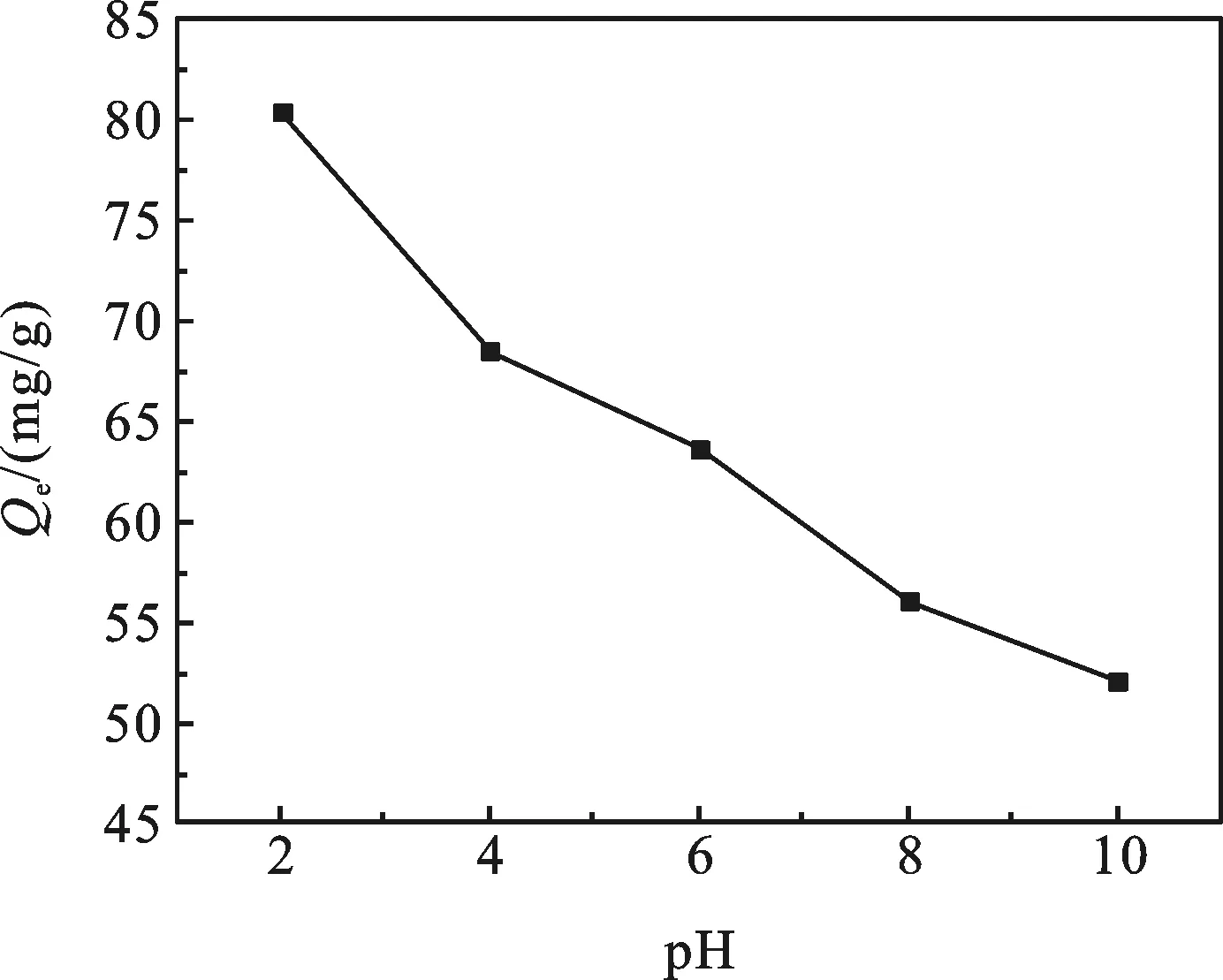
图5 pH对MB吸附量的影
2.2.1 亚甲基蓝溶液的pH对吸附效果的影响 取10 mg吸附剂,于20 mL的40 mg/L亚甲基蓝溶液中振荡,考察不同pH下该吸附剂对亚甲基蓝溶液吸附的影响.
由图5可以看出随着亚甲基蓝溶液pH的增大,吸附剂对MB的吸附量减小.因此低pH值更有利于亚甲基蓝的吸附.这是因为亚甲基蓝是阳离子染料,在水溶液中以阳离子的形式存在[12],吸附剂H6P2Mo15W3O62/MOF-508表面带负电荷,而吸附作用是靠吸附剂与吸附质之间的静电作用实现的.pH可以改变吸附剂和吸附质表面所带电荷.在低pH值下,H6P2-Mo15W3O62能电离产生更多的负离子,而MB表面正电荷也会增加,使H6P2Mo15W3O62/MOF-508和MB之间的静电作用增大,从而使吸附量增大.
2.2.2 MOF-508、H6P2Mo15W3O62、H6P2Mo15W3O62/MOF-508的吸附效果对比 取10 mg吸附剂,于20 mL的110 mg/L的亚甲基蓝溶液中并调节pH=2进行振荡,考察MOF-508、H6P2Mo15W3O62、H6P2Mo15-W3O62/MOF-508的吸附效果.
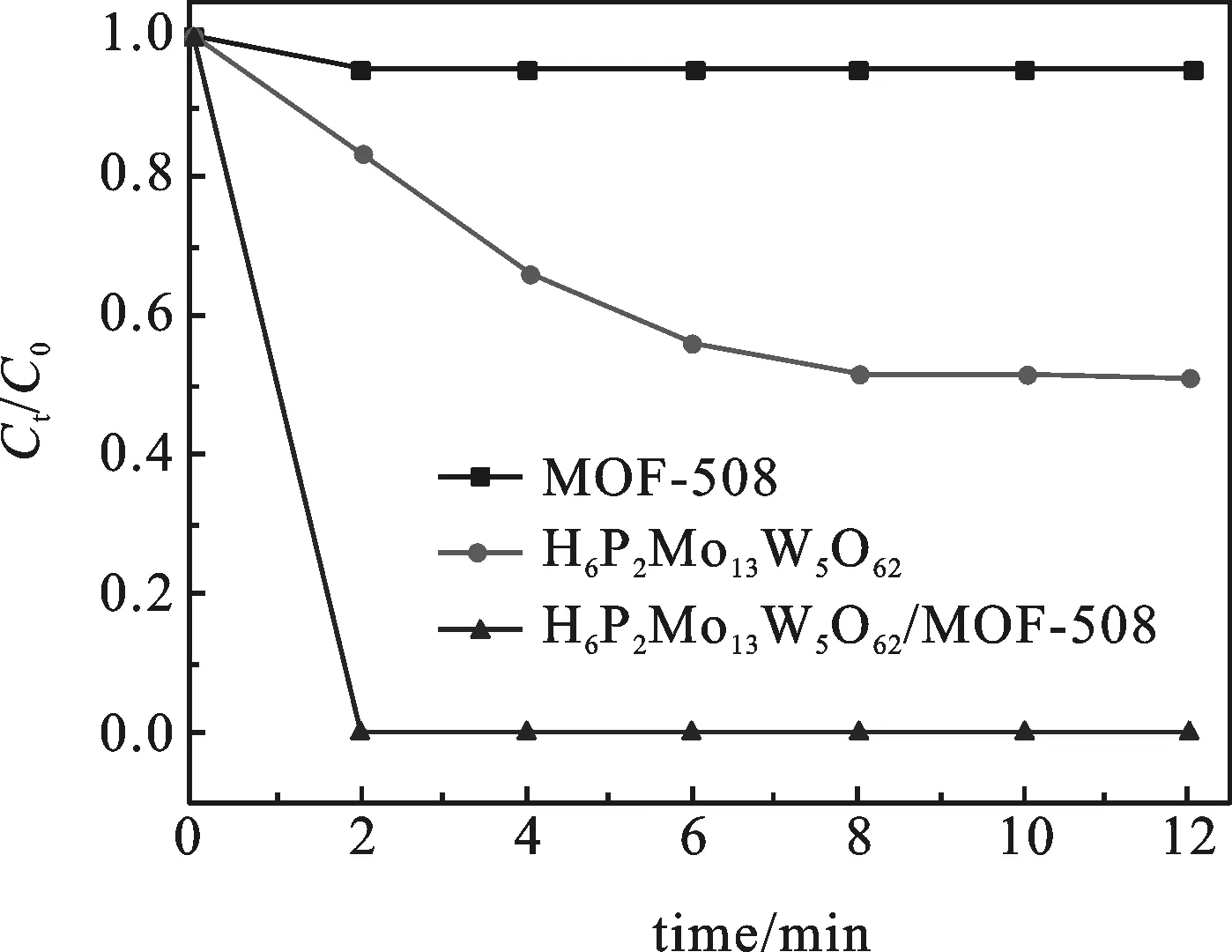
图
由图6可知,复合后的H6P2Mo15W3O62/MOF-508能快速吸附亚甲基蓝,2 min内能将浓度为110 mg/L的吸附完全,而单一的三维孔道结构的MOF-508对亚甲基蓝几乎没有吸附效果.这是因为MOF-508在液相吸附中虽然有合适的孔道和比表面积,但是缺乏吸附活性位点和驱动力,所以吸附效果不好;通过H6P2Mo15W3O62对MOF-508进行修饰改性,增加了MOF-508的吸附活性位点和驱动力,使得H6P2Mo15W3O62/MOF-508吸附阳离子型亚甲基蓝时,H6P2Mo15W3O62可以极化产生驱动力,还能作为活性吸附位点来吸引住亚甲基蓝[13].
2.2.3 温度对吸附效果的影响 分别向20 mL的90、100、110、120、130、140、150、160 mg/L的MB溶液中加入10 mg的吸附剂,调节溶液pH=2,考察温度对亚甲基蓝吸附效果的影响,其影响结果如图7所示.
图7结果显示,随着温度的升高,H6P2Mo15W3O62/MOF-508对亚甲基蓝的吸附量呈下降的趋势,这说明该吸附剂吸附亚甲基蓝是放热过程,低温有利于对亚甲基蓝的吸附.其可能原因是:随着温度的升高亚甲基蓝的溶解度增加,使溶液粘度增大,增加了吸附质与吸附剂之间的传质阻力,使吸附量减小;随着温度的升高,吸附平衡开始向脱附方向移动,也使吸附量减小[14].
2.2.4 H6P2Mo15W3O62/MOF-508吸附混合染料 取20 mg H6P2Mo15W3O62/MOF-508,与浓度为60 mg/L的甲基橙(MO)、亚甲基蓝(MB)各20 mL的混合溶液中并调节pH=2进行振荡,每2 min测一次样,考察H6P2Mo15W3O62/ MOF-508对混合染料吸附的研究.

图7 温度对MB吸附量的影
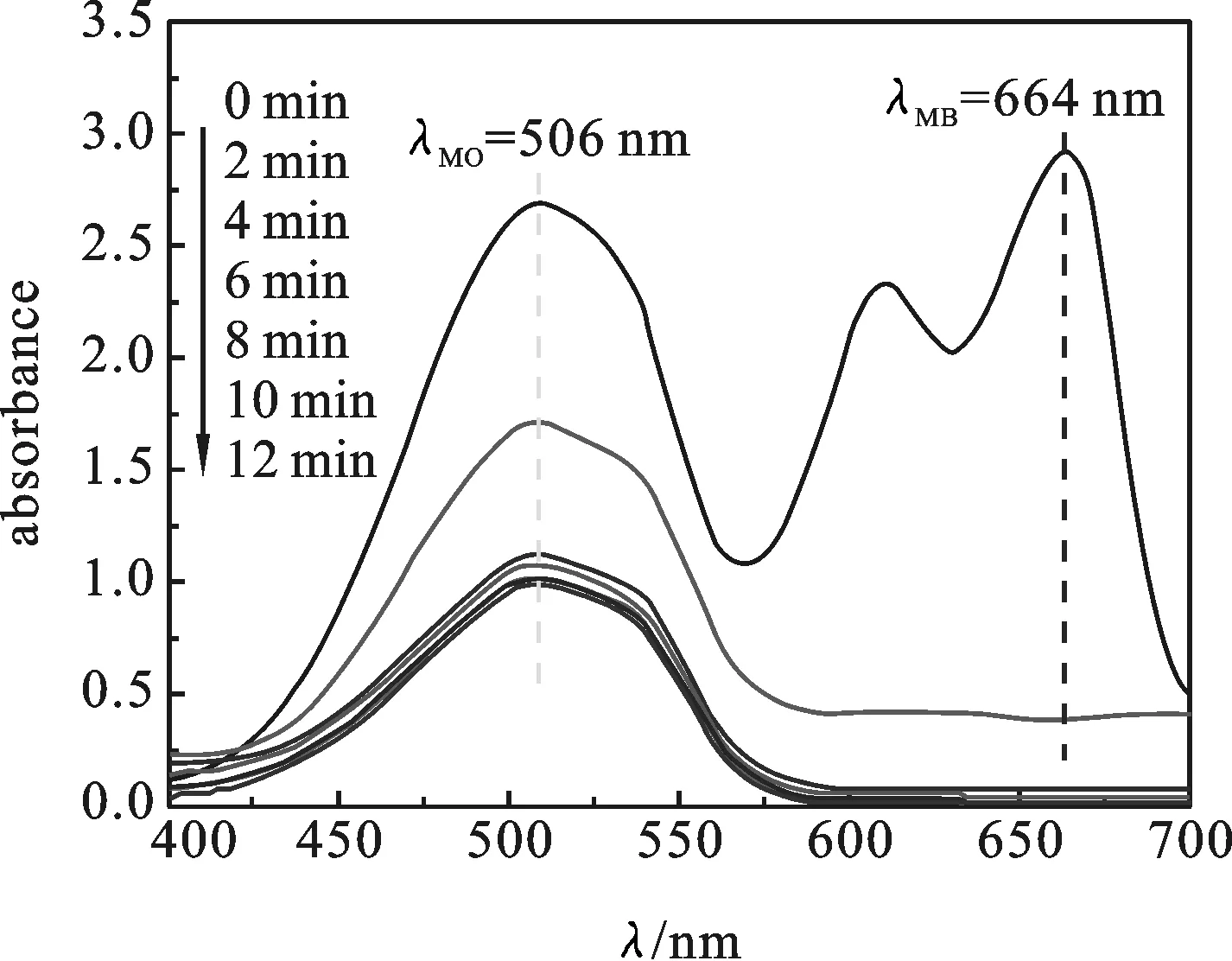
图8 H6P2Mo15W3O62/MOF-508对混合 染料溶液的选择性吸
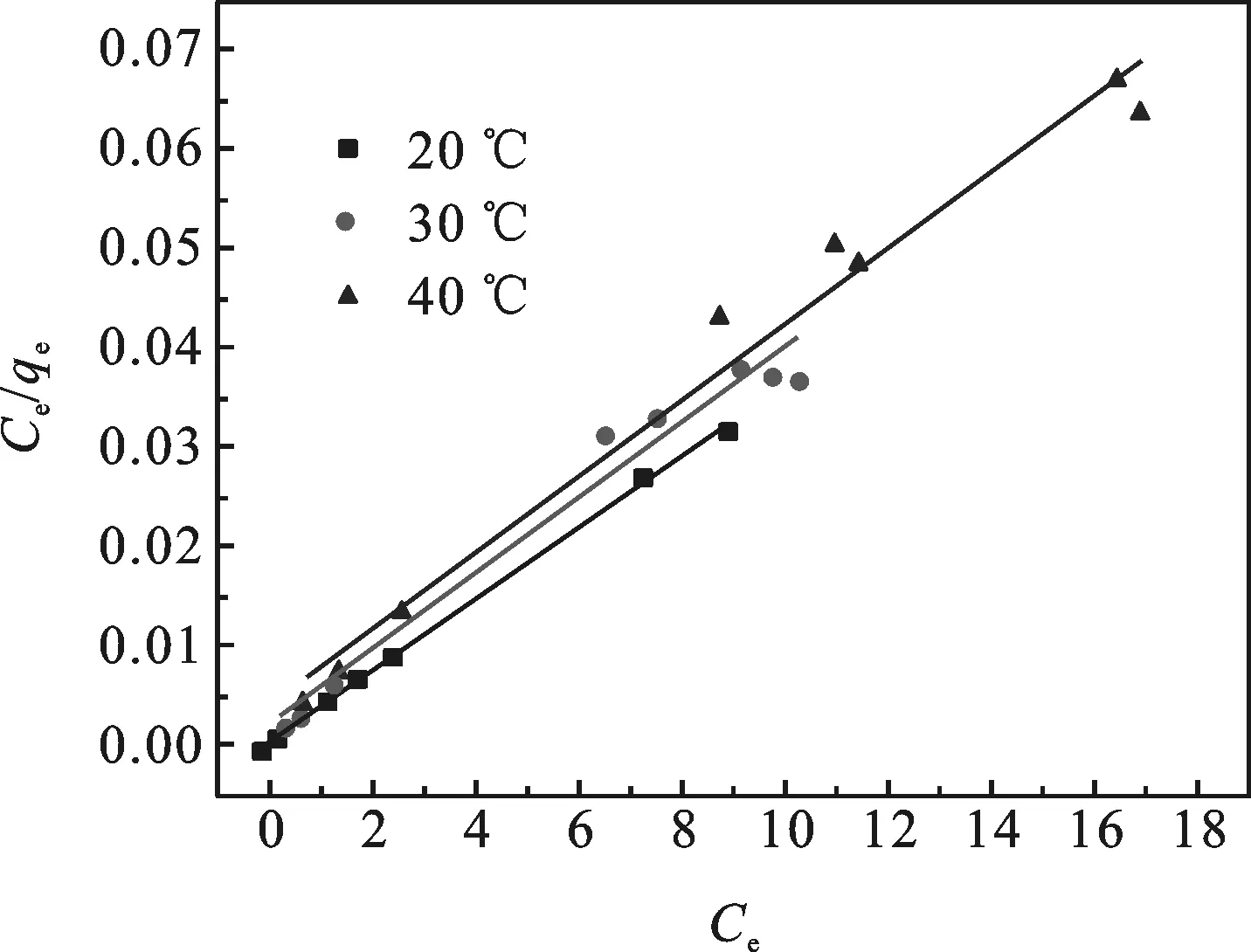
图9 亚甲基蓝的Langmuir吸附等温线
如图8所示,在紫外-可见吸收光谱中,在2 min内亚甲基蓝的吸收峰基本消失,然而甲基橙的特征吸收峰却减弱比较缓慢,由此可见,H6P2Mo15W3O62/MOF-508能在混合染料废水体系中快速地选择性吸附亚甲基蓝.
2.3 吸附等温方程的确定 在探讨温度影响(2.2.3)的基础上,我们参考文献进一步研究了MB的两种等温吸附模型(Langmuir和Freundlich).其中Langmuir线性方程[15-16]等式如下:
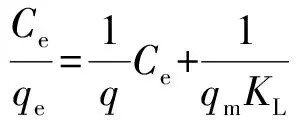
qe和qm(mg/g)分别是平衡时H6P2Mo15W3O62/MOF-508的吸附量和最大单层吸附量,Ce(mg/L)是平衡时亚甲基蓝的浓度,KL(L/mg)是Langmuir的吸附常数.
由图9可知,在20、30、40 ℃条件下,将Ce/qe对Ce作图均得到线性关系.结果表明H6P2Mo15W3O62/MOF-508吸附亚甲基蓝符合Langmuir等温模型,计算所得相关参数见表2.
Langmuir等温吸附的基本特性,可以用RL[15]的值来表示:

b(L/mg)是Langmuir等温方程的吸附常数,C0(mg/L)为染料的初始浓度.RL说明了相应的等温线的吸附能力:0
H6P2Mo15W3O62/MOF-508在20、30、40 ℃吸附亚甲基蓝的RL值分别为:0.906 1,0.004 642和0.009 562,从而表明H6P2Mo15W3O62/MOF-508对亚甲基蓝的吸附是适宜吸附.
Freundlich吸附等温方程[16]一般表示为:

其中KF是吸附容量,n吸附强度.表2中计算出了相关参数.
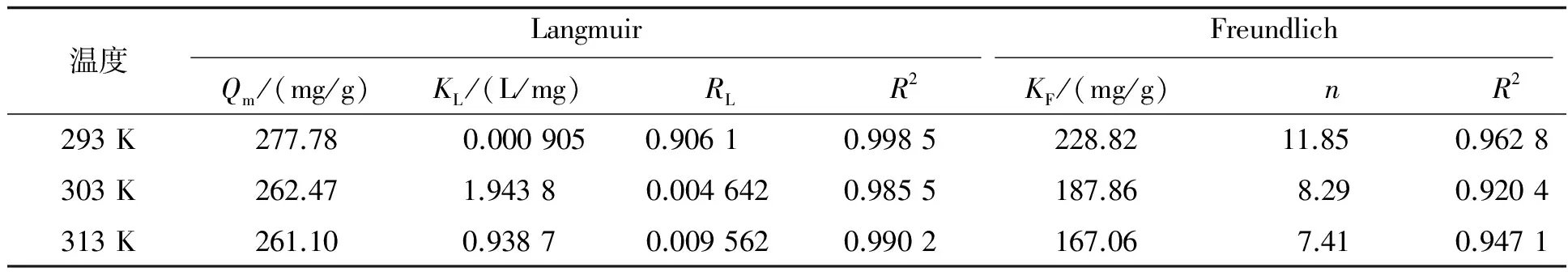
表2 Langmuir方程和Freundlich方程的拟合结果
由表2可见,在293、303、313 K不同温度下,Langmuir吸附等温式的相关系数R2分别为0.998 5,0.985 5,0.990 2.其数值相比于Freundlich吸附等温式的相关系数更接近1,表明吸附剂H6P2Mo15W3O62/MOF-508吸附亚甲基蓝符合Langmuir等温模型,亚甲基蓝主要以单层分子的形态吸附在吸附剂的表面[16].
2.4 吸附动力学的确定 为了探究该吸附过程的控制机制,参考文献[17]将实验数据通过两种动力学模型来拟合.

表3 H6P2Mo15W3O62/MOF-508吸附亚甲基蓝的动力学参数值
表3为分别采用拟一级动力学和拟二级动力学模型对H6P2Mo15W3O62/MOF-508吸附亚甲基蓝的结果,拟二级动力学计算而得的线性相关系数R2的数值远远高于拟一级动力学,且拟二级动力学模型的线性相关系数(R2)分别等于1,而且理论平衡吸附量Qe,cal(mg/g)与实验所得的平衡Qe,exp(mg/g)的数值相吻合.因此表明拟二级动力学模型能很好地描述H6P2Mo15W3O62/MOF-508对MB的吸附,对MB的吸附属化学吸附控制[16].
2.5 热力学参数 在293、303和313 K温度下进行H6P2Mo15W3O62/MOF-508吸附亚甲基蓝的实验,研究吸附平衡常数KL,吉布斯自由能(ΔGo),焓变(ΔHo)和熵变(ΔSo),他们可参考文献[18]进行计算,得出相关热力学参数见表4.

表4 H6P2Mo15W3O62/MOF-508吸附MB的热力学参数
如表4所示,在293、303、313 K不同温度下,ΔG<0,说明该吸附过程应该是一个自发的过程,且随着温度的上升,ΔG的绝对值减小,吸附的推动力减小,这说明升温阻碍了H6P2Mo15W3O62/MOF-508对亚甲基蓝的吸附;ΔH<0,说明该吸附过程是一个放热的过程,温度的升高不利于对亚甲基蓝的吸附,这与前面所得结论一致;ΔS<0,说明吸附剂吸附亚甲基蓝后其有序性增加,可能原因是在固液相吸附体系中,溶质吸附在吸附剂上,自由度减小,是一个熵减小的过程.
3 结论
通过H6P2Mo15W3O62对MOF-508进行修饰改性,得到吸附剂H6P2Mo15W3O62/MOF-508增加MOF-508吸附活性位点和驱动力.结果表明在降低温度和降低pH都有利于H6P2Mo15W3O62/MOF-508对亚甲基蓝的吸附,H6P2Mo15W3O62/MOF-508对MB的吸附符合Langmuir等温吸附模型,其吸附过程由拟二级动力学模型拟合推定属化学吸附控制.H6P2Mo15W3O62/MOF-508对亚甲基蓝的最大吸附量为277.78 mg/g,同时对混合染料中的阳离子染料有快速吸附的效果.
[1] Carneiro P A, Umbuzeiro G A, Oliveira D P, et al. Assessment of water contamination caused by a mutagenic textile effluent/dye house effluent bearing disperse dyes[J].J Hazard Mater, 2010,174(1/3): 694-699.
[2]王丰昶,余彩莉,许建本,等.含松香的羧基化聚合物微球对亚甲基蓝吸附研究[J].化学研究与应用,2016,28(6):776-782.
[3] Crini G. Non-conventional low-cost adsorbents for dye removal: a review[J]. Bioresour Technol, 2006,97(9): 1061-1085.
[4] 毛蜜,周建刚, 何瑜, 等.G/TiO2/CoFe2O4磁性复合光催化材料的制备及光催化降解亚甲基蓝[J].湖北大学学报(自然科学版),2016,38(3):195-207.
[5] Bestani B, Benderdouche N, Benstaali B, et al. Methylene blue and iodine adsorption onto an activated desert plant[J]. Bioresour Technol, 2008, 99(17):8441-8444.
[6] 李小娟,何长发,黄斌,等.金属有机骨架材料吸附去除环境污染物的进展[J].化工进展,2016,35(2):586-594.
[7] Hasan Z, Jhung S H. Removal of hazardous organics from water using metal-organic frameworks(MOFs):plausible mechanisms for selective adsorptions[J]. J Hazard Meter, 2015, 283:329-339.
[8] Chen B L, Liang C D, Yang J, et al. A microporous metal-organic framework for gas-chromatographic separation of alkanes[J]. Angew Chem Int Ed, 2006, 45(9):1390-1393.
[9] Park D R, Song J H, Lee S H, et al. Redox Properties of H3PMoxW12-xO40and H6P2MoxW18-xO62Heteropolyacid Catalysts and Their Catalytic Activity for Benzyl Alcohol Oxidation[J]. Applied Catalysis A: General, 2008, 349(1/2):222-228.
[10] 王恩波,高丽华,刘景福,等.具有Dawson结构的钼钒磷杂多酸的制备和性质研究[J].化学学报,1988,46(8):757-762.
[11] Liu Y W, Liu S M, Liu S X, et al. Crystal facets make a profound difference in polyoxometalate-containing metal-organic frameworks as catalysts for biodiesel production[J]. J Am Chem Soc, 2015,137(39):12697-12703.
[12] 杜二玲,左黎明,于少明.新型炭黑材料对亚甲基蓝吸附性能的研究[J].安徽化工, 2010, 36(6):31-41.
[13] Li R, Ren X Q, Zhao J S, et al. Polyoxometallates trapped in a zeolitic imidazolate framework leading to high uptake and selectivity of bioactive molecules[J]. J Mater Chem A, 2014, 2(7), 2168-2173.
[14] Eftekhari S,Sohrabnezhand Habibi-Y A.Application of AlMCM-41 for competitive adsorption of methylene blue and rhodamine B: thermodynamic and kinetic Studies[J]. Hazard Mater, 2010, 78(1/3):349-355.
[15] Langmuir I. The adsorption of gases on plane surfaces of glass, mic a and platinum[J]. J Am Chem Soc, 1918, 40(9):1361-1403.
[16] Hameed B H. Equilibrium and kinetic studies of methyl violet sorption by agricultural waste[J]. Hazard Mater, 2008, 154(1/3):204-212.
[17] Liu X X, Gong W P, Luo J, et al. Selective adsorption of cationic dyes from aqueous solution bypolyoxometalate-based metal-organic framework composite[J]. Appl Surf Sci, 2016, 362: 517-524.
[18] Shi H C, Li W S, Zhong L, et al. Methylene blue adsorption from aqueous solution by magnetic cellulose/graphene oxide composite: equilibrium, kinetics, and thermodynamics[J]. Ind Eng Chem Res, 2014, 53(3):1108-1118.
(责任编辑 胡小洋)
Application of H6P2Mo15W3O62modified MOF-508 as an adsorbent to remove methyl blue from aqueous solution
GONG Wenpeng, CHEN Zhuqing, MA Haiqin, TIAN Chaoqiang, YANG Shuijin
(College of Chemistry and Chemical Engineering, Institute for Advanced Materials,Hubei Key Laboratory of Pollutant Analysis & Reuse Technology, Hubei Normal University, Huangshi 435002,China)
The novel absorbent H6P2Mo15W3O62/MOF-508 has been prepared by hydrothermal synthesis method, and the active component H6P2Mo15W3O62was introduced while synthesizing metal organic framework MOF-508. By X-ray powder diffraction pattern(XRD), Fourier transform infrared spectrum(FT-IR), scanning electron micrographs(SEM), thermogravimetric(TG), brunaue Emmett teller (BET), the composition, structure, morphology, stability and toleration of H6P2Mo15W3O62/MOF-508 were characterized. The adsorption of methylene blue(MB) onto H6P2Mo15W3O62/MOF-508 in aqueous solution was studied. The effects of the experimental parameters including the temperature, the initial pH value and initial concentration of methylene blue solution were discussed. It’s maximum adsorption capacity value reached to 277.78 mg/g at 20 ℃ and pH=2. The experiment data could be well described by the Langmuir equations and pseudo-second-order kinetic model. The adsorption process of the composites on methylene blue was spontaneous and exothermic.
metal organic frameworks; H6P2Mo15W3O62; adsorption; separation; methylene blue
2016-08-01
湖北省自然科学基金重点项目(2014CFA131)、2016年地方高校国家级大学生创新创业训练计划项目(201610513010)和湖北师范大学研究生创新基金(20160107)资助
龚文朋(1991-),男,硕士生;杨水金,通信作者,教授,E-mail:yangshuijin@163.com
1000-2375(2017)01-0001-07
O647.3
A
10.3969/j.issn.1000-2375.2017.01.001

