金柴胶囊微生物限度检查方法的建立和验证
郝 福 胡向青 李 东 张 纲 丁 锐 周长明 李志刚*
(1 神威药业集团有限公司,河北 石家庄 051430;2 北京市药品检验所,北京 100035)
金柴胶囊微生物限度检查方法的建立和验证
郝 福1胡向青1李 东1张 纲1丁 锐2周长明2李志刚1*
(1 神威药业集团有限公司,河北 石家庄 051430;2 北京市药品检验所,北京 100035)
目的 建立金柴胶囊微生物限度检查的方法并验证。方法 按照《中国药典》2015年版要求,采用金黄色葡萄球菌、铜绿假单胞菌、枯草芽胞杆菌、白色念珠菌、黑曲霉和大肠埃希菌进行微生物限度检查方法验证。结果 金柴胶囊对金黄色葡萄球菌、铜绿假单胞菌与枯草芽孢杆菌有较强的抑菌作用,增加稀释液(1∶50)后,明显消除了抑菌性;常规法下检查霉菌和酵母菌,回收比值均在0.5~2.0;控制菌方法适用性试验中试验组均检出试验菌。结论 采用平皿法通过增加供试品稀释液法检查需氧菌数;采用常规平皿法检查霉菌、酵母菌计数;控制菌检查可采用常规法。所建立的方法适用于金柴胶囊的质量控制。
金柴胶囊;验证;微生物限度检查法;稀释法
金柴胶囊是由中国中医科学院中药研究所和神威药业集团联合研制的中药6类新药,由金银花、连翘、柴胡、黄芩、半夏、西洋参、绵马贯众7味中药组成,具有透邪解毒之功能,用于治疗病毒性上呼吸道感染(中医分型属风热感冒)[1-3]。对口服固体制剂进行微生物限度检查是保证药品安全的一项重要检测内容。文献[4-7]报道,金银花、黄芩、连翘等药材具有抑菌和杀菌作用。对具有抑菌作用的药物制剂进行微生物限度检查时,须采用适宜的方法消除抑菌性才能保证检测结果的准确性。与《中国药典》2010年版相比,2015年版药典在微生物限度章节部分有较多修订,体现在培养基、培养条件和检验方法等方面。目前尚未见报道金柴胶囊中微生物限度的研究。本文参考《中国药典》2015年版[8]四部(通则1105和1106)的要求,建立了金柴胶囊微生物限度检查法并进行了验证,能客观地反映药物中微生物的污染状况,达到有效、可控的检测目的。
1 仪器与材料
1.1 仪器:VS-1300L-U净化工作台(苏州净化设备公司),XG1. DMX-0.36脉动真空灭菌柜(山东新华医疗器械厂),LRH-250生化培养箱(上海一恒科学仪器有限公司),GHP-9160隔水式恒温培养箱(上海一恒科学仪器有限公司),101-2SA电热鼓风干燥箱(上海沪南科学仪器联营厂),BHC-1300Ⅱ生物安全柜(苏州净化设备公司)等。
1.2 菌种:金黄色葡萄球菌[CMCC(B)26 003],铜绿假单胞菌
[CMCC(B)10 104],枯草芽孢杆菌[CMCC(B)63 501],黑曲霉菌[CMCC(F)98 003],白色念珠菌[CMCC(F)98 001]与大肠埃希菌[CMCC(B)44 102]均购自中国食品药品检定研究院。
1.3 培养基:胰酪大豆胨琼脂培养基(批号20150618)、胰酪大豆胨液体培养基(批号20150914)、沙氏葡萄糖琼脂培养基(批号20150910)、沙氏葡萄糖液体培养基(批号20150921)、麦康凯琼脂培养基(批号20150920)、麦康凯液体培养基(批号20150912)均购自北京三药科技开发公司。培养基适用性检查均符合规定。
1.4 样品:金柴胶囊,神威药业集团有限公司生产,批号为150901、150902、151003。
2 方法与结果
2.1 菌液的制备:大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌:取新鲜培养物接种至胰酪大豆胨液体培养基中,置30~35 ℃培养18~24 h;取此培养液1 mL,加入0.9%无菌氯化钠溶液9 mL,以10倍递增稀释至浓度为10-3~10-5的菌悬液。白色念珠菌:取新鲜培养物接种至沙氏葡萄糖液体培养基中,置20~25 ℃培养2~3 d;培养物用0.9%无菌氯化钠溶液稀释制成浓度为10-3~10-5的菌悬液。
黑曲霉:取新鲜培养物接种至沙氏葡萄糖琼脂斜面培养基中,置20~25 ℃培养5~7 d,加入含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液3~5 mL洗下孢子。然后用管口有纱布的无菌吸管吸出孢子液置无菌试管内,用含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,采用10倍递增稀释法稀释至浓度为10-2~10-4。孢子悬液。
2.2 供试液制备:取本品内容物10 g,加入pH 7.0氯化钠-蛋白胨缓冲液100 mL,置45 ℃水浴振摇,混合均匀,静置10 min,取上清液,制成1∶10供试液,备用。为筛选有效的消除抑菌活性的方法,另将1∶10供试液用pH 7.0氯化钠-蛋白胨缓冲液稀释制成1∶20和1∶50的供试液。
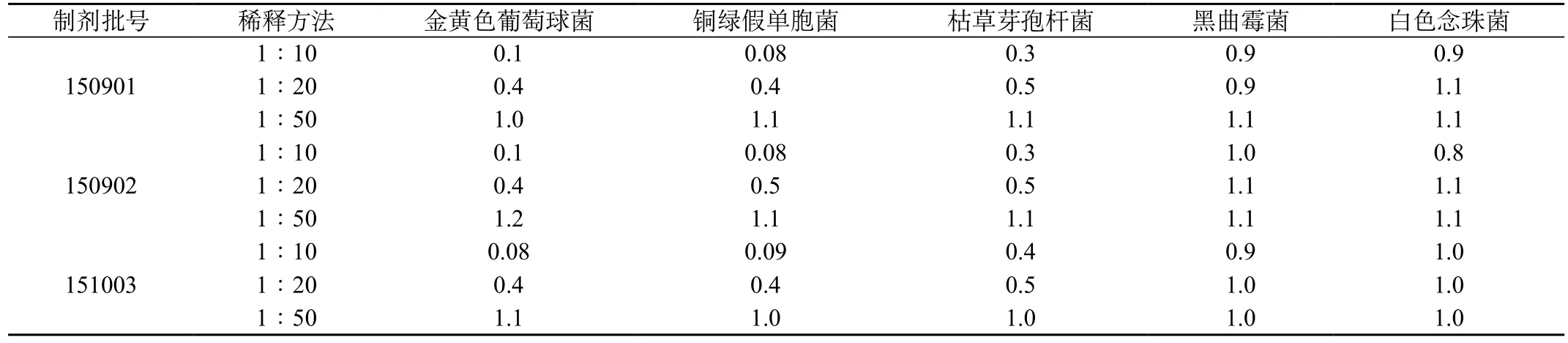
表1 需氧菌总数回收比值试验结果
2.3 需氧菌总数:分别取1∶10或1∶20或1∶50供试液10 mL置无菌试管中,加入相应试验菌0.1 mL使其最终浓度为每1 mL不大于100 cfu菌液,混匀,从试管中吸取1 mL注入平皿中,立即倾注胰酪大豆胨琼脂,待凝,在30~35 ℃培养,每株试验菌平行制备2个平皿,测定试验组菌落数,同法测定菌液组和供试品对照组的菌落数。计算各菌株回收比值,回收比值=(试验组的平均菌落数-供试品对照组的平均菌落数)/菌液对照组的平均菌落数,结果见表1。
结果表明,用常规方法进行本品的需氧菌计数检查时,金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的回收比值均<0.5,故常规法不适宜本品的需氧菌计数检查。改用增加稀释液(1∶50)进行验证,上述5种需氧菌的回收比值均在0.5~2.0。
2.4 霉菌和酵母菌总数:取1∶10供试液10 mL于灭菌试管中,加入相应试验菌0.1 mL使其最终浓度为每1 mL不大于100 cfu菌液,混匀,从试管中吸取1 mL注入平皿中,立即倾注沙氏葡萄糖琼脂,待凝,在20~25 ℃培养,每株试验菌平行制备2个平皿,测定试验组菌落数,同法测定菌液组和供试品对照组的菌落数。计算各菌株回收比值,回收比值=(试验组的平均菌落数-供试品对照组的平均菌落数)/菌液对照组的平均菌落数,结果见表2。
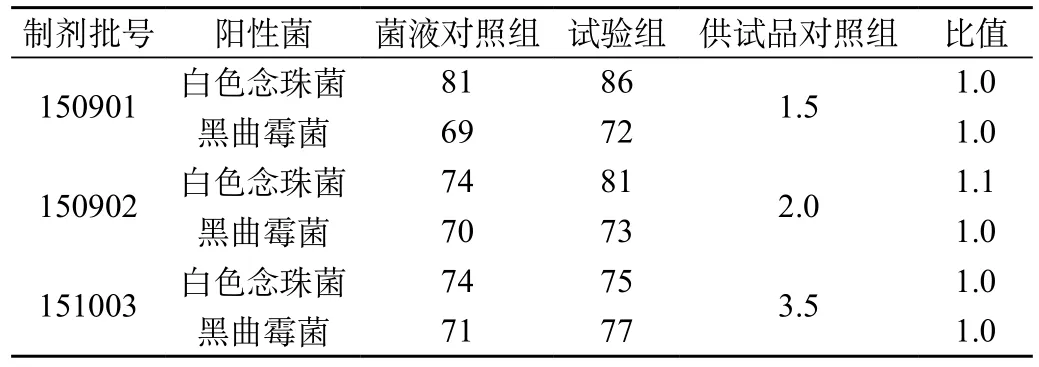
表2 霉菌和酵母菌总数回收比值试验结果
结果表明,本品对霉菌和酵母菌的回收比值均在0.5~2.0,即可确认该供试液在该检验条件下无抑菌作用,可采用平皿法进行供试品的霉菌和酵母菌数检验。
2.5 控制菌检查:按《中国药典》2015年版四部通则1106控制菌检查法进行方法验证。取100 mL胰酪大豆胨液体培养基,分别加入1∶10供试液10 mL和制备好的大肠埃希菌悬液1 mL,混匀,30~35 ℃培养18~24 h。取上述培养物1 mL接种至100 mL麦康凯液体培养基中,42~44 ℃培养24~48 h。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35 ℃培养18~72 h。结果,胰酪大豆胨液体培养基、麦康凯液体培养基和麦康凯琼脂培养基平板上均检出了试验菌,表明常规法适宜检查供试品的大肠埃希菌。
2.6 样品检测:取样品,按照“2.2”项下方法制备供试液,采用已验证的微生物限度检查方法进行检验,结果均未检出大肠埃希菌,需氧菌、霉菌和酵母菌符合限度要求,合格率为100.0%。
3 讨 论
本品原依照《中国药典》2010年版微生物限度方法采用离心沉淀法来消除抑菌性,但离心沉淀法可能鉴于方法回收率重现性较差且一般无法保证细菌的回收率等原因未被2015版药典收载[9]。2015版药典收录的去除供试品抑菌作用的方法有:增加稀释液或培养基体积、加入适宜的中和剂或灭活剂、采用薄膜过滤法或上述几种方法的联合使用[8],因此我们重新依照要求配制了不同稀释级别的供试液开展验证,结果表明,供试品对金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌等试验菌株有较强的抑菌作用,通过增加稀释液法(1∶50)进行需氧菌计数验证,结果各规定菌株的回收比值达到药典要求。本方法准确、可靠,可用于金柴胶囊的质量控制。
与《中国药典》2010版相比,2015版药典中微生物限度检查进行了较大的修订[10-11]微生物计数改为需氧菌总数和酵母总数,培养基更改为广谱性的胰酪大豆琼脂和沙氏葡萄糖琼脂,对回收试验等内容和要求也进行了对应的修订,方法更倾向于与国际接轨。本文均按照2015版药典中相关要求,开展研究与验证,对该类药物微生物限度检查方法制定有一定参考和借鉴意义。
[1] 钟菊迎,崔晓兰,时宇静,等.金柴抗病毒胶囊防治甲型H1N1流感病毒PR8株感染小鼠肺炎的实验研究[J].世界中西医结合杂志, 2010,5(4):297.
[2] 钟菊迎,崔晓兰,时宇静,等.金柴抗病毒胶囊对IFITM3蛋白表达的影响[J].药学学报,2012,47(7):904.
[3] 钟菊迎,崔晓兰,时宇静,等.金柴抗病毒胶囊对甲型H1N1流感病毒FM1株感染免疫低下小鼠肺炎的影响[J].中国实验方剂学杂志,2010,16(13):109.
[4] 李平,赵成.金银花水提物及醇提物体外抗菌实验[J].中国当代医药,2010,17(17):48.
[5] 周锡钦,梁鸿,路新华,等.中药黄芩主要黄酮类成分及其生物活性研究[J].北京大学学报医学版,2009,41(5):578.
[6] 章德林,汤丹丰,郑 琴,等.具有抗感染作用的中药分类研究[J].中草药,2015,46(24):3771.
[7] 薛建江,乔海霞,刘进军,等.6种常用抗菌中药对3株常见病原性细菌的抑菌作用检测[J].河北北方学院学报(医学版),2008,25 (3):19.
[8] 国家药典委员会.中华人民共和国药典.四部[S].北京:中国医药科技出版社,2015:140.
[9] 胡昌勤.药品微生物控制现状与展望[J].中国药学杂志,2015,50 (20):1747.
[10] 景荣先,张国林.2015年版《中国药典》微生物限度检查法洁净环境及计数培养基修订分析探讨[J].中国卫生产业,2015(5): 184.
[11] 李趣娥,江艳芳.《中国药典》2010版与2015版微生物限度检查法对四种药物检测结果的比较[J].中国药品标准,2015,16(2):86.
Establishment and Validation of a Microbial Limit Test Method for Jinchai Capsules
HAO Fu1, HU Xiang-qing1, LI Dong1, ZHANG Gang1, DINGRui2, ZHOU Chang-ming2, LI Zhi-gang1
(1 Shineway Pharmaceutical Group Co., Ltd, Shijiazhuang 051430, China; 2 Beijing Institute for Drug Control, Beijing 100035, China)
ObjectiveTo establish and validate a method of microbial limit test for Jinchai capsules.MethodsThe microbial limit test method was validated using Staphylcoccus aureu, Pseudomonas aeruginosa, Bacillus subtilis, Aspergillus niger, Candida albicansand Escherichia coli according to Chinese Pharmacopoeia Edition 2015.ResultsJinchai capsules have a strong inhibition on Staphylcoccus aureu, Pseudomonas aeruginosa and Bacillus subtilis. The antibacterial activity of the samples was eliminated after diluting the sample 1mL to 50mL. The recovery ratios for counts of mold and yeasts were all within 0.5-2.0 when using the routine plate count method, and the validation result of control bacteria was positive.ConclusionMedium dilution method can be used for total aerobic microbial count. The routine method can be used with enumeration mold and yeasts. Specifed microorganisms can be tested when general method was applied. The method is effective and can be used to the quality control of the Jinchai capsules.
Jinchai capsules; Validation; Microbial limit test; Medium dilution method
R282.710.3
B
1671-8194(2016)35-0001-02
石家庄市重大科技计划项目(151200257A)
*通讯作者

