VEGF和MMP—2在卵巢乳头状癌组织中表达特征及临床意义
张永波 胡远强
[摘 要] 目的:探讨卵巢乳头状癌组织中VEGF和MMP-2的表达特征,与卵巢乳头状癌发生侵袭、转移的相关性。方法:利用实时定量聚合酶链反应(QT-PCR )、免疫组织化学染色法、Western blot法检测VEGF/MMP-2基因及蛋白在正常卵巢组织、卵巢乳头状癌组织中的表达情况。结果:与正常卵巢组织相比,在卵巢乳头状癌组织中,VEGF/MMP-2基因和蛋白的表达量均明显升高,差异具有统计学意义(P<0.05 )。对比I-II期和III-IV期,在III-IV期VEGF/MMP-2基因和蛋白的表达也明显升高,差异具有统计学意义(P<0.05 )。结论:VEGF/MMP-2的高表达可能与卵巢乳头状癌的侵袭和转移密切相关。
[关键词] 卵巢乳头状癌;VEGF;MMP-2;侵袭和转移
中图分类号:R737.31 文献标识码:A 文章编号:2095-5200(2016)06-111-03
DOI:10.11876/mimt201606041
卵巢癌是女性患者中死亡率最高的一类恶性肿
瘤[1],最常见的类型是卵巢乳头状癌。而卵巢癌高死亡率的主要原因[2]是70%左右的病例确诊时已有卵巢癌的浸润、盆腹腔的转移,无法手术和放疗。肿瘤发生转移和侵袭的两个重要环节就是新生血管形成与细胞外基质金属降解[3]。血管内皮生长因子 (Vascular endothelial growth factor,VEGF)是一种多功能的细胞因子[4-5],可以增强癌组织中内皮细胞的增生,促进新生血管的形成,同时增加肿瘤中血管的通透性,促进癌细胞进入血管的过程,提高其浸润和侵袭的能力。基质金属蛋白酶(Matrix Metalloproteinases, MMPs)是一种锌离子依赖的高度保守的内切蛋白水解酶家族,包括MMP1-MMP26等26个成员,能有效降解血管基底膜及细胞外基质的各种蛋白成分,从而破坏阻碍癌细胞侵袭的组织学屏障[6]。而MMP-2 [7]具有降解基膜Ⅳ型胶原的能力,一直是卵巢乳头状癌转移和浸润机制的研究热点。
本实验利用QT-PCR 法、免疫组织化学染色法、Western blot法检测VEGF/MMP-2基因及蛋白在正常卵巢组织、卵巢乳头状癌组织中的表达情况,探讨其与卵巢乳头状癌侵袭、转移的关系,为下一步研究卵巢乳头状癌的早诊断早治疗及预后提供参考。
1 材料和方法
1.1 材料
VEGF兔多克隆抗体(武汉博士德有限公司);MMP-2鼠单克隆抗体(武汉博士德有限公司);柠檬酸盐修复液(福州迈新生物技术有限公司); RNeasy FFPE Tissue Kit试剂盒 (厦门艾德生物医药科技有限公司);Maxima SYBR Green QT-PCR Master Mixes(Thermo Fisher Scientific);HiFi-MMLV Two Step RT-PCR Kit(北京康为世纪生物科技有限公司);DL1000Protein Marker (TaKaRa);组织蛋白提取试剂盒(上海经科化学科技有限公司);ECL显色试剂盒(Thermo) ;PBS缓冲液(pH7.2~7.4)(福州迈新生物技术有限公司)。
1.2 方法
1.2.1 标本来源 收集我院从2013年1月至2015年6月期间具有完整的临床资料、经手术和病理检查诊断明确卵巢乳头状癌且术前均未行放、化疗的病例80例,正常卵巢组织49例。临床资料包括患者的姓名、年龄、有无浸润和转移等。卵巢乳头状癌病理诊断由两位高年资病理医师复阅切片,不一致病例由第三名医师进行评估,最后讨论达成共识。所有卵巢乳头状癌患者临床分期按国际妇产科联盟 (FIGO,1988 年)标准,其中I-II期15例,III-IV 期 65例。
1.2.2 总RNA提取,检测VEGF/MMP-2基因水平的表达情况 收集的正常卵巢组织、卵巢乳头状癌组织石蜡标本,用RNeasy FFPT试剂盒,按照说明书对每一份病例的石蜡标本分别进行总RNA提取。经反转体系得到cDNA,用QT-PCR方法检测VEGF/MMP-2基因的表达。QT-PCR条件:底物液12μL,H2O7.5μL ,引物(VEGF/MMP-2/actin)2μL模板2μL。
1.2.3 免疫组织化学染色法检测VEGF/MMP-2蛋白的表达情况 1)卵巢组织脱蜡和水化;2)抗原修复;3)免疫组织化学染色 : 3%H2O2滴加在组织上,室温静置10min;PBS洗3次各5min;滴加正常山羊血清封闭液,室温20min;滴加一抗50μL, 4℃过夜;PBS洗3次各5min;滴加二抗50μL,37℃20min;PBS洗3次各5min;DAB显色2-3min,在显微镜下掌握染色程度;自来水冲洗5min;苏木精复染3min,盐酸酒精分化3s;自来水冲洗10min;脱水、透明、封片、镜检。4)结果判读:VEGF/MMP-2以胞浆出现黄色或棕黄色颗粒为阳性细胞。阳性结果的判断标准是按照染色程度和显色细胞的数量结合进行归类:细胞显色比例 < 5%(-);细胞显色的比例在 5%~25%之间,呈现为淡黄色(+);细胞显色的比例在25%~50%之间,呈现为黄色(++);细胞显色的比例 > 50% ,呈现棕黄色(+++)。以( ++ )( +++ )者为免疫组化阳性表达。
1.2.4 提取总蛋白,Western blot法检测VEGF/MMP-2蛋白的表达 从上述收集的病例中正常卵巢组织、卵巢乳头状癌组织石蜡标本I-II期、III-IV期中各选取5例,用组织蛋白提取试剂对每一份病例的石蜡组织分别进行总蛋白的提取,测定蛋白浓度。Western blot具体步骤:配置分离胶和浓缩胶,蛋白上样,SDS-PAGE 80V电泳3h后转移至聚偏氟乙烯(PVDF)膜,5%脱脂奶37℃封闭1h,一抗(1:500)4℃过夜,二抗(1:1000)37℃孵育1h,ECL法显色,同时检测actin(1:500)的表达作为内参。
1.2.5 统计学处理 使用SPSS11.0软件系统,计数资料进行χ2检验或Fishers确切概率法检验,相关比较采用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
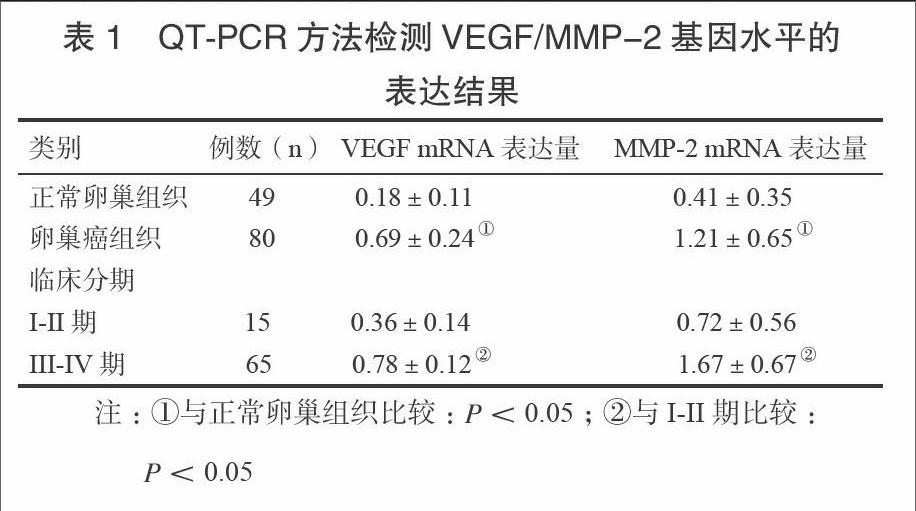
2.1 VEGF/MMP-2基因水平的表达情况
如表1所示,正常卵巢组织中VEGF/MMP-2基因表达分别为0.18±0.11和0.41±0.35。卵巢乳头癌组织VEGF/MMP-2基因表达分别为0.69±0.24和1.21±0.65。在卵巢乳头癌组织中VEGF/MMP-2基因表达明显升高,差异具有统计学意义(P<0.05)。并且随着卵巢乳头癌组织分期升高,VEGF/MMP-2基因表达也增加,差异具有统计学意义(P<0.05)。
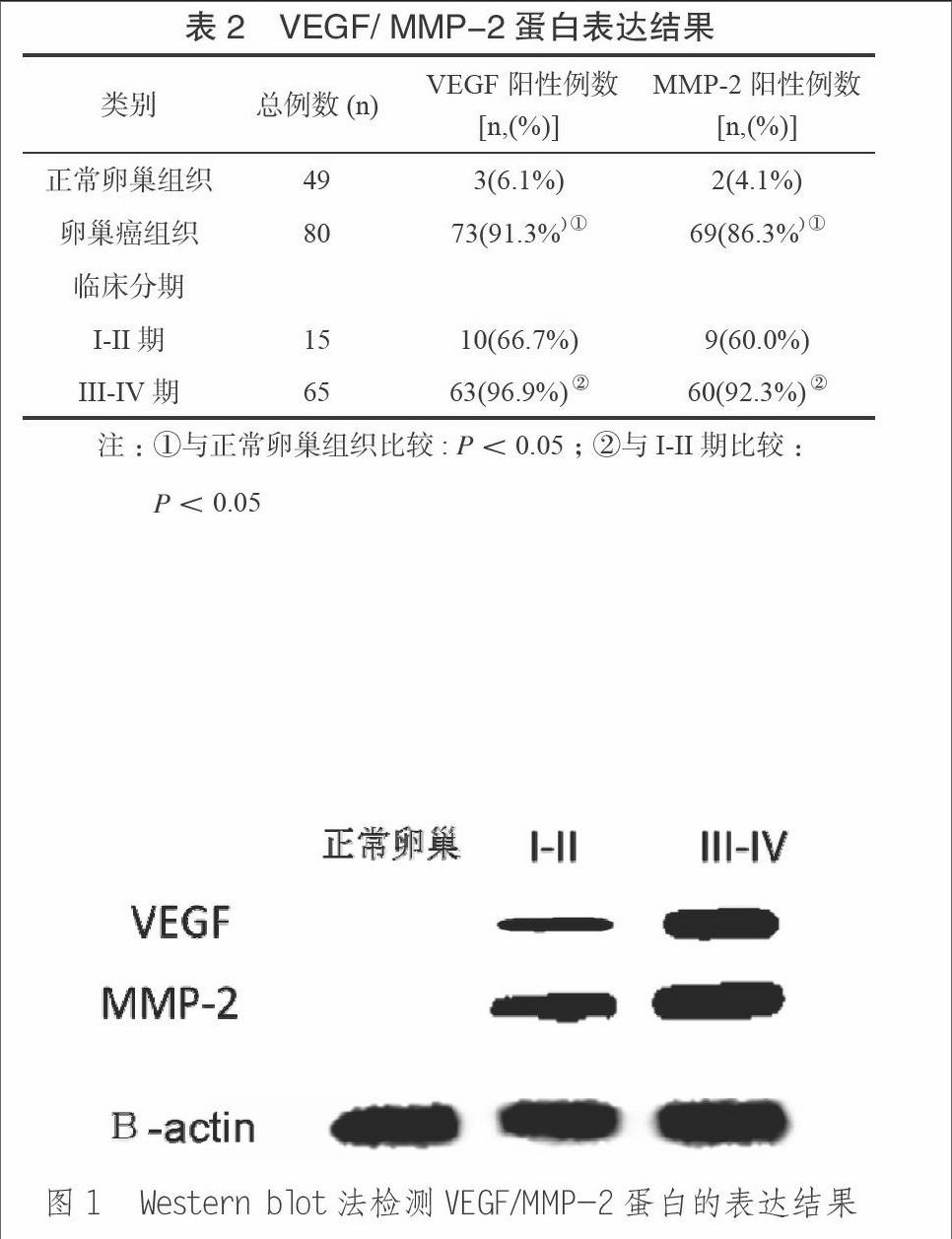
2.2 VEGF/MMP-2蛋白的表达情况
正常卵巢组织中VEGF/MMP-2蛋白表达阳性率分别是6.1%和4.1%,而在卵巢乳头状癌中VEGF/MMP-2蛋白表达阳性率分别是91.3%和86.3%。
与正常卵巢组织相比,卵巢乳头状癌中VEGF/ MMP-2蛋白表达量显著升高,差异具有统计学意义(P<0.05)。在III-IV中VEGF/ MMP-2蛋白高于I-II级的表达(P<0.05)(见表2)。
P<0.05
2.3 Western blot法检测VEGF/MMP-2蛋白的表达
情况
对比图1正常卵巢组织、卵巢乳头状癌组织石蜡标本I-II期、III-IV期,可见VEGF/ MMP-2蛋白表达逐级升高,差异具有统计学意义(P<0.05)。
3 讨论
卵巢癌在女性生殖系统癌瘤中排名第三[8],仅次于子宫颈癌和子宫体癌。近年,宫颈癌及宫体癌早期筛查技术的大力发展,对宫颈癌及宫体癌的防治已取得显著成效,总生存率明显升高。而卵巢癌的早期诊断非常困难[9-10],发现时已有卵巢癌的浸润、盆腹腔的转移,因此成为死亡率最高的肿瘤。而肿瘤发生转移和侵袭的两个重要环节就是新生血管形成与细胞外基质金属降解。
VEGF作为血管内皮特异性的有丝分裂原,对血管内皮细胞的增殖、血管渗透性增加等方面具有很强的调控作用[11-13]。因此VEGF在肿瘤细胞与血管内皮细胞都有阳性表达,只是在恶性细胞中,VEGF过度表达。从我们的研究发现,VEGF无论是基因水平还是蛋白水平表达量在正常卵巢组织、卵巢乳头状癌组织表达差异均非常明显,尤其是在卵巢癌III-IV期表达量最高,这说明VEGF在卵巢乳头状癌转移过程中发挥重要的作用。
MMP-2作为细胞外蛋白水解酶,主要功能是降解细胞外基质的多种成分。细胞外基质是阻碍癌组织学屏障,而癌细胞可以通过自身分泌或旁分泌等方式合成大量的MMP-2,破坏基底膜的完整性,发生侵袭和转
移[14-15]。我们的实验中可以观察到MMP-2基因和蛋白的表达在正常卵巢组织、卵巢乳头状癌组织石蜡标本I-II期、III-IV期也逐渐升高,而MMP-2在III-IV期高表达,有利于卵巢癌细胞的浸润和侵袭。
总之,VEGF通过增加血管通透性和促进血管形
成[16],MMP-2通过裂解细胞外基质,加速了卵巢癌的恶性转移[17]。因此研究VEGF/ MMP-2两者的相关性为深入了解调控肿瘤微血管生成的分子机制及其与肿瘤侵袭和转移关系奠定基础。而VEGF/ MMP-2在III-IV期的高表达,成为设计和研制治疗卵巢癌药物的新思路。
参 考 文 献
[1] Hua X, Yu L, You R, et al. Association among Dietary Flavonoids, Flavonoid Subclasses and Ovarian Cancer Risk: A Meta-Analysis [J]. PloS One, 2016, 11(3):e0151134.
[2] Kihara K, Yamamoto S, Ohshiro T, et al. Laparoscopic ovarian transposition prior to pelvic irradiation in a young female patient with advanced rectalcancer[J].Surg Case Rep, 2015, 1(1):113.
[3] Yaqi K, Yotsumoto F, Miyamoto S. Heparin-binding epidermal growth factor-like growth factor promotes transcoelomic metastasis in ovarian cancerthrough epithelial-mesenchymal transition[J].Mol Cancer Ther, 2008,7(10):3441-3451.
[4] He Z, Chen AY, Roianasakul Y, et al. Gallic acid, a phenolic compound, exerts anti-angiogenic effects via the PTEN/AKT/HIF-1α/VEGF signaling pathway in ovarian cancer cells [J]. Oncol Rep, 2016, 35(1):291-297.
[5] Ranjbar R, Nejatollahi F, Nedaei Ahmadi AS, et al. Expression of Vascular Endothelial Growth Factor (VEGF) and Epidermal Growth Factor Receptor (EGFR) in Patients With Serous Ovarian Carcinoma and Their Clinical Significance[J].Iran Cancer Prev, 2015, 8(4):e3428.
[6] Wang X, Shi L, Deng Y, et al. Inhibition of leucine aminopeptidase 3 suppresses invasion of ovarian cancer cells through down-regulation of fascin and MMP-2/9[J]. Eur Pharmacol, 2015, 768:116-122.
[7] Zou M, Zhang X, Xu C. IL6-induced metastasis modulators p-STAT3, MMP-2 and MMP-9 are targets of 3,3-diindolylmethane in ovarian cancer cells[J].Cell Oncol, 2016, 39(1):47-57.
[8] 牛兆园. 上皮性卵巢癌预后因素分析[D]. 青岛:青岛大学, 2007.
[9] Wang ZC,Birkbak NJ,lulhane AC,et a1. Profiles of Genomic In stability in High Grade Serous Ovarian Cancer Predict Treatment Outcome[J]. Clin Cancer Res, 2012, 18 (20):5806 -5815.
[10] Ayhan A,Kurman RJ,Yemelyanova A, et al. Defining the cut point between low grade and high grade ovarian serous carcinomas: a clinic pathologic and molecular genetic analysis[J]. Am Surg Pathol, 2009, 33 (8):1220-1224.
[11] Wang FQ, So J, Reierstad S, et al. Vascular endothelial growth factor-regulated ovarian cancer invasion and migration involves expression and activation of matrix metalloproteinases [J]. Int Cancer,2006,118(4):879-888.
[12] BelottiD,Calcagno C,Garof alo A,et al.ascular endothelial growth factor stimulates organ2specific host matrix metaloproteinase-9 expression and ovarian cancer invasi on[J].Mol Cancer Res,2008,6(4):525.
[13] Chen Q, Chen P, Pang X, et al.Adrenomedullin Up-regulates the Expression of Vascular Endothelial Growth Factor in Epithelial OvarianCarcinoma Cells via JNK/AP-1 Pathway[J].Int Gynecol Cancer , 2015,25(6):953-960.
[14] Morgan M R,Thomas GJ,Russell A,et al. The integrin cytoplasmic tail motif EKQKVDLSTDC is sufficient to promote tumor cell invasion mediated by matrix metalloproteinase(MMP) -2 or MMP-9[J]. Biol Chem,2004, 279(25):26533 -26539.
[15] Li J, Jiang K, Zhao F. Oxymatrine suppresses proliferation and facilitates apoptosis of human ovarian cancer cells through upregulating microRNA?29b and downregulating matrix metalloproteinase?2 expression[J].Mol Med Rep, 2015, 12(4):5369-5374.
[16] Masoumi-Moghaddam S, Amini A, Wei AQ, et al. Vascular endothelial growth factor expression correlates with serum CA125 and represents a useful tool in prediction of refractoriness to platinum-based chemotherapy and ascites formation in epithelial ovarian cancer[J].Oncotarget, 2015, 6(29):28491-28501.
[17] Desmeules P, Trudel D, Turcotte S, et al. Prognostic significance of TIMP-2, MMP-2, and MMP-9 on high-grade serous ovarian carcinoma using digital image analysis[J]. Hum Pathol, 2015, 46(5):739-745.

