HPLC-ELSD分析超声法合成月桂酸蔗糖酯的含量
兰梅娟,徐勇士,杨 旭,张若璇,孙帅楠,曲睿晶,杭方学,2,5*
(1广西大学轻工与食品工程学院,广西 南宁 530004;2广西蔗糖产业协同创新中心,广西 南宁 530004;3广西制糖学会,广西 南宁 530004;4来宾市产品质量检验所,广西 来宾 546100;5糖业及综合利用教育部工程研究中心,广西 南宁 530004)
HPLC-ELSD分析超声法合成月桂酸蔗糖酯的含量
兰梅娟1,徐勇士2,3,杨 旭4,张若璇1,孙帅楠1,曲睿晶1,杭方学1,2,5*
(1广西大学轻工与食品工程学院,广西 南宁 530004;2广西蔗糖产业协同创新中心,广西 南宁 530004;3广西制糖学会,广西 南宁 530004;4来宾市产品质量检验所,广西 来宾 546100;5糖业及综合利用教育部工程研究中心,广西 南宁 530004)
建立一种准确、快速、灵敏测定月桂酸蔗糖酯的高效液相色谱检测法。使用C8色谱柱为分离柱,以甲醇和水作为流动相,采用梯度洗脱方式,流速1.0 mL/min,漂移管温度85℃,氮气流速2.4 L/min。结果表明:月桂酸蔗糖单酯的线性范围为2~10 mg/mL (R2=0.9988),最低检出限为1.5 μg,平均加标回收率为99.68%,RSD为3.50%,该方法操作简便、准确可靠,可用于月桂酸蔗糖酯的测定。
高效液相色谱-蒸发光散射检测法(HPLC-ELSD);月桂酸蔗糖酯;超声
0 前言
蔗糖脂肪酸酯亦名蔗糖酯,是一种非离子型表面活性剂,无嗅无味,对人体无毒害,可被微生物降解,不会造成环境污染,具有很好的乳化、分散、增溶、润滑、发泡等作用,并且还有杀虫灭菌功效,广泛应用于食品、化妆品、医药、农药等行业[1-7]。
色谱法定性定量分析蔗糖脂肪酸酯不但有助于促进蔗糖酯合成领域的研究工作,也可作为一种工具用于食品、化妆品中蔗糖酯的分析检测,薄层色谱是较早也是较广泛用来分析蔗糖酯的方法[8-11],它能较好地分离蔗糖单酯、双酯以及多酯,但是蔗糖酯本身无色,需要使用显色剂显色,并且薄层色谱法步骤繁琐,难以精确测量,气相色谱也能分析定量蔗糖酯的组分,但是需要对蔗糖酯进行衍生化[12-14]。HPLC分离度好、检测灵敏度高、方便快捷,被广泛用于定量分析蔗糖酯[15-19]。最早与HPLC联用于蔗糖酯检测的是紫外检测器和示差折光检测器,蔗糖酯分子紫外吸收较弱,而示差折光检测器不能改变流动相的梯度,这2种检测器都不是分析定量蔗糖酯的理想选择,作为一种质量响应型检测器,蒸发光散射检测器克服了上述缺陷,在蔗糖酯分析检测领域受到广泛关注。目前ELSD-HPLC法分析检测蔗糖酯,是用色谱峰面积百分数定量不同取代度的蔗糖酯。蒸发光散射检测器检测的是不挥发的溶质颗粒,通用于各种沸点高于流动相的物质,严格来说ELSD并不是真正的“质量型检测器”,其响应与被分析物的理化性质有一定关系,但对理化性质很近似的一类化合物,ELSD的响应几乎是一致的[20]。
本文采用反相C8色谱柱,通过梯度洗脱,月桂酸蔗糖单酯外标定量蔗糖单酯含量,建立了一种快速、简便、准确分析蔗糖脂肪酸酯及其杂质的新方法。
1 材料与方法
1.1 材料与试剂
蔗糖(AR)、无水碳酸钾(AR)、二甲基亚砜(AR)、乳酸(AR)、氯化钠(AR)、正丁醇(AR)、无水硫酸钠(AR)、甲醇(色谱纯)、无水乙醇,国药集团化学试剂有限公司;月桂酸甲酯(AR),中国阿拉丁公司;月桂酸蔗糖单酯,美国sigma公司;实验用水均为过0.45 µm微孔滤膜超纯水。
1.2 仪器与设备
Waters高效液相色谱仪配有Empower软件,美国Waters;Alltech ELSD2000检测器,美国奥泰科技有限公司;Easypure LF超纯水仪,美国Barnstead;GENIUS ME215S微量分析天平,德国Sartorius; AL204电子天平,瑞士METTLER TOLEDO;KQ-500DE数控超声波清洗仪,昆山市超声仪器有限公司;2XZ-1型旋片式真空泵,浙江黄岩求精真空泵厂;真空干燥箱,上海生银医疗仪器仪表有限公司;HHS型电热恒温水浴锅,上海博讯实业有限公司医疗设备厂。
1.3 月桂酸蔗糖酯的制备
将0.01 mol的蔗糖溶解于二甲基亚砜中,加入适量的无水碳酸钾和月桂酸甲酯,置于超声波清洗仪中,在11 kPa压强,80℃下进行反应,反应结束后,加入适量乳酸,钝化催化剂,蒸出二甲基亚砜,加入5 mL 25%氯化钠溶液和20 mL正丁醇搅拌至完全溶解,转入分液漏斗静置分层,弃去水相,少量25%氯化钠溶液洗涤正丁醇相,加入无水硫酸钠干燥,过滤,蒸除正丁醇,乙酸乙酯洗涤,40℃真空干燥得乳白色蜡状物,即为月桂酸蔗糖酯。
1.4 对照品溶液的配制
精密称取月桂酸蔗糖单酯对照品50.00 mg,使用甲醇溶解,配制浓度为10 mg/mL的溶液,用0.45 µm微孔滤膜过滤,作为标准溶液贮备液。
1.5 色谱条件
色谱柱:依利特HypersilC8柱(4.6 mm×300 mm,5 µm);柱温25℃,流动相A为甲醇,流动相B为水,梯度洗脱程序见表1;进样量20 µL,流速1.0 mL/min,蒸发光散射检测器的漂移管温度为85℃,激光增益为1,雾化气为氮气,流速2.4 L/min。
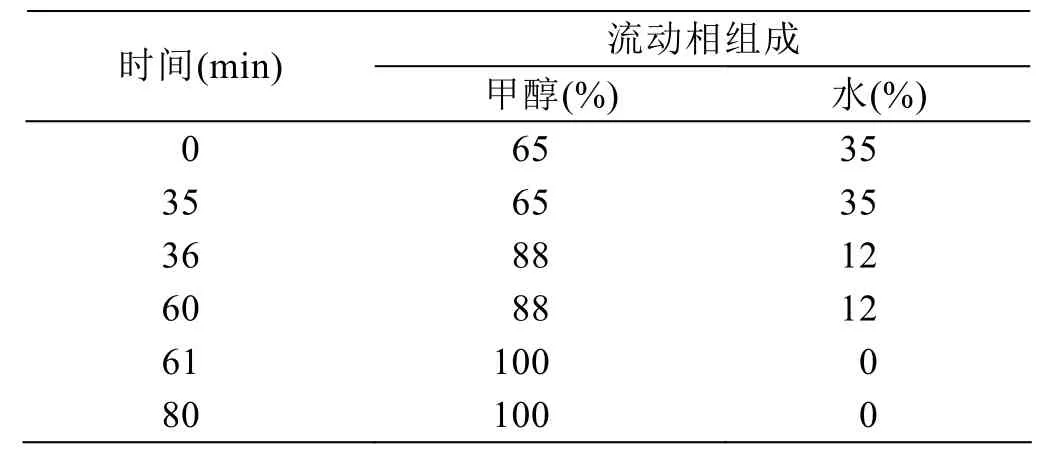
表1 HPLC梯度洗脱条件
1.6 月桂酸蔗糖酯的ESI-MS分析
电离模式:电喷雾电离(ESI),正、负离子检测;质谱扫描范围100~1500 u。
样品流速;0.8 mL/min;干燥气:氮气,Ion transfer tube温度:380℃;蒸发温度:200℃;流速:5.0 L/min;干燥气温度:350℃。
制样:样品用甲醇溶解,配制成500 μg/mL的溶液。
2 结果与讨论
2.1 线性范围及检出限
准确吸取月桂酸蔗糖单酯对照品标准溶液贮备液适量,甲醇定容,配置成浓度为:2、3、4、5、6、8、10 mg/mL的标准工作液,按照1.4中的分析条件进行测定。以峰面积为纵坐标、月桂酸蔗糖单酯浓度(mg/mL)为横坐标,得到月桂酸蔗糖单酯标准品的标准曲线,如图1。月桂酸蔗糖单酯在质量浓度范围为2~10 mg/mL范围内线性关系良好,峰面积与单酯质量浓度呈指数关系,回归方程为y=5670438.664x1.1888,决定系数R2=0.9988。逐步稀释单酯贮备液,由信噪比(RSN)=3计算,得月桂酸蔗糖单酯的检出限为1.5 μg。

图1 HPLC梯度洗脱条件
2.2 精密度实验
准确吸取单酯贮备液1 mL,甲醇定容至2 mL,配制成5 mg/mL的单酯溶液,连续进样6次,测定峰面积,并计算其相对标准偏差,结果如表2,RSD为1.20%,表明仪器精密度良好。
2.3 稳定性实验
把标记为LS1样品溶于甲醇,配置成10 mg/mL的溶液,进行稳定性实验。分别于0、3、6、9、12、15 h进样测定峰面积,结果如表3所示。测定的15 h内,月桂酸蔗糖单酯峰面积RSD为2.94%,月桂酸蔗糖二酯峰面积RSD为2.32%,表明供试品溶液在15 h内基本稳定。
2.4 加标回收率实验
取标记为LS2的月桂酸蔗糖酯9份,分别加入样品中单酯含量的80%、100%、120% 3个水平的月桂酸蔗糖单酯标准品,甲醇溶解,进行检测,计算回收率,结果见表4。月桂酸蔗糖单酯平均回收率为99.68%,RSD为3.50%,说明方法准确度良好。
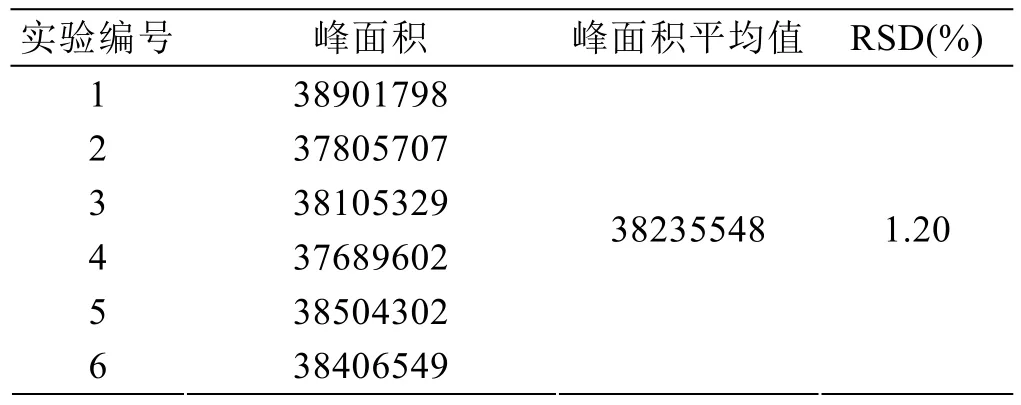
表2 精密度实验结果

表3 稳定性实验结果
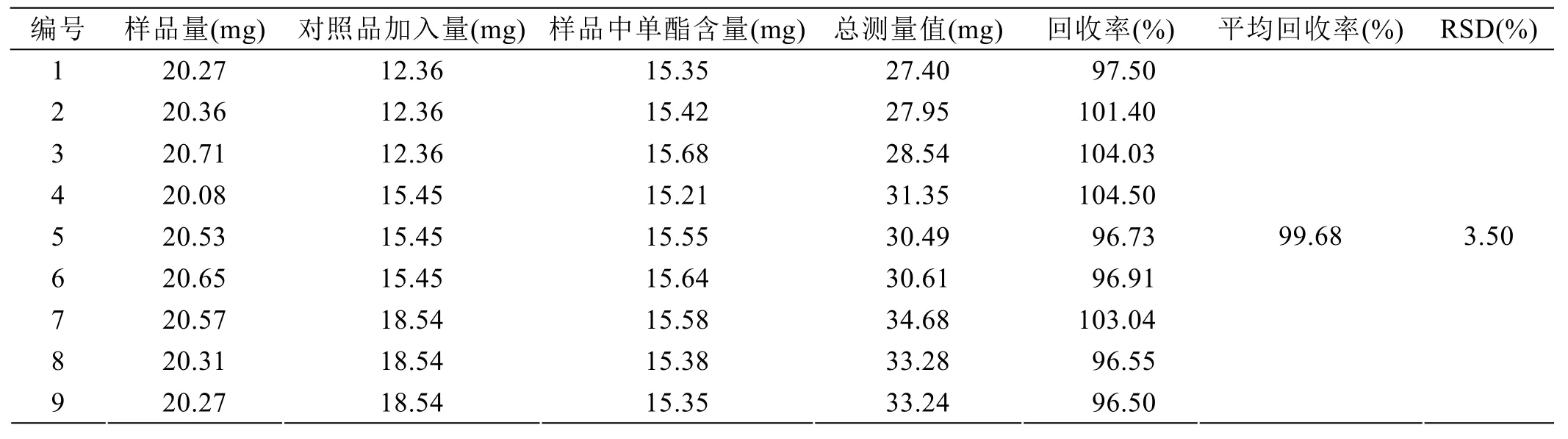
表4 月桂酸蔗糖单酯加标回收实验
2.5 月桂酸蔗糖酯的ESI-MS分析
图2是超声合成月桂酸蔗糖酯样品的HPLC色谱图,峰1是分离过程中引入氯化钠的色谱峰,峰2是蔗糖杂质,为了进一步证实超声合成月桂酸蔗糖酯的组分,采用电喷雾电离质谱对合成月桂酸蔗糖酯的组分进行分析表征。月桂酸蔗糖酯的HPLC色谱图中各个色谱峰代表的物质的质谱表征结果如表5至表7所示,可知峰3~峰8均是月桂酸蔗糖单酯的同分异构体;第9簇色谱峰和峰10是月桂酸蔗糖二酯的一系列同分异构体;第11簇色谱峰是月桂酸蔗糖三酯的一系列同分异构体;本方法可以检测到超声合成月桂酸蔗糖酯有6种月桂酸蔗糖单酯同分异构体、7种月桂酸蔗糖二酯同分异构体以及4种月桂酸蔗糖三酯同分异构体。
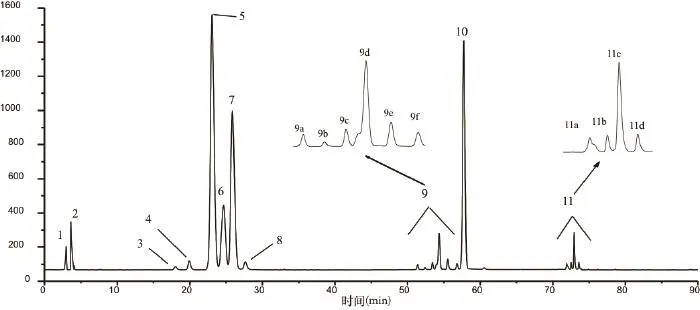
图2 月桂酸蔗糖酯的HPLC色谱图
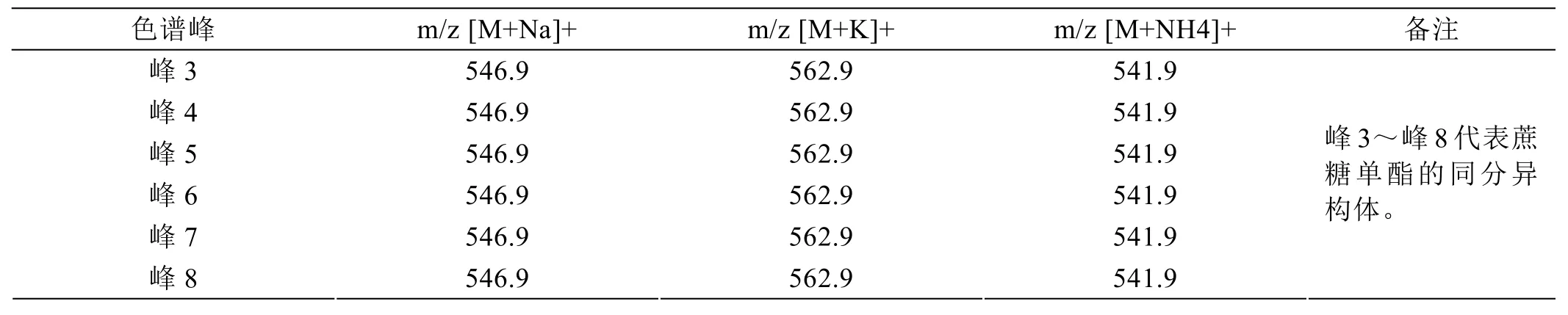
表5 蔗糖单酯色谱峰的质谱表征
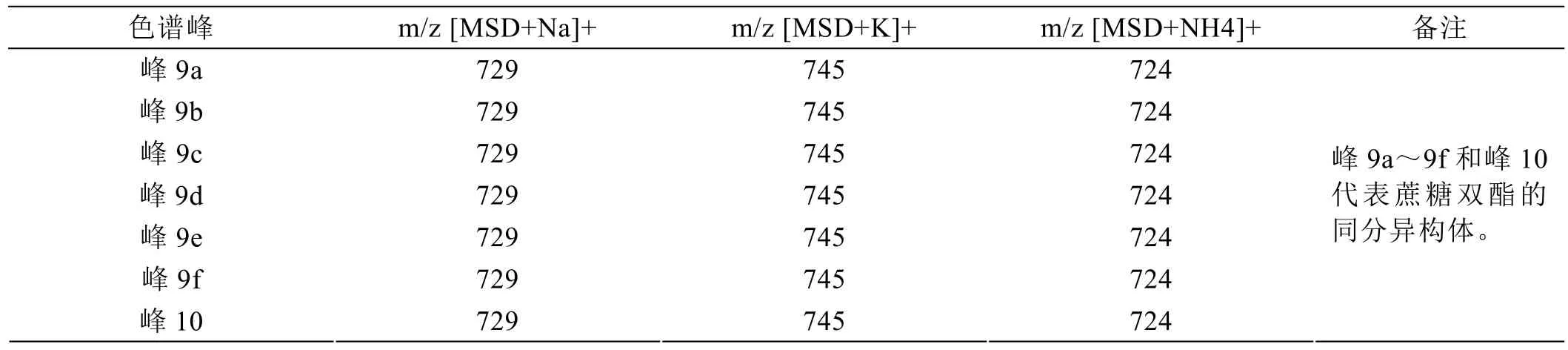
表6 蔗糖双酯色谱峰的质谱表征
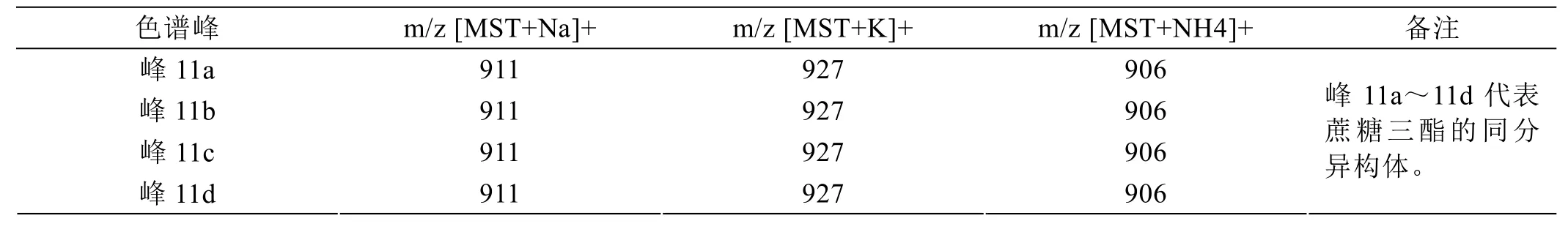
表7 蔗糖三酯色谱峰的质谱表征
3 结论
本文建立了同时测定月桂酸蔗糖单酯同分异构体、月桂酸蔗糖双酯、月桂酸蔗糖三酯及其杂质蔗糖的高效液相色谱-蒸发光散射检测方法(HPLC-ELSD)。该方法蔗糖单酯的线性范围为2~10 mg/mL (R2=0.9988),最低检出限为1.5 µg,准确度和精密度均较高;该方法可以检测到超声合成月桂酸蔗糖酯有6种月桂酸蔗糖单酯同分异构体、7种月桂酸蔗糖二酯同分异构体以及4种月桂酸蔗糖三酯同分异构体。
[1] SZUTS A, SZABO R P. Sucrose esters as natural surfactants in drug delivery systems—A mini-review[J]. International Journal of Pharmaceutics, 2012, 433(1-2): 1-9.
[2] GAROFALAKIS G, MURRAY B S. Dilatational rheology and foaming properties of sucrose monoesters in the presence of β-lactoglobulin[J]. Colloids & Surfaces B Biointerfaces, 2001, 21(1-3): 3-17.
[3] SONG Z J, LI S J, CHEN X, et al. Synthesis of insecticidal sucrose esters[J] .Forestry Studies in China, 2006, 8(3): 26-29.
[4] CHANSANROJ K, BETZ G. Sucrose esters with various hydrophilic–lipophilic properties: Novel controlled release agents for oral drug delivery matrix tablets prepared by direct compaction[J]. Acta Biomaterialia, 2010, 6(6): 3-9.
[5] PLAT T, LINHARDT R J. Syntheses and applications of sucrose-based esters[J]. Journal of Surfactants and Detergents, 2001, 4(4): 415-421.
[6] AHSAN F, ARNOLD J J, MEEZAN E, et al. Sucrose cocoate, a component of cosmetic preparations, enhances nasal and ocular peptide absorption[J]. International Journal of Pharmaceutics, 2003, 251(1-2): 195-203.
[7] SANGNARK A, NOOMHORM A. Effect of dietary fiber from sugarcane bagasse and sucrose ester on dough and bread properties[J]. Lebensmittel-Wissenschaft und-Technologie, 2004, 37(7): 697-704.
[8] MIMA H, KITAMORI N. Chromatographic analysis of sucrose esters of long chain fatty acids[J]. Journal of American Oil Chemists Society, 1964, 41(3): 198-200.
[9] FEUGE R O, ZERINGUE H J, WEISS T J, et al. Preparation of sucrose esters by interesterification[J]. Journal of American Oil Chemists Society, 1970, 47(2): 56-60.
[10] WEISS T J, BROWN M, ZERINGUE H J, et al. Quantitative estimation of sucrose esters of palmitic acid[J]. Journal of American Oil Chemists Socicety,1971, 48(4): 145-148.
[11] 李延科,张淑芬,杨锦宗. 蔗糖酯的薄层色谱分析[J].色谱,2002,20(5):476-478.
[12] GUPTA R K, JAMES K, SMITH F J. Analysis of sucrose mono- and diesters prepared from triglycerides containing C12-C18 fatty acids[J]. Journal of the American Oil Chemists Society, 1983, 60(11): 1908-1913.
[13] 朱福妹,曾洁. 气相色谱法测定蔗糖脂肪酸酯[J]. 海峡药学,1997,9(1):141.
[14] KARRER R, HERBERG H. Analysis of sucrose ester fatty acid esters by high temperature gas chromatography[J]. Journal of High Resolution Chromatography, 1992, 15(9): 585-589.
[15] KAUFMAN V R, GARTI N. Analysis of sucrose esters composition by HPLC[J]. Journal of Liquid Chromatography, 1981, 4(7): 1195-1205.
[16] SEINO H, UCHIBORI T, NISHITANI T, et al. Enzymatic synthesis of carbohydrate esters of fatty acid (I) esterification of sucrose, glucose, fructose and sorbitol [J]. Journal of American Oil Chemists Society, 1984. 11(61): 1761-1765.
[17] 黄进. 蔗糖醋的高效液相色谱分析方法[J]. 精细化工,1986,3(6):43-47.
[18] JASPERS M E A P, VAN LEEWEN F F, Nieuwenhuls H J W, et al. High performance liquid chromatographic separation of sucrose fatty acid esters [J]. Journal of American Oil Chemists Society, 1987(64): 1020-1025.
[19] 杨勤萍,徐国梁,施邑屏,等. 高效液相色谱及薄层色谱分析蔗糖脂肪酸酯[J]. 分析测试学报,1999,18(1):28-30.
[20] 魏泱,丁明玉. 蒸发光散射检测技术[J]. 色谱,2000,18(5):398-401.
(本篇责任编校:邓丹丹)
Quantitative Analysis of Ultrasonic Synthesized Sucrose Laurate by HPLC Coupled with Evaporative Light-Scattering Detection
LAN Mei-juan1, XU Yong-shi2,3, YANG Xu4, ZHANG Ruo-xuan1, LI Yi1, SUN Shuai-nan1, QU Rui-jing1,
HANG Fang-xue1,2,5
(1Institute of Light Industry and Food Engineering, Guangxi University, Nanning 530004;2Collaborative Innovation Center of Guangxi Sugarcane Industry, Nanning 530004;3Institute of Guangxi Sugarcane, Nanning 530004;4Institute of Product Quality, Laibin 546100;5Engineering Center for Sugarcane and Guangxi University, Nanning 530004)
An accurate, rapid and sensitive high-performance liquid chromatographic (HPLC) method with evaporative light scattering detection (ELSD) was developed for the determination of ultrasonic synthesized sucrose laurate. The chromatographic separation was carried out on C8 column (4.6 mm× 300 mm, 5 μm) with a mobile phase composed of methanol and water at a flow rate of 1 mL/min by gradient elution, the ELSD drift tube temperature was set at 85℃ and the carrying gas was nitrogen of which the flow rate was 2.4 L/min. Under the above conditions, the linear range of the established monoesters calibration curve was 2~10 mg/mL, with a regression correlation coefficient of 0.9988. The average spike recovery was 99.68%, with a relative standard deviation (RSD) of 3.50%, and the limit of detection of 0.15 μg. The method was useful for the determination of sucrose laurate, being rapid and simple to conduct with good accuracy and reliability.
High-performance liquid chromatography; Evaporative light scattering detection; Sucrose laurate; Ultrasonic
TS246
A
1005-9695(2016)06-0053-06
2016-10-31;
2016-12-20
国家自然科学基金资助项目(11164001)
兰梅娟(1992-),女,硕士研究生,研究方向:蔗糖深加工;E-mail:1446942108@qq.com
*通讯作者:杭方学(1978-),男,副教授,研究方向:蔗糖深加工;E-mail:hangfx@163.com
兰梅娟,徐勇士,杨旭,等. HPLC-ELSD分析超声法合成月桂酸蔗糖酯的含量[J]. 甘蔗糖业,2016(6):53-58.

