牛粪发酵沼液中产甲烷菌的分离及分子鉴定
陈楠楠,叶丽丽,王华欣,祝婧,乔波,赵静虎,刘通,岳山,周金玲,刘宇,朱战波
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江省兽医科学研究所)
牛粪发酵沼液中产甲烷菌的分离及分子鉴定
陈楠楠1,2,叶丽丽1,王华欣1,祝婧1,乔波1,赵静虎1,刘通1,岳山1,周金玲1,刘宇1,2,朱战波1
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江省兽医科学研究所)
为了确定牛粪发酵沼液中疑似菌株的生物特性和种属关系。采用Hungate滚管技术、厌氧培养、革兰氏染色镜检、PCR扩增技术和抗生素耐受性鉴定等方法进行分析。实验结果表明,牛粪发酵沼液分离到了一株革兰氏阳性菌,能够利用CO2,最适生长温度为37℃,单独或成对存在。菌落呈灰白色,光滑,表面凸起。PCR扩增出1 200 bp的16S rDNA片段,测序结果表明,该分离菌为产甲烷短杆菌。
产甲烷菌;厌氧培养;沼气
产甲烷菌(methanogen)是一类以产生大量甲烷气体作为能量代谢的终产物的特殊原核微生物,广泛存在于各种极端厌氧环境中,如反刍动物的瘤胃和沼气反应器等人为环境中[1],沼气发酵过程是一个由多种微生物联合,交替作用的复杂生化过程[2]。沼气发酵微生物种类繁多,分为不产甲烷群落和产甲烷群落[3],并且,在沼气发酵过程中,产甲烷菌是关键微生物[4]。人们在以往有关沼气发酵微生物的研究中重点关注沼气发酵三个阶段及各阶段中不同微生物的作用[5-6],发现沼气发酵限速步骤是产甲烷阶段[7],而其中起主导作用的是产甲烷菌。产甲烷菌作为自然界碳素循环中厌氧生物链的最后一个成员,分析沼气发酵过程中产甲烷菌的变化,对于自然界中的其他许多循环具有不可估量的推动力[8]。目前已知,自然环境中的微生物有90%~99%是还未可培养的,加之产甲烷菌的严格厌氧性、培养周期长等特点,使得通过传统的培养分离技术对产甲烷菌群落结构的分析十分困难,随着现代分子生物学的发展,特别是16S rDNA分析的方法引入厌氧环境微生物群落的研究中,使得快速、全面、准确地研究厌氧系统内的产甲烷菌的群落结构的多样性成为可能。对沼气发酵池中的产甲烷菌进行研究,并通过传统的Hungate滚管技术[9]和厌氧培养方法,从发酵液中分离产甲烷菌并进行鉴定,以期为有效控制沼气发酵,减少温室气体的排放提供参考数据。
1 材料与方法
1.1 原料
沼液样品采自黑龙江省某奶牛场粪污发酵池。
1.2 培养基
1.2.1 普通培养基
营养琼脂培养基,购自北京奥博星生物技术有限责任公司;厌氧肉肝汤培养基,购自上海源叶生物科技有限公司。
1.2.2 产甲烷菌分离培养基[10]
NaCl0.1%,MgCl20.01%,K2HP040.04%,KH2P040.02%,酵母提取物0.2%,蛋白胨0.2%,半胱氨酸0.05%,甲酸钠0.5%,乙酸钠0.5%,甲醇0.35%,Na2S1%,NaHC035%,琼脂粉,均购自哈尔滨赛拓有限公司。
固体培养基:添加0.5%琼脂,在高压灭菌(115℃,30 min)后,培养基使用前,每5 mL培养基中加入1%的Na2S和5%的NaHC03各0.1 mL。
1.3 产甲烷菌的分离纯化
1.3.1 产甲烷菌培养基分离纯化
试管中装有5 mL融化的琼脂培养基,冷却至47℃左右时接种,在漩涡振荡器上混匀,然后迅速(数秒钟)在装有冷水的烧杯中滚动,使琼脂培养基在滚管中凝固,将凝固后的培养基立即放入厌氧培养罐中,抽真空,注入CO2,37℃厌氧培养。培养7 d后,滚管壁上即可出现菌落,而后用接种环挑取单菌落放入新鲜的培养基中培养,新培养的菌液经过多次滚管和单菌落分离后即可得到纯的菌株。
1.3.2 厌氧肉肝汤培养基分离纯化
试管中装有5 mL的厌氧肉肝汤培养基,吸取沼液50 μL加入厌氧肉肝汤中,在漩涡振荡器上混匀,加入500 μL液体石蜡,立即放入厌氧培养罐中,抽真空,注入CO2,37℃培养。培养4 d后,试管中培养基变浑浊,而后吸取50 μL放入新鲜的培养基中培养,新培养的菌液经过多次分离后即可得到纯的菌株。
1.4 产甲烷菌的生物特性鉴定
1.4.1 形态观察
将产甲烷菌进行革兰氏染色,镜检观察。
1.4.2 运动性观察
直接滴加菌液至载玻片上,盖上盖玻片后,用显微镜直接观察,可观察到产甲烷菌的形态,以及是否具有运动性。
1.5 抗生素耐受性测定
1.5.1 药物敏感试验
产甲烷菌对于多种抗生素均有耐受性,试验选取十种抗生素:多粘菌素B、大观霉素、头孢唑啉、阿莫西林、呋喃唑酮、环丙沙星、四环素、氯霉素、青霉素、链霉素与产甲烷菌进行试验。首先将产甲烷菌涂布于营养琼脂平板,之后加入抗生素纸片,37℃恒温厌氧培养3 d,检验产甲烷菌的抗生素耐受性。
1.5.2 消毒剂杀菌试验
研究选择三种表面活性剂复配消毒剂[11](实验室研制)与产甲烷菌作用,首先,将0.2%浓度的表面活性剂4.5 mL,加入产甲烷菌液0.5 mL,作用1 h后,稀释涂板,最后置于37℃恒温厌氧培养3 d,观察表面活性剂与甲烷菌的杀菌作用。
1.6 产甲烷菌的16SrDNA序列的测定
1.6.1 菌液总DNA的提取
参考Esther M.Gabon的Blending method[12]和黄婷婷[13]的修正后的方法进行了操作。
1.6.2 产甲烷菌的16S rDNA的PCR扩增
根据Wright等人所报道的产甲烷菌16S rDNA特异性引物[14],Met83F(5′-ACKGCTCAGTAACAC-3′),Met1340R(5′-CGGTGTGTGCAAGGAG-3′),选择性扩增出产甲烷菌16S rDNA片段(扩增片段理论大小为1.2 kb),PCR反应体系见表1。

表1 PCR反应体系Table 1 PCR reaction system
反应条件:首轮循环94℃预变性3 min;再接94℃变性30 s,59℃复性30 s,72℃延伸90 s,共30个循环,最后在72℃再延伸l0 min,扩增出1.2 kb的片断。1.6.3 PCR扩增产物的回收与纯化
用琼脂糖凝胶DNA回收试剂盒回收和纯化DNA,操作步骤详见北京索莱宝科技有限公司琼脂糖凝胶DNA回收试剂盒中的说明书。收集得到的DNA溶液一部分用琼脂糖凝胶电泳鉴定回收效果,剩余的DNA溶液放-20℃保存。
1.6.4 目的基因片段与pMD18-T载体连接
将回收并纯化后的基因片段与pMD18-T载体进行连接,具体操作方法按照TaKaRa的pMD18-T Vector说明书进行。取一个PCR微量反应管,依次向管中加入表2中所列出的各项试剂,上下颠倒混合均匀后瞬时离心,放16℃连接仪中连接10 h。

表2 连接反应体系Table 2 Ligation reaction system
1.6.5 连接产物的转化
将pMD18-T连接产物分别转化进E.coli DH5α感受态细胞中,具体操作方法按照BMDH5α感受态细胞使用说明书进行。
1.6.6 16SrDNA的序列测定
以pMD18-T Vector上的经PCR鉴定正确的菌确定为pMD18-T阳性克隆菌,将阳性克隆菌的菌液与50%甘油1∶1混合,装入1.5 mL离心管中,用封口膜封口,一部分送上海生工生物工程技术服务有限公司进行测序,另一部分保存于-80℃冰箱中备用。
2 结果与分析
2.1 产甲烷菌的分离纯化结果
2.1.1 产甲烷菌培养基分离纯化
利用产甲烷培养基,经过严格厌氧培养7 d,试管中有气体产生,并带有刺激性气味,菌落呈灰白色,表面凸起,革兰氏染色阳性,菌体呈短杆状,成对或多个相连,能够利用CO2,最适生长温度为37℃。
2.1.2 厌氧肉肝汤培养基分离纯化
利用厌氧肉肝汤培养基,经过严格厌氧培养4 d,试管中有气体产生,试管颜色变深,底部有白色沉淀产生,带有刺激性臭味,在营养琼脂板中生长良好,菌落呈灰白色,光滑,表面凸起,革兰氏染色阳性,菌体成对存在,能够利用CO2,最适生长温度为37℃。
产甲烷菌属于严格厌氧菌,很难被分离出来,由以上培养结果可以看出,产甲烷菌的培养必须在严格厌氧的条件下,且能够利用CO2,才有可能被培养、分离出来。采用Hungate滚管技术分离纯化,与厌氧肉肝汤培养相比较,培养时间稍长些,但是菌落生长较好。
2.2 产甲烷菌的生理生化鉴定结果
2.2.1 形态观察
产甲烷菌为革兰氏阳性菌,菌体呈短杆状,一般单独或成对存在,菌落呈灰白色,表面凸起。
2.2.2 运动性观察结果
产甲烷菌镜检观察无鞭毛、无荚膜、没有运动性。
2.3 抗生素耐受性测定结果
2.3.1 药物敏感试验结果
试验选择多粘菌素B、大观霉素、头孢唑啉、阿莫西林、呋喃唑酮、环丙沙星、四环素、氯霉素、青霉素、链霉素与产甲烷菌进行药物敏感性试验,检验产甲烷菌的耐受性。结果表明,产甲烷菌对多粘菌素B,大观霉素,头孢唑啉,阿莫西林,氯霉素,青霉素敏感,对呋喃唑酮、链霉素耐药(见表3)。

表3 药物敏感试验Table 3 Drug sensitivity test
2.3.2 表面活性剂试验结果
试验选择Gemini+戊二醛、Gemini+醋酸氯已定、Gemini+二硫氰基甲烷,三种新型消毒剂与产甲烷菌作用,检测新型消毒剂对产甲烷菌的杀菌效果。结果表明,Gemini+戊二醛消毒剂在60 min作用时间下,可有效杀灭产甲烷菌,而Gemini+醋酸氯已定、Gemini+二硫氰基甲烷消毒剂在同样的作用时间下不能杀灭产甲烷菌,由此可以看出,Gemini+戊二醛消毒剂对产甲烷菌有一定杀灭作用。(见表4)。

表4 消毒剂杀菌试验结果Table 4 Disinfectant test results
2.4 PCR扩增结果
以产甲烷菌16S rDNA特异性引物通过PCR扩增出产甲烷菌1 200 bp的16S rDNA片段(见图1)。

图1 PCR鉴定电泳图谱Fig.1 PCR electrophoresis patterns identified
由图5可见,扩增大小与设计时的大小结果一致,约为1 200 bp,目的片段扩增的成功与否取决于反应体系、温度、扩增参数、引物设计等方面,试验成功扩增出了目的片段,说明上述条件都符合甲烷菌特异片段扩增的要求。
2.5 16SrDNA的序列测定结果
连接到pMDl8-T Vector上的16S rDNA,以特异性测序引物Met83F(5′-ACKGCTCAGTAACAC-3′),Met1340R(5′-CGGTGTGTGCAAGGAG-3′)测序,并将结果进行序列比对,结果该序列甲烷菌与Methanobrevibacter sp.R4C序列比对结果为相似率100%,并且无基因突变(见图2)。
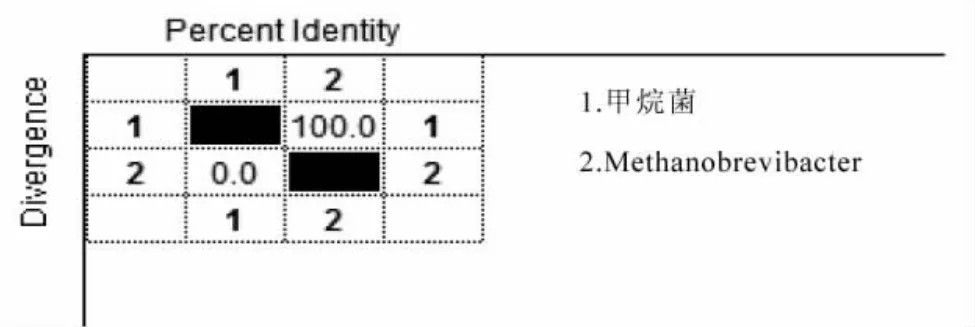
图2 产甲烷菌16S rDNA序列比对结果Fig.2 Methanogenic bacteria 16SrDNA sequence alignment results
2.6 16SrDNA的系统发育树
产甲烷菌16S rDNA序列用Blast软件与GENEBANK数据库中的16S rDNA序列进行同源性比较,利用Bayes软件包中程序生成系统发育进化树(见图3)。
以传统的Hungate滚管技术和厌氧培养方法,从牛粪沼气池中分离到一株产甲烷菌-图中的83F,通过鉴定和系统发育树分析,结果显示,该菌株确定为Methanobrevibacter sp,鉴定的结果与前一部分分子生物学方法所得到的结果一致。
3 讨论
近年来,由于甲烷是仅次于二氧化碳的一种不容忽视的温室气体,有关产甲烷菌的研究因而日益受到重视。严格的厌氧条件是产甲烷细菌分离成败的关键,产甲烷细菌遇氧后其生长会受到抑制,失去活性。所以密封的培养容器和操作过程的严格厌氧是整个试验成功的关键。为此,厌氧箱中需用高纯CO2等来驱除气相中的空气。

图3 基因文库中与产甲烷菌相关的16S rDNA系统发育树图Fig.3 Gene library with methanogens related 16S rDNA phylogenetic tree
使用现有的亨盖特滚管分离纯化培养技术,通过改变底物成分或添加化学抑制剂仍被作为研究产甲烷菌代谢特性并实现分离纯化产甲烷菌的主要途径。采用此方法从沼液中分离出产甲烷细菌,但是此方法分离出的产甲烷菌比较少,而且过程比较烦琐。因此,采用厌氧肉肝汤培养基进行厌氧培养,同样,分离出一株产甲烷菌,通过初步的形态、生理生化特征及16S rDNA分析等方法进行鉴定,结果,该菌为革兰氏阳性菌,菌体呈短杆状,一般成对存在,能够利用CO2,最适生长温度为37℃,经PCR鉴定,目的片段为1 200 bp,测序鉴定结果为产甲烷短杆菌。因此,确定该菌为一株产甲烷短杆菌,该甲烷菌对多粘菌素B、大观霉素、头孢唑啉、阿莫西林敏感、氯霉素、青霉素敏感,表面活性剂Gemini+戊二醛消毒剂在60 min作用时间内即可杀灭产甲烷菌。
[1]Lange M,Ahring B K.A comprehensive study into the molecularmethodologyandmolecularbiologyof methanogenic Archaea[J].FEMS Microbiol ReV.,2001(12):553-571.
[2]RITCHIE D A,EDWARDS C.Detection of methanogens and methanotrophs in natural environments[J].Global Change Biology,1997(3):33.
[3]陈世和,陈建华,王士芬.微生物生理学原理[M].上海:同济大学出版社,1992.
[4]阂航,陈美慈.厌氧微生物学[M].杭州:浙江大学出版社,1991.
[5]农业部.全国生猪优势区域布局规划(2008—2015)[EB/ OL].http://www.ahri.gov.cI∥govpublic,2010-11-13.
[6]张克强,高怀友.畜禽养殖业污染物处理与处置[M].北京:化学工业出版社,2004.
[7]刘京,刘志丹,袁宪正,等.沼气生产及利于一瑞典经验[J].中国沼气,2008,26(6):38.
[8]汪婷.沼气发酵过程中产甲烷菌分子多样性研究及产甲烷菌的分离[D].南京:南京农业大学,2005.
[9]Hungate R H.Laboratory Exercises in Anaerobic[J].Microbiology,1980(6):27.
[10]路子佳.高温菌糖沼气发酵的初探及产甲烷菌的分离[D].南京:南京农业大学,2010.
[11]陈楠楠.阳离子表面活性剂的复配及在牛场消毒中的应用研究[D].大庆:黑龙江八一农垦大学,2015.
[12]张瑞福,曹慧.土壤微生物总DNA的提取和纯化[J].微生物学报,2004,43(2):276-281.
[13]Esther M.Gabor,Erik J.de Vries,Dick B.Janssen.Efficient recovery of environmental DNA for expression cloning by indirect extraction methods[J].FEMS Microbiology Ecology,2003,44:153-156.
[14]Wright A D G,pimp C.Improved strategy for presumptive identification of methanogens using 16S riboprinting[J]. J.Microbiol.Methods,2003,55(2):337-349.
Molecular Identification of Methanogens Isolated from Biogas Slurry Fermented with Cow Dung
Chen Nannan1,2,Ye Lili1,Wang Huaxin1,Zhu Jing1,Qiao Bo1,Zhao Jinghu1,Liu Tong1,Yue Shan1,Zhou Jinling1,Liu Yu1,2,Zhu Zhanbo1
(1.College of Animal Science and Veterinary Medicine,Heilongjiang Bayi Agricultural University,Daqing 163319;
2.Veterinary Science Research Institute of Heilongjiang Province)
Biological characteristics and relationship between species of Methanogens in biogas slurry fermented with cow dung were researchedbyHungaterolling-tubetechnique,anaerobicculturemethod,Gram'smethod,PCRandAntibioticresistance identification.Results showed that a gram-positive isolated bacteria was able to take advantage of the CO2,growth temperature was 37℃,existed alone or in pairs.Colonis were pale,smooth and convex.PCR results showed that 16SrDNA fragments of 1 200 bp were amplified,isolated bacteria was identified as Methanogens by DNA sequencing technology.
methanogens;anaerobic cultivation;biogas slurry
S216.4
A
1002-2090(2016)06-0117-05
10.3969/j.issn.1002-2090.2016.06.024
2015-10-11
国家科技支撑计划课题(2013BAD21B01-1)。
陈楠楠(1990-),女,黑龙江八一农垦大学动物科技学院2013级硕士研究生。
朱战波,男,教授,博士研究生导师,E-mail:zhanbozhu@163.com。

