索拉非尼联合替吉奥治疗晚期肝癌的临床观察
李建旺,黄春珍,元建华,陈琼慧,刘英平,孟娟,张曙波
(海南省海口市人民医院肿瘤科,海南海口570208)
新进展研究
索拉非尼联合替吉奥治疗晚期肝癌的临床观察
李建旺,黄春珍,元建华,陈琼慧,刘英平,孟娟,张曙波
(海南省海口市人民医院肿瘤科,海南海口570208)
目的比较索拉非尼联合替吉奥与索拉非尼单药治疗肝功能Child-Pugh A级的晚期肝癌患者的疗效和安全性。方法回顾性分析经病理组织学检查确诊的肝细胞癌Ⅳ期患者56例,其中27例患者行索拉非尼联合替吉奥治疗,29例行索拉非尼单药治疗。收集所有患者的临床病理和人口学特征。使用Kaplan-Meier方法对无进展生存期(PFS)和总生存期(OS)进行生存分析。结果可评价患者56例,中位随访8个月(4~36个月),联合组和单药组分别接受2.9个周期(1~8个周期)和3.5个周期(1~6个周期)治疗(P=0.44)。联合组和单药组疾病控制率(DCR)分别为48.1%和37.9%(χ2=0.650,P=0.171)。联合组与单药组中位PFS分别为5.2和3.4个月(χ2=7.329,P=0.007),中位OS 8.8和6.2个月(χ2=3.095,P=0.08)。联合组3/4级毒性主要与化疗药物有关,天门冬氨酸氨基转移酶(AST)的增加(18.5%),血小板减少症(14.8%),中性粒细胞减少症(22.2%),手足综合征(22.2%)。单药组3/4级毒性表现为AST增加(3.5%),中性粒细胞减少症(6.8%),皮肤损害(3.4%)。结论索拉非尼联合替吉奥治疗晚期肝细胞癌与目前推荐的单药索拉非尼相比,有效率提高10.2%,PFS延长1.8个月,OS延长2.6个月,安全性良好,值得临床上推广应用和进一步观察。
晚期肝癌;索拉非尼;替吉奥;疗效
肝细胞性肝癌(hepatocellular carcinoma,HCC)是世界上5个最常见实体瘤之一,在全球肿瘤相关性死亡中位居第2位[1]。肝癌具有显著的中国特色,不仅肝癌患者的发病率和死亡率占据了全世界的半壁江山,并且在发病原因、生物学行为、临床特征、治疗选择和预后方面,均与西方国家和日本人存在明显的差异[2]。尽管早、中期肝癌由于治疗方法的进步使得其预后得到改善,但晚期肝癌仍缺乏有效系统的治疗[3]。索拉非尼(Sorafenib,商品名:多吉美,Nexavar)作为晚期肝癌的多靶点、多激酶抑制剂,被列为晚期肝癌的一线治疗药物。索拉非尼具有双重抗肿瘤作用,一方面通过抑制RAF/MEK/ERK信号转导通路直接抑制肿瘤细胞生长;另一方面又通过阻断细胞表面血管内皮生长因子受体/血小板衍生生长因子受体的自身磷酸化,影响下游酪氨酸激酶活性,从而抑制肿瘤新生血管的形成,达到肿瘤饥饿疗法的目的,间接抑制肿瘤细胞的生长[4]。一项索拉非尼治疗晚期肝癌Ⅲ期临床研究发现,与安慰剂相比,中位总生存期分别为10.7和7.9个月,中位肿瘤进展时间分别为5.5和2.8个月。治疗组的中位总生存期较对照组仅延长了2.8个月[5]。但它对患者生存获益仍表现一般,尚不尽如人意。靶向药物与细胞毒类药物联合使用是提高分子靶向药物治疗疗效的一种策略。替吉奥(tegefur gimeracil oteracil,S-1)是一种氟尿嘧啶衍生物口服抗癌剂,由替加氟、吉美拉西和奥特拉西钾按照摩尔比1∶0.4∶1的比例组成[6],替吉奥对多种实体瘤有效[7-8],同时,也是毒副反应可耐受且疗效前景乐观的抗肝癌药物[9]。前期一些Ⅰ、Ⅱ期的研究已证实索拉非尼联合细胞毒类药物疗效尚可,且毒副反应均可耐受[10]。免疫缺陷小鼠实验发现替吉奥联合索拉非尼治疗较单用替吉奥或索拉非尼具有更强的抗肿瘤生长,能够显著抑制胸苷酸合成酶(thymidylate synthetase,TS)活性[11]。YOSHIHIKO等[12]完成Ⅰ、Ⅱ期研究证实替吉奥联合索拉非尼在64mg/(m2·d)和800mg/d具有稳定的疗效,并且毒副反应可耐受。基于以上背景,索拉非尼协同替吉奥将有效的成为晚期肝癌患者的一线治疗药物。
1 资料与方法
1.1 一般资料
选取2010年3月-2014年6月在海口市人民医院住院的56例晚期肝癌患者。其中,男性37例(66.1%),女性19例(33.9%),年龄37~81岁,平均63岁。入选标准:患者均经病理学确诊或具有典型影像学证据确诊;无手术切除或局部治疗[经皮(瘤内)无水乙醇注射用于肝癌微创治疗、射频消蚀、微波凝固疗法、经导管动脉化学栓塞放射治疗等]指针;初治未接受化疗的患者;至少有1个可测量病灶,疗效评定采用实体瘤评价标准(response evaluation criteria in solid tumour,RECIST);美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1;年龄≥20岁;中性白细胞计数≥1 500μl;血红蛋白≥9.0 g/dl;血小板≥80 000μl;总胆红素<3.0mg/dl;天冬氨酸转氨酸(glutamic oxaloacetic transaminase,AST)/丙氨酸转氨酶(glutamic pyruvic transaminase,ALT)<5倍正常值上限;白蛋白≥2.8 g/dl,血清肌酸酐<正常值上限;凝血酶原时间≥40%;肝功能Child-Pugh A级;患者可进食物及口服药物;预期生存期12周以上。剔除标准:门静脉癌栓形成;难控制高血压;胸腔积液;腹水及心包积液或呼吸循环功能不良;治疗前30 d内有过输血或输注过血清白蛋白的患者;肝性脑病或者具有临床症状的脑病变;中枢神经系统肿瘤(包括脑转移瘤);伴有临床症状的骨转移;活动性感染[除外乙肝病毒(hepadnaviridae virus,HBV)及丙肝病毒(hepatitis C virus,HCV)];治疗前30 d内具有严重消化道出血证据者;胃食管静脉曲张需预防治疗者;怀孕及哺乳期妇女;研究期间不同意采取避孕者;第2原发肿瘤患者(除外原位癌或者原发肿瘤经治疗后5年以上无复发者)。所有患者的追踪随访截止至2015年2月。
1.2 方法
1.2.1 治疗方法联合组接受索拉非尼联合替吉奥方案治疗:索拉非尼400mg/d,2次/d口服,同时口服替吉奥40~60mg/次、口服(体表面积<1.25m2者,40mg/次;体表面积1.25~1.5m2者,50mg/次;体表面积≥1.5m2者,60 mg/次),第l~14天,停药1周,3周为1个疗程。对照组接受索拉非尼单药方案治疗:索拉非尼400mg/d,2次/d。治疗过程中,如患者出现Ⅲ、Ⅳ度骨髓抑制时,可使用利可君20mg/次,3次/d;重组人促红素注射液2 000 u/次,皮下注射,1次/d。治疗期间每周查血常规1次,每月查肝功能1次,白细胞计数<3×109个/L或肝功能异常时停药8周后进行评价,对药物反应性好及可耐受治疗者停药休息2~4周重复下一周期治疗。患者均签署知情同意书。
1.2.2 疗效评价每2个周期治疗后采用放射(胸部X射线和计算机断层扫描)检查进行疗效评估,直至疾病进展。评价标准根据RECIST 1.1版,疾病控制率(objective response rate,DCR)=完全缓解(CR)+部分缓解(PR)+疾病稳定(SD)。无进展生存期(progression-free survival,PFS)定义为从治疗开始至肿瘤客观进展或任何原因的死亡时间。总生存期(overall survival,OS):时间从登记日期到死亡日期。幸存的患者在最后确认的生存日期。
1.3 统计学方法
采用SPSS 13.0统计软件进行数据分析,分组比较行χ2检验及Ridit分析,两组间生存率比较,分析用Kaplan-Meier法以及Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组分组情况及均衡性比较
56例患者分两组,联合组27例,单药组29例,两组性别、年龄、病毒感染类型、ECOG评分、巴塞罗那临床肝癌分期(BCLC)、Child-Pugh分级等临床资料比较,差异无统计学意义(P>0.05)。见表1。
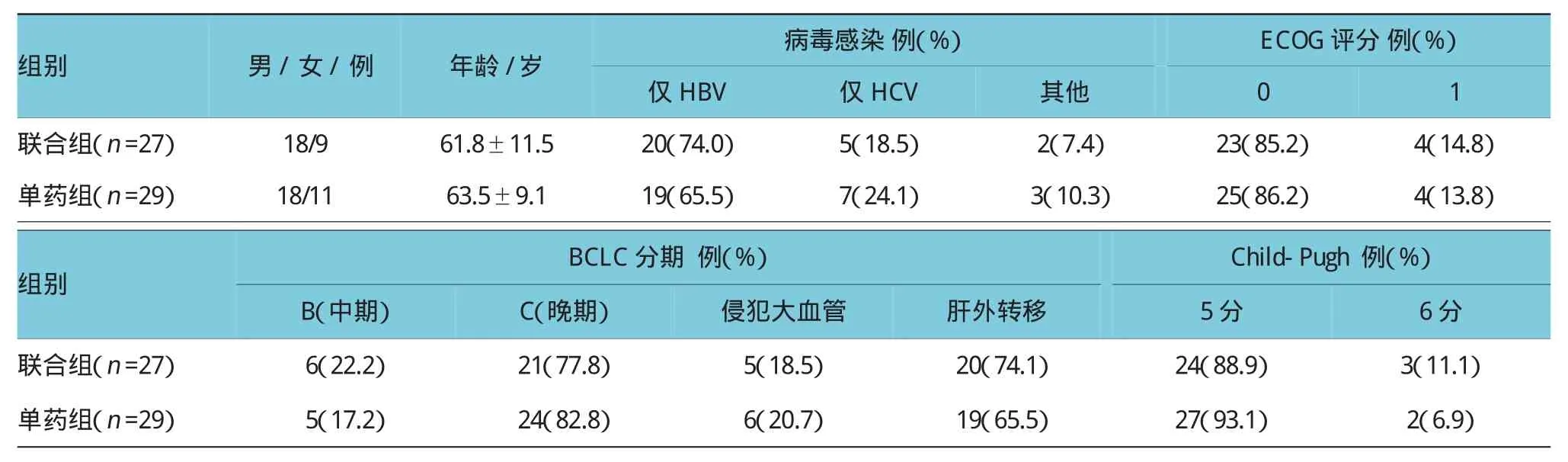
表1 56例患者的一般情况
2.2 客观疗效
全组56例患者均可评价疗效,联合组和单药组分别完成治疗周期数为2.9(1~8个周期)及3.5个周期(1~6个周期)(P=0.440)。联合组获CR 0例(0%),PR 2例(7.4%),SD 11例(40.7%),疾病进展(PD)14例(51.9%),RR 7.4%,DCR 48.1%。单药组获CR 0例(0%),PR 1例(3.4%),SD 10例(34.5%),PD 18例(62.1%),RR为3.4%,DCR 37.9%。两组间RR差异无统计学意义(χ2=0.045,P=0.831),两组间DCR差异无统计学意义(χ2=0.650,P=0.171)。至随访截止日期2015年2月,死亡41例,15例存活。所有患者中位随访8个月(4~36个月)。联合组中位OS为8.8个月(95%CI:4.1,23.1),单药组中位OS为6.2个月(95%CI:4.3,18.5),联合组OS较单药组延长,差异有统计学意义(χ2=3.095,P=0.08)。联合组中位PFS 5.2个月(95%CI:2.7,10.2),单药组中位PFS 3.4个月(95%CI:2.3,9.7),联合组PFS较单药组延长,差异有统计学意义(χ2=7.329,P= 0.007)。见表2、3。
2.3 治疗相关性毒性
联合组3/4级毒性主要为AST增加(18.5%)、血小板减少症(14.8%)、中性粒细胞减少症(22.2%)和手足综合征(22.2%)。单药组3/4级毒性表现为AST增加(3.5%)、血小板减少症(0%)、中性粒细胞减少症(6.8%)和皮肤损害(3.4%)。联合组均高于单药组,差异有统计学意义(P<0.05)。两组间Ⅲ、Ⅳ级乏力、皮肤损害、疼痛及胃肠反应等发生比率均基本相似,差异无统计学意义(P>0.05)。两组患者治疗中均未出现感染及感染性发热,均无患者因治疗相关性毒性致停药或减量化疗事件发生。见表4。
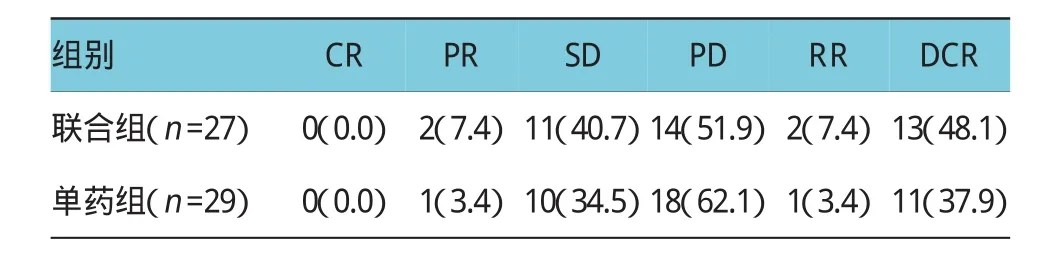
表2 联合组或单药组治疗晚期肝癌的近期疗效比较例(%)

表3 联合组或单药组治疗晚期肝癌的疗效比较

表4 联合组或单药组治疗晚期肝癌的毒副反应≥3级例(%)
3 讨论
在晚期肝癌治疗中,索拉非尼联合替吉奥比索拉非尼单药更有效提高缓解期,并延长总生存期和无进展生存期,2种药物的协同作用导致药效提高,但具体机制有待进一步研究。
肝癌是最常见的恶性肿瘤之一,在中国肝癌发病率为30/10万,死亡20.4/10万,占恶性肿瘤死亡的18.8%[13]。在我国,晚期HCC患者的中位生存期仅为3~4个月,明显低于欧美国家的6~9个月[2]。目前,对于失去手术、移植、局部消融及TACE治疗机会的晚期肝癌患者尚缺乏治疗的标准[14]。2007年11月,美国食品药品管理局批准索拉非尼作为晚期肝癌的多靶点、多激酶抑制剂,并将其列为晚期肝癌的一线治疗药物。两项关于索拉非尼治疗原发性肝癌的大规模的Ⅲ期临床研究LLOVET[5]和CHENG[15]均证实,索拉非尼较安慰剂可显著延长晚期肝细胞癌患者的总生存期和疾病进展时间,因此索拉非尼被NCCN的专家推荐用于晚期肝癌标准一线治疗的首个靶向药物。SHARP研究结果显示,中位OS 10.7个月,中位PFS 5.5个月(95%CI:2.63,3.58),ORIENTAL研究结果显示,总有效率为3.3%,疾病控制率为35.3%,中位OS 6.5个月(95%CI:5.56,7.56),中位TTP 2.8个月(95%CI:2.63,3.58)。本研究中联合组总有效率为7.4%,疾病控制率为48.1%,中位OS为8.8个月(95%CI:4.1,23.1),中位PFS 5.2个月(95%CI:2.7,10.2)。单药组总有效率为3.4%,疾病控制率为37.9%,中位OS为6.2个月(95%CI:4.3,18.5),中位PFS 3.4个月(95%CI:2.3,9.7)。索拉非尼单药组RR、DCR、中位TTP及OS与ORIENTAL研究比较基本相似,均较SHARP研究明显减少,这应该是亚洲肝癌患者多具有乙型肝炎及肝硬化背景,往往合并肝功能损害和(或)全血细胞减少。该病理变化可能是预后较差的原因。而本研究中联合组患者较单药组患者RR、DCR有提高趋势,但差异无统计学意义。中位PFS延长1.8个月,中位OS延长2.6个月,差异有统计学意义。而与临床各因素均无相关,考虑为化疗药物协调靶向药物增加疗效有关。ZHAI等[11]研究发现,索拉非尼通过下调E2F-1和TS的表达增强氟尿嘧啶/S-1对肝癌疗效,索拉非尼联合替吉奥对肝细胞癌具有协同疗效。该实验结论与本研究结果类似。
YAU等[16]报道了一项对香港患者进行的Ⅱ期研究结果,采用以奥沙利铂为主的XELOX方案系统化疗联合索拉非尼治疗51例亚洲晚期HCC患者,患者中84%为HBV携带者,肝功能为Child A级患者占98%,具体方案为:索拉非尼400mg,2次/d,口服,第1~14天,第1天联合奥沙利铂85mg/m2,卡培他滨1 700 mg/m2,口服,第1~7天;结果显示,全组患者的RR为16%,中位PFS和OS分别为7.3和10.8个月,较ORIENTAL研究的对应指标显著延长。隋忠国等[17]报道索拉非尼联合卡培他滨治疗晚期HCC;沈二栋等[18]报道索拉非尼联合5-氟尿嘧啶治疗晚期HCC。以上结果均提示联合治疗具有较好的可行性和安全性。本研究中RR较YAU研究减少,但与ORIENTAL研究相似,可能本研究中联合化疗单药较联合两药化疗有效率更低,或者因为样本量少造成。但本研究与其他国内相关研究结果均显示出靶向联合化疗较单药靶向治疗晚期肝癌具有较好的可行性和安全性。
YOSHIHIKO等[12]对26例晚期肝癌患者采用S-1 64mg/(m2·d),第1~14天联合索拉非尼800mg/d,每21天1周期。进行Ⅱ期实验,研究显示Ⅲ~Ⅳ的毒副反应为天门冬氨酸氨基转移酶增高(38.5%)、血小板减少症(23.1%)、中性粒细胞减少症(19.2%)、高胆红素血症(15.4%)、丙氨酸氨基转移酶升高(15.4%)、低钠血症(11.5%)、皮疹(11.5%)和低磷血症(11.5%)。突然死亡患者1例(3.8%)。结论提示,实验患者毒副反应在可耐受范围。本研究中,27例联合组患者中出现Ⅲ、Ⅳ级毒性主要与化疗药物有关,其中天门冬氨酸氨基转移酶(AST)升高(18.5%)、血小板减少症(14.8%)、中性粒细胞减少症(22.2%)及手足综合征(22.2%)。对比29例单药组患者出现3/4级毒性表现为AST增加(3.5%)、中性粒细胞减少症(6.8%)及皮肤损害(3.4%)。其中AST升高、血小板减少症及手足综合征为新增反应,中性粒细胞下降较单药组有增多,但总体毒副反应均在可接受范围。与YOSHIHIKO等[12]实验比较相似。
因此,当前的研究结果显示:索拉非尼联合替吉奥治疗晚期肝细胞癌较单药索拉非尼比较不良反应稍有增加,但总体毒副反应均在可接受范围。索拉非尼与替吉奥联合对部分晚期肝细胞癌患者可提高治疗的有效率并延长PFS及OS,可能成为晚期肝细胞癌患者治疗的一种有效选择,并且其安全性良好,值得临床应用和进一步深入研究。但由于本研究病例数较少,尚需扩大病例进一步证实。
[1]FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136:e359-386.
[2]龚新雷,秦叔逵.索拉非尼治疗国人晚期肝细胞癌的临床研究进展[J].临床肿瘤学杂志,2015,20(2):175-184.
[3]LLOVET J,DI BISCEGLIE A,BRUIX J,et al.Design and endpoints of clinical trials in hepatocellular carcinoma[J].J Natl Cancer Inst,2008,100:698-711.
[4]WILHELM SM,CARTER C,TANG L,et al.BAY 43-9006 exhibits broad spec trum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Re,2004,64: 7099-7109.
[5]LLOVET JM,RICEI S,MAZZAFERRO V,et al.Sorafenib in advanced hep.atocellular carcinoma[J].N Engl J Med,2008, 359(4):378-390.
[6]SHIRASAKA T,SHIMAMATO Y,OHSHIMO H,et al.Development of a novel form of an oral 5-fluorouracil derivative(S-1) directed to the potentiation of the tumor selective cytotoxicity of 5-fluorouracil by two biochemical modulators[J].Anticancer Drugs, 1996,7(5):554-557.
[7]SHIRASAKA T.Development history and concept of an oral anticancer agent S-1(TS-1):its clinical usefulness and future vistas[J].Jpn J Clin Oncol,2009,39(1):2-15.
[8]SAIF M W,SYRIGOS K N,KATIRTZOGLOU N A.S-1:a promising new oral fluoropyrimidine derivative[J].Expert Opin Investig Drugs 2009,18(3):335-348.
[9]FURUSE J,OKUSAKA T,KANEKO S,et al.PhaseⅠ/Ⅱstudy of the pharmacokinetics,safety and efficacy of S-1 in patients with advanced hepatocellular carcinoma[J].Cancer Sci,2010,101(12): 2606-2611.
[10]TAKIMOTO CH,AWADA A.Safety and anti-tumor activity of sorafenib(nexavar)in combination with other anti-cancer agents: a review of clinical trials[J].Cancer Chemother Pharmacol, 2008,61(4):535-548.
[11]ZHAI JM,YIN X Y,LAI Y R,et al.Sorafenib enhances the chemotherapeutic efficacy of S-1 against hepatocellular carcinoma through downregulation of transcription factor E2F-1[J]. Cancer Chemother Pharmacol,2013,71(5):1255-1264.
[12]YOSHIHIKO O,TETSUHIRO C,SADAHISA O,et al.A phaseⅠ/Ⅱstudy of S-1 with sorafenib in patients with advanced hepatocellular carcinoma[J].InvestNew Drugs,2014,32(4):723-728.
[13]张思维,李连弟,鲁凤珠,等.中国1990~1992年原发性肝癌死亡调查分析[J].中华肿瘤杂志,1999,21(4):245-249.
[14]NG K K,POON R T,LO C M,et al.Analysis of recurrence pattern and it's influence on survival outcome after radiofre-quency ablation of hepatocellular carcinoma[J].Gastrointest Surg, 2008,12(1):183-191.
[15]CHENG A L,KANG Y K,CHEN Z,et al.Efficacy and safety of Sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phaseⅢrandomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1): 25-34.
[16]YAU T,CHEUNG F,LEE F,et al.A multicenter phaseⅡ study of sorafenib,capecitabine,and oxa liplatin(SECOX)in patients with advanced hepatocellular carcinoma:Final results of hong kong-singapore hepatocellular carcinoma research collaborative group study[J].J Clin Oncol,2013,31(Supp1):a4117.
[17]隋忠国,薛宏伟,荆凡波,等.索拉非尼联合卡培他滨治疗肝细胞癌患者的临床研究[J].中国药房,2008,19(11):848-849.
[18]沈二栋,胡建兵,翁洁.索拉非尼联合5-氟尿嘧啶治疗晚期肝癌的临床研究[J].临床和实验医学杂志,2013,12(19):1573-1574.
(张西倩编辑)
Clinical study of Sorafenib combined w ith S-1 in advanced hepatocellular carcinoma
Jian-wang Li,Chun-zhen Huang,Jian-hua Yuan,Qiong-hui Cheng, Ying-ping Liu,Juan Meng,Shu-bo Zhang
(Department of Oncology,People's Hospital of Haikou,Haikou,Hainan 570208,China)
ObjectiveTo compare the efficacy and safety of sorafenib combined with S-1 and single-agent sorafenib treatment Child-Pugh A grade of liver function in patients with advanced hepatocellular carcinoma.MethodsA total of 56 patients were included to this study,27 and 29 patients were treated with sorafenib combined with S-1 and single-agent sorafenib respectively.The clinicopathological and demographic characteristics of all patients were collected from themedical charts.Kaplan-Meier survival analysis was carried out for PFS and OS.ResultsThemedian follow-up of our study was 8(4-36)months.In both groups,median cycle of 56 patients was 2.9(1-8)and 3.5(1-6)in sorafenib combined with S-1 and single-agent sorafenib groups,respectively(P= 0.44).Overall response rate was observed in 48.1%and 37.9%of patients in sorafenib combined with S-1 and single-agent sorafenib groups,respectively(χ2=0.650,P=0.171).Median PFSwas 5.2 and 3.4months in sorafenib combined with S-1 and single-agent sorafenib groups,respectively(χ2=7.329,P=0.007).Median OSwas 8.8 and 6.2 months in sorafenib combined with S-1 and sorafenib single drug groups arms,respectively(χ2=3.095,P= 0.08),sorafenib combined with S-1 Group 3/4 toxicity associated with chemotherapy drugs,aspartate amino transferase(AST)(18.5%),thrombocytopenia(14.8%),the Neutrophilic granulocytopenia(22.2%),hand-footsyndrome(22.2%).Single group 3/4 toxicity manifested as increased AST(3.5%),Neutrophilic granulocytopenia (6.8%)and skin lesions(3.4%).ConclusionIn our trial,Sorafenib combined with S-1 in treating advanced hepatocellular carcinoma compared with the currently recommended single-agent sorafenib,extends the effective rate to 10.2%,PFS 1.8months,OS 2.6months.This treatment iswell tolerated,worthy of clinical application and further observation.
advanced hepatocellular carcinoma;Sorafenib;tegefur gimeracil oteracil;efficacy
R 735.2
B
10.3969/j.issn.1005-8982.2016.24.017
1005-8982(2016)24-0077-06
2016-03-02

