淫羊藿苷联合地塞米松对人髓核细胞增殖及分泌表达的影响
冯仲锴,孙永强,刘汝银,岳宗进,王新立
(河南中医学院第二附属医院骨科脊柱病区,河南郑州450002)
淫羊藿苷联合地塞米松对人髓核细胞增殖及分泌表达的影响
冯仲锴,孙永强,刘汝银,岳宗进,王新立
(河南中医学院第二附属医院骨科脊柱病区,河南郑州450002)
目的探讨淫羊藿苷(ICA)与地塞米松(Dex)联合作用对人髓核细胞(hNPs)增殖及聚集蛋白聚糖(Aggrecan)、II型胶原蛋白(Col2a)、IL-6、IL-8和基质金属蛋白酶(MMP-13)表达的影响。方法取生长状态良好的hNPs按不同处理因素分为:control组(只含培养基)、ICA组(20μmol/LICA)、Dex组(0.2μmol/LDex)、ICA+Dex组(20μmol/LICA+0.2μmol/LDex)、IL-1β组(10ng/mlIL-1β)、ICA+IL-1β组(20μmol/LICA+10ng/mlIL-1β)、Dex+IL-1β组(0.2μmol/LDex+10ng/mlIL-1β)、ICA+Dex+IL-1β组(20μmol/LICA+0.2μmol/LDex+10ng/mlIL-1β),各组作用48h;CCK-8法检测细胞的增殖;Westernblot、RT-PCR以及ELISA检测Aggrecan、Col2a、IL-6、IL-8和MMP-13表达。结果CCK-8结果显示:与control组比较,低浓度的ICA(≤20μmol/L)和Dex(≤0.2μmol/L)单独作用均提高hNPs存活率但差异无统计学意义(P>0.05)。然而,10μmol/LICA和0.2μmol/LDex联合用药对hNPs的存活率大于单独用药(P<0.05);Westernblot、RT-PCR以及ELISA结果表明:与单独用药组相比,ICA和Dex联合作用促进Aggrecan、Col2a蛋白和mRNA表达(P<0.05);另外,ICA和Dex联合处理抑制IL-1β诱导的hNPs炎症介质IL-6、IL-8的分泌表达(P<0.05),同时降低MMP-13蛋白、mRNA水平(P<0.05)。结论ICA与Dex联合作用对促进hNPs增殖、Aggrecan和Col2a表达有效果;同时抑制IL-1β诱导的hNPs炎症介质IL-6、IL-8和MMP-13的表达,为椎间盘退行性病变的药物治疗提供理论依据。
淫羊藿苷;地塞米松;人髓核细胞;聚集蛋白聚糖;II型胶原蛋白;椎间盘退行性病变
椎间盘退行性病变是脊柱外科典型的常见病、多发病,是由椎间盘退变引起的以颈肩腰腿痛为主要表现的一系列临床综合征。其机制极其复杂,到目前为止尚不完全清楚,是一个急需解决的医学难题[1]。促进髓核细胞的增殖,提高蛋白聚糖(Aggrecan)和Ⅱ型胶原蛋白(typeⅡcollagen,Col2a)的含量,抑制炎症介质的产生,对改善椎间盘退行性病变至关重要[2]。淫羊藿苷(Icariin,ICA)提取于中药淫羊藿,有强筋壮骨、增强免疫力等作用[3]。研究发现[4],淫羊藿苷抑制白细胞介素8(Interleukin-8,IL-8)、白细胞介素6(Interleukin-6,IL-6)、Col2a和基质金属蛋白酶(matrix metalloproteinases,MMPs),从而延缓椎间盘退变过程。地塞米松(Dexamethasone,Dex)是合成的糖皮质激素,具有抗炎、抗过敏、抗休克、免疫抑制等重要生理和药理作用,已经被广泛应用[5]。淫羊藿苷和地塞米松在改善腰椎间盘退行性病变方面均有相关报道,然而目前未见二者以及联合用药在髓核细胞方面的相关研究。本研究以人髓核细胞(human nucleus pulposus cells,hNPs)为研究对象,探讨ICA和Dex联合用药对hNPs增殖的影响,以及对hNPs内Aggrecan、Col2a表达、炎症介质和基质金属蛋白酶13(MMP-13)的影响。以期为预防、延缓及治疗椎间盘退行性病变提高实验依据。
1 材料与方法
1.1 材料
hNPs(sciencell公司),重组人白细胞介素1β(Interleukin-1β,IL-1β)(Peprotech公司),胰酶、胎牛血清(FBS)和DMEM/F12培养基(Gibco公司),淫羊藿苷(中国食品药品检定研究院),Dex(Sigma公司);CCK-8试剂盒、RIPA裂解液和BCA试剂盒(上海碧云天公司),硝酸纤维素膜(Bio-Rad公司),Aggrecan、MMP-13和Col2a兔抗(AbcamCambridge公司)及β-actin山羊抗兔二抗(北京博奥森生物技术有限公司),Trizol(Invitrogen公司),TaKaRaPrime-ScriptTMRT-PCRKit(TaKaRa公司),PCR引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 hNPs培养hNPs用含10%FBS、DMEM/F12培养基(pH7.2),置于37℃、5%二氧化碳的培养箱中孵育。观察细胞状态,待生长到80%~90%融合时用0.25%的胰蛋白酶消化传代。
1.2.2 CCK-8检测hNPs增殖取生长状态良好的hNPs,调整细胞浓度,按每孔6.5×103个/150μl密度接种至96孔培养板,边缘用无菌PBS填充,10~24h后根据不同处理因素将细胞随机分组:只含培养基组(control)、ICA作用组(ICA)、Dex作用组(Dex)、ICA与Dex作用组(ICA+Dex)。ICA作用组分别用终浓度5、10、20及40μmol/LICA处理hNPs;Dex作用组分别用终浓度0.1、0.2、0.4及0.8μmol/L Dex处理细胞;ICA与Dex作用组用ICA(终浓度10μmol/L)和Dex(终浓度0.2μmol/L)同时处理细胞。每组设5个复孔,每孔200μl,继续培养48 h加入20μl CCK-8,37℃孵育3 h,充分震荡10min后,酶标仪于450nm处测吸光值。实验重复3次,取平均值,细胞活力以control组的百分比表示。
1.2.3 ELISA检测细胞因子分泌表达水平取生长状态良好的hNPs,调整细胞浓度,按每孔2.0× 104个/100μl密度接种至24孔培养板,10~24 h后根据不同处理因素将细胞随机分为两大组:对照组(control)只加培养基,实验组(IL-1β组)加入终浓度为10 ng/m l IL-1β,其中IL-1β的浓度参考文献[17]选定。IL-1β组又根据不同药物作用分为:ICA+ IL-1β组(终浓度为10μmol/L ICA)、Dex+IL-1β组(终浓度为0.2μmol/L Dex)、ICA+Dex组(ICA终浓度10μmol/L+终浓度0.2μmol/L Dex)处理细胞。每组设4个复孔,每孔600μl,继续培养48 h收集上清液,按照ELISA试剂盒使用说明书检测IL-6及IL-8的含量。实验重复3次,取平均值。
1.2.4 Western blot检测蛋白表达水平将hNPs细胞(每孔1.5×106个/2ml)接种于6孔板,检测Aggrecan和Col2a表达的实验分组及细胞处理与1.2.2完全相同。检测MMP-13表达的实验分组及细胞处理与1.2.3完全相同。培养48 h收集各组细胞,用含RIPA裂解液裂解细胞;BCA法测定蛋白浓度并定量;SDS-PAGE电泳、转膜、封闭、抗体孵育,利用免疫反应化学发光剂上机检测蛋白的表达,以β-actin作为内参。其中一抗为Aggrecan(1∶200)、Col2a(1∶500)和MMP-13(1∶500)兔抗抗体(1∶200);二抗为β-actin辣根过氧化物酶标记的山羊抗兔抗体(1∶1500)。
1.2.5 RT-PCR检测mRNA表达水平将hNPs(每孔1.3×106个/2ml)接种于6孔板,实验分组及细胞处理与1.2.4相同。收集到的细胞用Trizol法提取各组细胞的总RNA,紫外分光光度计检测提取RNA浓度并纯度;将调整至同一浓度的各组总RNA按照TaKaRa逆转录试剂盒合成cDNA;然后以cDNA为模板,以β-actin为内参,进行基因片段的扩增,PCR引物见表1。用TaKaRa PrimeScriptTMRT-PCR Kit试剂盒采用两步法RT-PCR检测。反应条件:94℃,5min;36个循环(95℃,30 s;60℃,35 s;72℃,50 s);72℃,终延伸10min。实验重复3次。根据2-ΔΔCT方法计算基因相对表达水平。
1.3 统计学方法
采用SPSS16.0统计学软件进行数据处理,数据采用均数±标准方差(±s)表示,采用单因素方差分析和LSD-t检验,P<0.05表示差异有统计学意义。

表1 实时定量PCR引物
2 结果
2.1 人髓核细胞
倒置显微镜下观察hNPs多呈短梭形,胞浆均匀,边界清楚。其增殖速度适中,贴壁生长较好(见图1)。
2.2 ICA和Dex联合用药对hNPs增殖的影响
CCK-8检测ICA与Dex单独及联合用药对hNPs增殖的影响,结果显示:与Control组比较,低浓度的ICA和Dex单独作用均提高hNPs存活率,但差异没有统计学意义(P>0.05)(图2A、B)。为了检测ICA和Dex联合作用对hNPs增殖的影响,选取2者促增殖效果最大时对应的药物浓度,观察2者联合作用对hNPs增殖的影响,结果发现,10μmol/L ICA和0.2μmol/LDex联合用药时hNPs的存活率高于单独用药时存活率(与ICA组比较:P=0.024;与Dex组比较:P=0.032)(图2C)。
2.3 ICA和Dex联合用药对hNPs表达Aggrecan和Col2a的影响

图1 hNPs(×100)
Western blot及RT-PCR检测结果显示,与control组比较,ICA和Dex单独作用促进Aggrecan和Col2a的mRNA及蛋白表达,差异有统计学意义(ICA组mRNA:PAggrecan=0.029,PCol2a=0.023;蛋白:PAggrecan=0.038,PCol2a=0.039;Dex组mRNA:PAggrecan=0.024,PCol2a=0.027;蛋白:PAggrecan=0.034,PCol2a=0.017);而ICA和Dex联合用药组高于单独用药组,差异具有统计学意义(与ICA组比较mRNA:PAggrecan=0.01,PCol2a=0.001;蛋白:PAggrecan=0.011,PCol2a=0.006;与Dex组比较mRNA:PAggrecan=0.03,PCol2a=0.024;蛋白:PAggrecan= 0.029,PCol2a=0.025)。见图3。
2.4 ICA和Dex联合用药对IL-1β诱导hNPs炎症介质IL-6及IL-8的影响
ELISA检测结果显示,IL-6和IL-8在IL-1β组中的表达水平高于control组(PIL-6=0.003,PIL-8= 0.001);其在ICA组、Dex组及ICA和Dex联合用药组的表达水平低于IL-1β组(ICA组:PIL-6=0.047,PIL-8=0.016;Dex组:PIL-6=0.019,PIL-8=0.015;ICA+Dex组:PIL-6=0.006,PIL-8=0.002);而ICA和Dex联合用药组低于单独用药组,差异具有统计学意义(与ICA组比较:PIL-6=007,PIL-8=0.003;与Dex组比较:PIL-6=0.005,PIL-8=0.004)。见图4。
2.5 ICA和Dex联合用药对IL-1β诱导hNPs表达MMP-13的影响
Western blot及RT-PCR检测结果显示,MMP-13在IL-1β组中的表达水平高于control组,差异具有统计学意义(mRNA:P=0.005;蛋白:P=0.005);ICA和Dex单独或联合作用后IL-1β的表达水平低于IL-1β组(ICA组mRNA:P=0.037;蛋白:P= 0.035;Dex组mRNA:P=0.011;蛋白:P=0.013;ICA+ Dex组mRNA:P=0.004.;蛋白:P=0.005);同时ICA和Dex联合用药组低于单独用药组,差异具有统计学意义(与ICA组比较mRNA:P=0.005;蛋白:P=0.000;与Dex组比较mRNA:P=0.006;蛋白:P= 0.006)。见图5。

图2 CCK-8法检测ICA和Dex联合用药对hNPs增殖的影响

图3 ICA和Dex联合用药对hNPs表达Aggrecan和Col2a的影响

图4 ICA和Dex联合用药对IL-1β诱导hNPs炎症介质IL-6及IL-8的影响
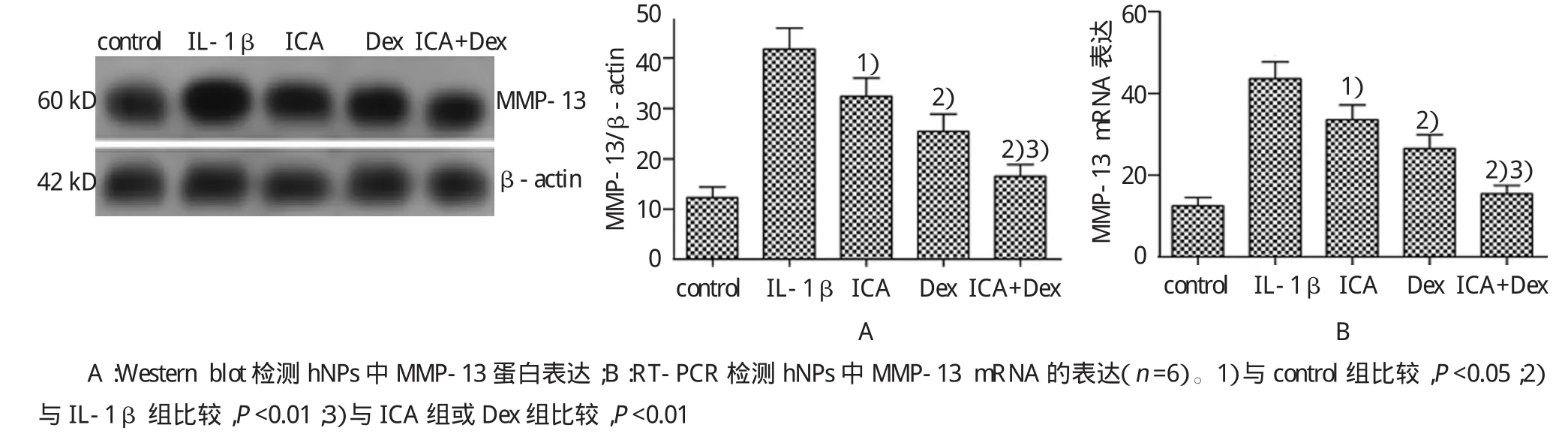
图5 ICA和Dex联合用药对IL-1β诱导hNPs表达MMP-13的影响
3 讨论
椎间盘退行性病变是一种慢性病变。当退行性病变发生时,椎间盘的成分、结构、功能渐进性被破坏,导致椎间盘高度和脊柱的稳定性改变,进而影响椎间盘生物力学功能,加重小关节和其他结构负担[6]。近年来,通过药物治疗、物理疗法、针灸、推拿、生物治疗等手段及时干预退行性病变的诸多环节,维持髓核细胞数量、功能并改善其生存微环境,为扭转和修复椎间盘退行性病变带来新希望[7]。
髓核细胞是椎间盘的主要细胞之一,是椎间盘功能的主要执行者。髓核细胞数量的减少以及细胞外基质的丢失进而导致椎间盘发生退行性病变。文献报道[8],退行性病变椎间盘中髓核细胞凋亡率[(61.3±24.5)%]比正常椎间盘中髓核细胞凋亡率[(15.5±6.8)%]高出很多;也有研究显示[9],Dex可促进髓核细胞增殖,本研究通过CCK-8法也发现了相同的现象。另外,本研究首次发现ICA也可以促进髓核细胞增殖。但是Dex和ICA单独作用,增殖不显著,于是本研究将2者联合处理髓核细胞,发现可以促进增殖。文献报道,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路与髓核细胞增殖有关[10]。同时,ICA促细胞增殖作用也与MAPK信号通路有关[11],推测2者促髓核细胞增殖的分子机制也与MAPK信号通路有关。髓核细胞作为椎间盘组织工程的种子细胞,其保持和再植可延缓椎间盘退行性病变[12],因此,可以考虑采用Dex和ICA 2者联合作用来治疗椎间盘退行性病变。
Aggrecan和Col2a是椎间盘基质内最主要的蛋白基质,主要由髓核细胞分泌表达。基质内的Aggrecan大量结合透明质酸形成富含负电荷、具有弹性和亲水性的聚合体。当椎间盘发生退行性病变时,整个椎间盘的含水量下降,Aggrecan含量减少,同时伴有Col1a的增多,Col2a的减少。有学者发现[4],ICA促进腰椎间盘退行性病变的大鼠模型中Col2amRNA表达,同时Dex可以上调兔髓核细胞中Aggrecan、Col2a的表达[13]。但是,2者在hNPs中的作用没有研究报道,本研究发现,Dex和ICA单独作用可促进hNPs Aggrecan和Col2a表达,2者联合作用效果更显著,提示Dex和ICA联合作用将更加有效地改善椎间盘退行性病变。
炎症因子在椎间盘退行性病变中发挥着重要的作用[14-17]。研究显示,突出腰椎间盘组织培养液中IL-6含量远远高于正常椎间盘组织中的IL-6含量[18],和IL-6一样,IL-8也参与椎间盘组织的退行性病变[19];另外,白藜芦醇能够抑制退行性病变椎间盘组织中IL-6和IL-8的异常表达,对阻止颈椎间盘退行性病变具有良好作用[20]。文献报道[21],ICA和Dex都可抑制炎症因子IL-6和IL-8的释放。但是,2者在髓核细胞中的作用没有报道,本研究发现,ICA和Dex也可抑制IL-1β诱导hNPs炎症因子IL-6和IL-8的表达,提示其对椎间盘退行性病变有改善作用。
MMPs是一类具有锌离子、钙离子活性的蛋白水解酶家族。其中,MMP-1、8主要降解Ⅲ型胶原和Ⅰ型胶原,MMP-13是Ⅱ型胶原降解酶。MMPs在椎间盘内的表达受到多种因素的调节,其中白细胞介素1(Interleukin-1,IL-1)、IL-6及前列腺素E2(Prostaglandin E2,PGE2)等炎症因子可以促进其合成[22-23]。有学者报道,IL-6影响MMP-13/基质金属蛋白酶抑制剂-1(tissue inhibitor ofmetalloproteinase-1,TIMP-1)的平衡,从而参与椎间盘退行性病变过程[24]。研究发现ICA可降低IL-1β诱导的人软骨肉瘤细胞MMP-13表达[25],Dex也可降低MMP-13表达[26]。但是2者以及联合在hNPs中的作用未见报道,本研究发现2者联合对IL-1β诱导的hNPs表达MMP-13降低更加明显,提示ICA和Dex联合作用可能通过抑制炎症因子降低MMP-13活性,减缓基质的降解,进而改善椎间盘退行性病变。
综上所述,ICA和Dex联合作用可促进hNPs增殖,同时增加Aggrecan和Col2a、mRNA水平的表达。此外,抑制IL-1β诱导的hNPs炎症介质IL-6、IL-8的分泌表达,降低MMP-13蛋白质、mRNA水平。这些结果均提示ICA和Dex联合作用对改善椎间盘退行性病变有显著的效果,然而,其在退行性病变的髓核细胞以及退行性病变椎间盘的动物模型中的研究以及分子机制的探讨有待深入研究,以期为改善椎间盘退行性病变提供直接的证据,这也是进一步研究的方向。
[1]许敬人,詹红生.椎间盘退变机制及中药对其的干预作用[J].临床和实验医学杂志,2015,14(19):1657-1660.
[2]陈金栋,彭宝淦,高春华,等.炎症与腰椎间盘退变[J].颈腰痛杂志,2010,31(6):460-462.
[3]TOHDA C,NAGATA A.Epimedium koreanum extractand its constituent icariin improve motor dysfunction in spinal cord injury[J]. Evid Based Complement Alternat Med,2012,2012:731208.
[4]赵飞,王其友.淫羊藿苷对大鼠腰椎间盘退变影响的实验研究[J].辽宁中医药大学学报,2015,17(10):36-38.
[5]MASLANKA T,JAROSZEWSKI J J.In vitro studies on the influence of dexamethasone and meloxicam on bovineWC1+gammadelta T cells[J].Vet Immunol Immunopathol,2013,151(3/4):248-262.
[6]BOXBERGER J I,AUERBACH J D,SEN S,et al.An in vivo model of reduced nucleus pulposus glycosaminoglycan content in the rat lumbar intervertebral disc[J].Spine(Phila Pa 1976),2008, 33(2):146-154.
[7]王锋,王运涛,吴小涛.髓核细胞修复椎间盘退行性变的研究进展[J].中国修复重建外科杂志,2009,23(7):864-867.
[8]KOHYAMA K,SAURA R,DOITA M,et al.Intervertebral disc cell apoptosis by nitric oxide:biological understanding of intervertebral disc degeneration[J].Kobe J Med Sci,2000,46(6): 283-295.
[9]ABBOTT R D,PURMESSUR D,MONSEY R D,et al.Degenerative grade affects the responses of human nucleus pulposus cells to link-N,CTGF,and TGFbeta3[J].J Spinal Disord Tech,2013, 26(3):E86-94.
[10]邹隆强,梁伟国.MAKP信号传导通路在髓核细胞研究进展[J].中国矫形外科杂志,2012,20(21):1963-1965.
[11]陈洋,黄建华,宁友,等.淫羊藿苷药理作用的分子机制研究进展[J].中西医结合杂志,2011,11(9):1179-1183.
[12]袁维,王会仁,董健.腰椎间盘髓核组织工程研究进展[J].中国脊柱脊髓杂志,2011,21(2):154-158.
[13]周小锐,刘世清,贺斌,等.地塞米松可影响兔髓核细胞增殖及Ⅱ型胶原的表达[J].中国组织工程研究,2012,16(11):1915-1918.
[14]LEE J M,SONG J Y,BAEK M,et al.Interleukin-1beta induces angiogenesis and innervation in human intervertebral disc degeneration[J].J Orthop Res,2011,29(2):265-269.
[15]LIW,LIU T,WU L,et al.Blocking the function of inflammatory cytokines and mediators by using IL-10 and TGF-beta:a potential biological immunotherapy for intervertebral disc degeneration in a beagle model[J].Int JMol Sci,2014,15(10):17270-17283.
[16]LIANG Q Q,ZHANG M,ZHOU Q,et al.Muscone protects vertebral end-plate degeneration by antiinflammatory property[J]. Clin Orthop Relat Res,2010,468(6):1600-1610.
[17]STUDER R K,VO N,SOWA G,et al.Human nucleus pulposus cells react to IL-6:independent actions and amplification of response to IL-1 and TNF-alpha[J].Spine(Phila Pa 1976), 2011,36(8):593-599.
[18]AL-OBAIDI S,MAHMOUD F.Immune responses following McKenzie lumbar spine exercise in individuals with acute low back pain:a p reliminary study[J].Acta Med Acad,2014,43 (1):19-29.
[19]HOLM S,MACKIEWICZ Z,HOLM A K,et al.Pro-inflammatory,pleiotropic,and anti-inflammatory TNF-alpha,IL-6,and IL-10 in experimental porcine intervertebral disk degeneration[J]. Vet Pathol,2009,46(6):1292-1300.
[20]欧斌,曹奇,陈亮元,等.白藜芦醇对椎间盘髓核细胞产生IL-6和IL-8的影响[J].中外医疗2013(24):57-58.
[21]陈昊,乔周旻,周超.小剂量地塞米松对脓毒症大鼠金属基质蛋白酶9等炎症因子的影响[J].药理与毒理,2013,10(23):106-108.
[22]WEI Y,ZHI-HONG W,GUI-XING Q,et al.Extracellular signal-regulated kinase inhibition modulates rat annulus fibrosus cell response to interleukin-1[J].Spine(Phila Pa 1976),2013, 38(17):1075-1081.
[23]KOTHARI P,PESTANA R,MESRAOUA R,et al.IL-6-mediated induction of matrix metalloproteinase-9 is modulated by JAK-dependent IL-10 expression in macrophages[J].J Immunol, 2014,192(1):349-357.
[24]AIDA Y,HONDA K,TANIGAWA S,et al.IL-6 and soluble IL-6 receptor stimulate the production of MMPs and their inhibitors via JAK-STAT and ERK-MAPK signalling in human chondrocytes[J].Cell Biol Int,2012,36(4):367-376.
[25]ZENG L,WANG W,RONG X F,et al.Chondroprotective effects and multi-target mechanisms of Icariin in IL-1 beta-induced human SW 1353 chondrosarcoma cells and a rat osteoarthritis model[J].Int Immunopharmacol,2014,18(1):175-181.
[26]SENDZIK J,SHAKIBAEI M,SCHAFER-KORTING M,et al. Synergistic effects of dexamethasone and quinolones on human-derived tendon cells[J].Int J Antimicrob Agents,2010,35 (4):366-374.
(张西倩编辑)
Effect of icariin in combination w ith Dexamethasone on cell proliferation and secretion expression of human nucleus pulposus cells
Zhong-kai Feng,Yong-qiang Sun,Ru-yin Liu,Zong-jin Yue,Xin-liWang
(Department of Orthopedics,Rachiopathy Ward,Henan Province Hospital of TCM,The Second Affiliated Hospital of Henan University of Traditional Chinese Medicine,Zhengzhou,Henan 450002,China)
ObjectiveTo investigate the effect of icariin(ICA)in combination with Dexamethasone(Dex)on cell proliferation and secretion expression of Aggrecan,typeⅡcollagen(Col2a),IL-6,IL-8 and MatrixMetalloproteinase-13(MMP-13)in human nucleus pulposus cells(hNPs).MethodsThe experimentwas divided into different groups based on different treatments:control group(only culturemedium),ICA group(20μM/L ICA),Dex group(0.2μM/L Dex),ICA+Dex group(20μM/L ICA+0.2μM/L Dex),IL-1βgroup(10 ng/mL IL-1β),ICA+IL-1βgroup(20 μM/L ICA+10 ng/mL IL-1β),Dex+IL-1βgroup(0.2μM/L Dex+10 ng/mL IL-1β),ICA+Dex+IL-1βgroup (20μM/L ICA+0.2μM/LDex+10 ng/mL IL-1β).Each group was treated for 48 h.Cell proliferation was detectedby CCK-8 assay.The expression levels of Aggrecan,Col2a,IL-6,IL-8 and MMP-13 were examined by Western blotting,RT-PCR and ELISA methods.ResultsICA(20μM/L)or Dex(≤0.2μM/L)at low concentrations promoted hNPs proliferation,but there was no significant difference when compared with the control group(P>0.05). However,20μM/L ICA in combination with 0.2μM/L Dex significantly increased the cell survival rate of hNPs when compared with the control group,the ICA and teh Dex single treatment group(P<0.05).The protein and mRNA expression of Aggrecan and Col2a in hNPs were also markedly increased by ICA in combination with Dex when compared with the control group,the ICA and the Dex single treatment group(P<0.05).In addition,the secretion expression of IL-6,IL-8 and MMP-13 in IL-1β-induced hNPs were significantly inhibited by ICA in combination with Dex when compared with IL-1β,ICA+IL-1βor Dex+IL-1βgroups(P<0.05).ConclusionsThese findings suggest that icariin in combination with Dexamethasone significantly promotes cell proliferation and the expression of Aggrecan and Col2a in hNPs,and inhibites the secretion expression of IL-6,IL-8 and MMP-13 in IL-1β-induced hNPs,providing a preliminary experimental basis for drug treatment of intervertebral disc degeneration.
icariin;Dexamethasone;hNPs;aggrecan;Col2a;intervertebral disc degeneration
R285.5
A
10.3969/j.issn.1005-8982.2016.24.003
1005-8982(2016)24-0011-07
2016-04-11

