华北地区圈养大熊猫粪便中产纤维素酶芽孢杆菌菌株的分离与鉴定
武红敏,郭威,郭晓军,周贤,朱宝成
(河北农业大学 生命科学学院,河北 保定 071001)
华北地区圈养大熊猫粪便中产纤维素酶芽孢杆菌菌株的分离与鉴定
武红敏,郭威,郭晓军,周贤,朱宝成
(河北农业大学 生命科学学院,河北 保定 071001)
为分离筛选大熊猫肠道中具有纤维素降解能力的芽孢杆菌菌株,首先对8份大熊猫粪便进行高温水浴处理,利用刚果红平板法进行初筛和复筛,DNS法测定酶活力.结果分离出126株菌株,其中8株菌株纤维素降解能力较强.结合形态特征、生理生化特征和16S rDNA序列分析,鉴定8个菌株均属于芽孢杆菌属,其中1株枯草芽孢杆菌(Bacillussubtilis),1株阿萨尔基芽孢杆菌(B.axarquienis),2株西姆芽孢杆菌(B.siamensis),4株甲基营养型芽孢杆菌(B.methylotrophicus).实验表明大熊猫肠道中存在多种降解纤维素的芽孢杆菌,其中新发现的有大熊猫源的阿萨尔基芽孢杆菌和西姆芽孢杆菌,丰富了大熊猫肠道菌群的研究,并为高效生产纤维素酶提供新的菌种来源.探究了大熊猫消化道内高效的纤维素降解菌,有利于实现高纤维类饲料资源化利用.
大熊猫;粪便;芽孢杆菌;纤维素酶
大熊猫是食肉目动物中罕见的素食者,以采食箭竹为主.大熊猫除能消化吸收竹子中的大部分蛋白质等营养物质外,也可以有效利用纤维素、半纤维素[1].但是在大熊猫基因组序列中并没有发现编码纤维素酶的相关基因[2],因此,认为大熊猫消化纤维素是依赖其肠道微生物的作用[3].谭志等[4]、鲁海峰等[5]、马清义等[6]分别研究了野外放归和圈养大熊猫肠道菌群的种类、数量、分布及群落结构.马海玲[7]从大熊猫粪便中分离得到13株纤维素分解菌,其中8株为真菌,5株为放线菌.王海娟等[3]研究推测了大熊猫肠道菌群消化竹纤维的过程.开展大熊猫肠道消化纤维素菌群组成和功能研究是十分必要的[8].
目前,对纤维素酶菌株已有深入研究,生产纤维素酶多使用真菌作为生产菌株;而以功能菌株来达到降解纤维素的目的时,则以细菌为优,即由过去以真菌为生产菌转到以细菌为生产主体[9].从菌剂的角度来讲,芽孢杆菌稳定性和环境适应性好、产酶活性高,可以得到比较稳定的菌剂,便于农牧业上的应用[10].目前所选育出来的芽孢杆菌菌株中高效产酶的菌种还不多,故仍然需要寻找新的产纤维素酶菌株或进一步选育高产菌株[11].因此大熊猫肠道纤维分解菌的研究具有潜在的应用价值.
本实验拟从健康的大熊猫新鲜粪便中分离筛选纤维素降解芽孢杆菌菌株,并对其进行种属鉴定,为纤维素降解提供新的菌种来源.
1 材料与方法
1.1 样品及来源
大熊猫新鲜粪样8份,于2014年10月份采自石家庄动物园健康的大熊猫.
1.2 培养基
NA培养基、NB种子培养基、富集培养基[12]、菌种筛选培养基[13](CMC-Na培养基、刚果红培养基)、发酵产酶培养基[14]、生理生化鉴定培养基(依据文献[15]的方法配制),所有培养基经121 ℃灭菌15 min.
1.3 实验方法
1.3.1 纤维素降解菌的筛选
取样:将新鲜的大熊猫粪便装入无菌自封袋中,将装有样品的自封袋冷藏.
富集培养:将8份大熊猫粪便样品混匀,取混合后的粪样5 g于盛有50 mL灭菌生理盐水的三角瓶中,摇床震荡20 min,80 ℃水浴20 min灭活菌体.取水浴后的10 mL粪样混悬液接种于100 mL富集培养基中,37 ℃,180 r/min摇床富集培养24 h.
细菌菌株的分离:将富集培养后的菌液进行梯度稀释,分别取稀释度为10-4、10-5、10-6的菌液100 μL涂布于刚果红平板上,37 ℃恒温培养箱中倒置培养24 h.挑取不同菌落形态的单个菌落,镜检,取G+菌株连续3次划线接种NA平板,将单菌落接种于NA斜面,保存于4 ℃冰箱.
纤维素降解菌的初筛:将分离纯化后的菌株点接到刚果红培养基,于37 ℃恒温培养箱中倒置培养48 h.观察是否出现透明圈.
纤维素降解菌的复筛:将初筛得到的菌株接种于NB培养基中,37 ℃,180 r/min 摇床培养12 h,然后将种子液按6%的接种量接种到发酵产酶培养基中,37 ℃,180 r/min 摇床培养48 h.将发酵液3 000 r/min离心10 min,取离心后的上清液60 μL注入CMC-Na平板孔内,37 ℃培养,24 h后滴加2 mg/mL刚果红染色液,染色30 min后,再用蒸馏水和1 mol/L NaCl洗去染液,分别记录透明圈直径.
纤维素酶活力的测定:发酵上清液即为粗酶液,参照文献[16]进行葡萄糖标准曲线的绘制以及酶活力的测定.
酶活力定义:1 mL粗酶液每分钟催化羧甲基纤维素钠生成1 μmol 还原糖所需的酶量定义为1个酶活力单位U.
1.3.2 菌株鉴定
根据菌株的菌落和菌体形态特征、生理生化特性实验及16S rDNA序列分析进行菌株的种属鉴定,具体方法参照文献[15]、文献[17].
菌株形态鉴定:参照文献[17]进行.
菌株的生理生化鉴定:参照文献[15]进行.
16S rDNA序列分析鉴定:参考 Kim等[18]和Rainey等[19]的方法提取细菌总DNA,采用细菌 16S rDNA 的通用引物进行PCR.产物纯化后送北京宝锐通生物科技有限公司测序.将所测得的16S rDNA序列结果提交到GenBank中进行BLAST比对,选取相似性较高的序列,利用Mega 5软件构建系统发育树[20].将8株菌株的16S rDNA基因提交到NCBI数据库.
2 结果与分析
2.1 菌株的筛选
2.1.1 纤维素降解菌株的初筛
将富集样品经热处理后,由刚果红平板筛选得到126株具有降解纤维素能力的菌株.
2.1.2 纤维素降解菌株的复筛
对初筛得到的126株菌株进行复筛,得到76株降解纤维素能力较高的菌株,部分菌株的透明圈大小见图1、表1.

图1 打孔法复筛结果Fig.1 Results of stiletto method rescreening
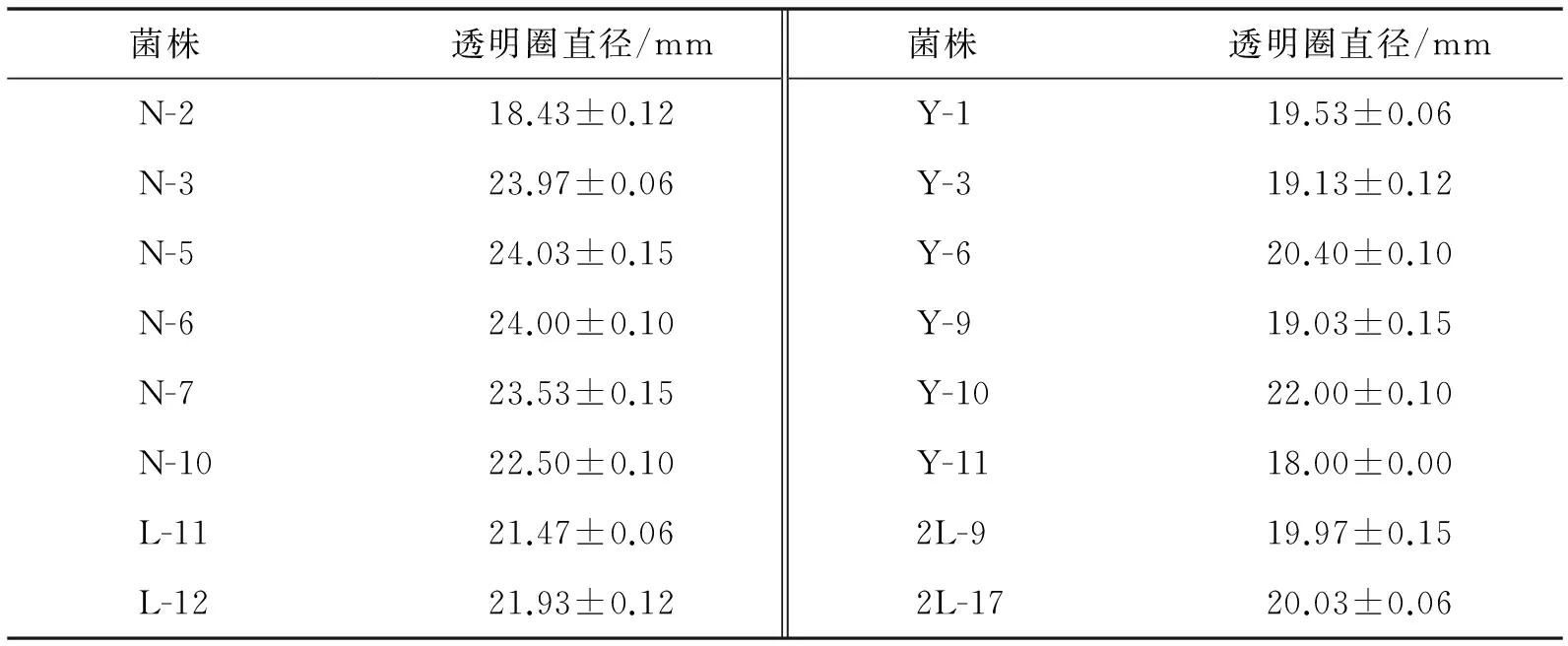
菌株 透明圈直径/mm菌株 透明圈直径/mmN-218.43±0.12Y-119.53±0.06N-323.97±0.06Y-319.13±0.12N-524.03±0.15Y-620.40±0.10N-624.00±0.10Y-919.03±0.15N-723.53±0.15Y-1022.00±0.10N-1022.50±0.10Y-1118.00±0.00L-1121.47±0.062L-919.97±0.15L-1221.93±0.122L-1720.03±0.06
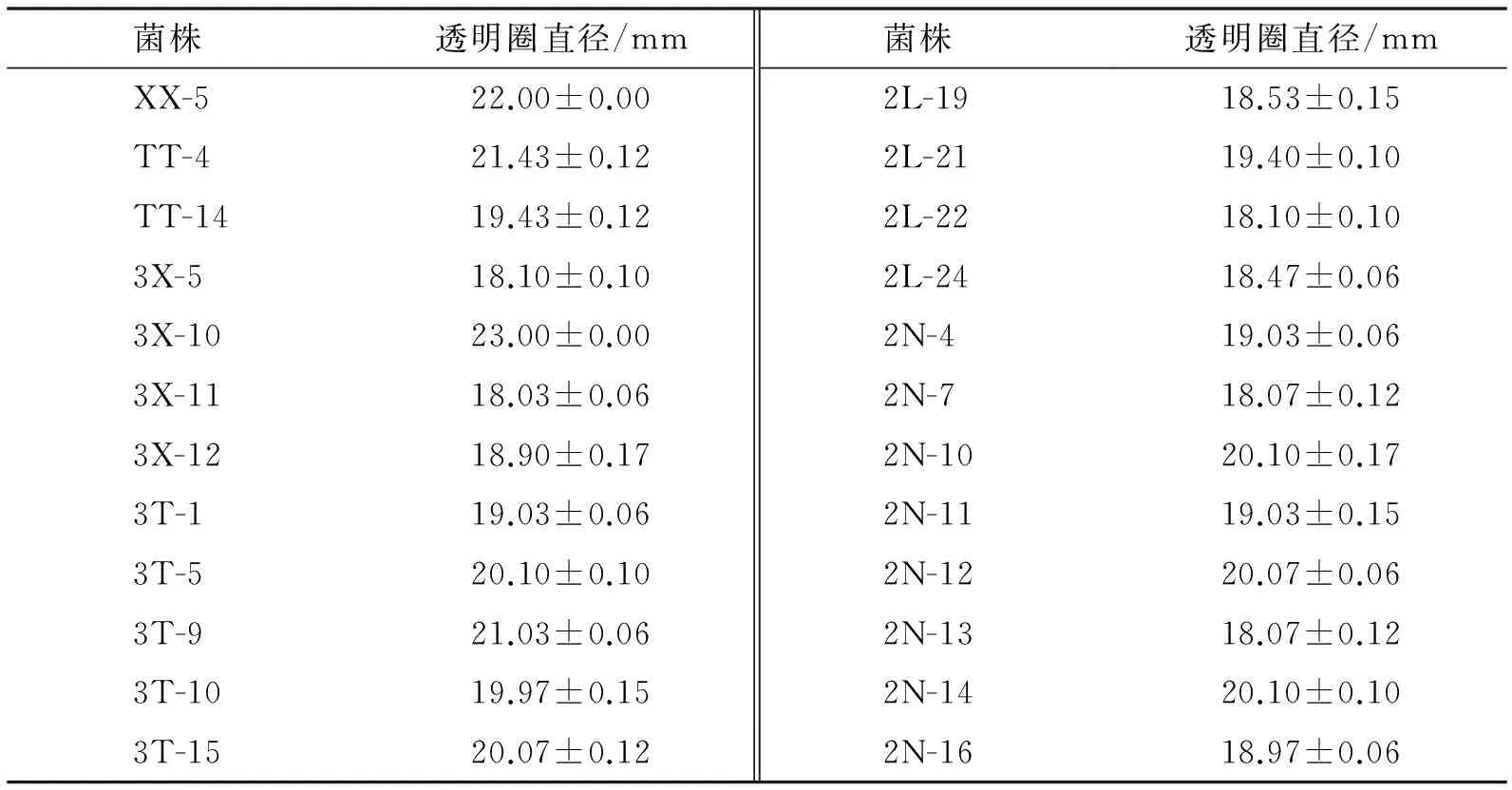
续表1
2.1.3 纤维素酶活力测定
对复筛过程中透明圈直径>18.0 mm的40株菌株进行酶活力测定,结果见表2.
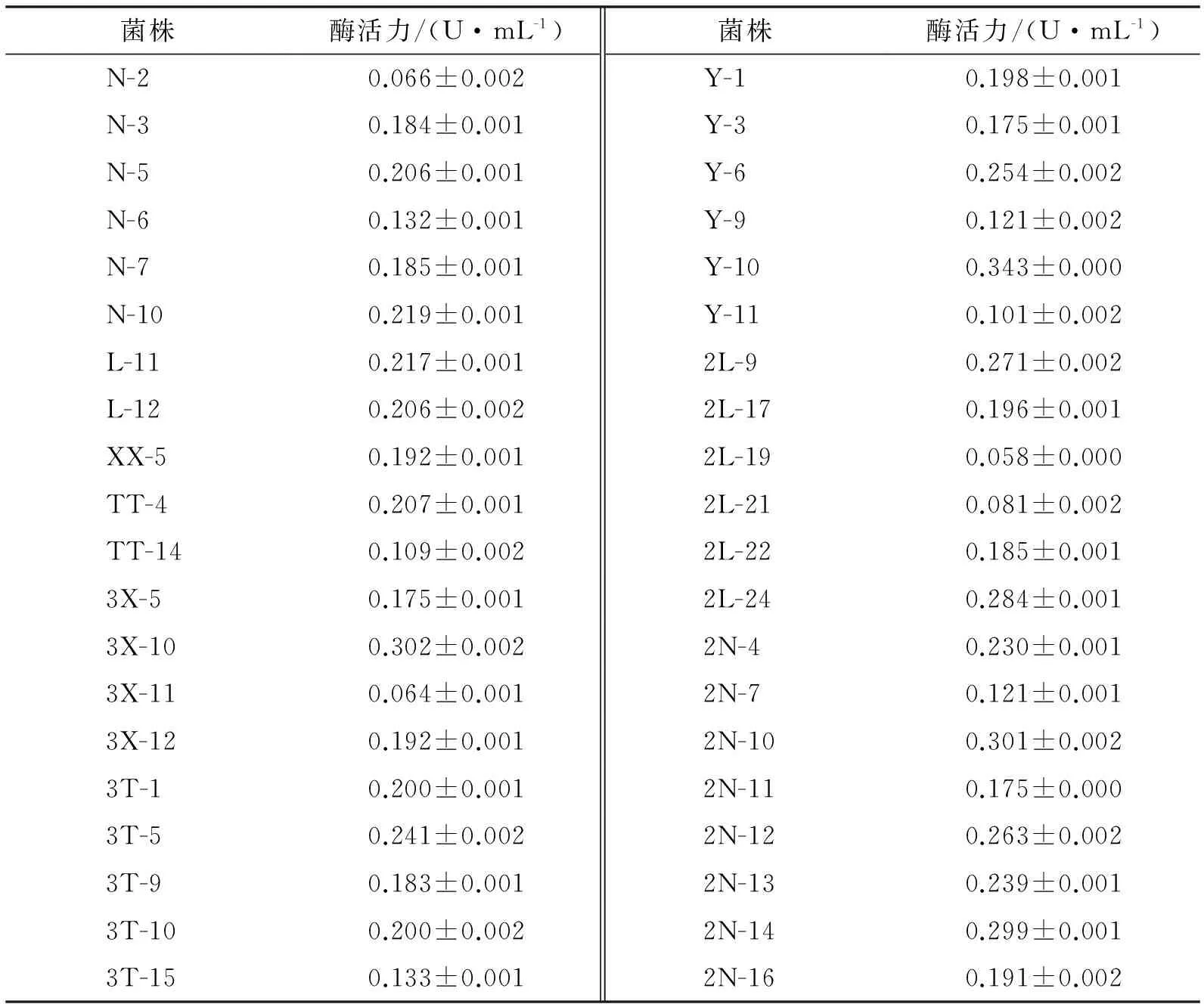
表2 发酵液中纤维素酶活力测定结果
由表2可以看出,2N-10、2N-12、2N-14、2L-9、2L-24、Y-6、Y-10和3X-10 8株菌株酶活性较高,因此,选取此8株菌株进行进一步研究.
2.2 菌株的种属鉴定
2.2.1 菌株的形态学鉴定
菌株菌落形态如图2所示,菌株菌体形态见图3,芽孢形态见图4,菌落形态特征见表3,菌体形态特征见表4.

图2 菌株菌落形态Fig.2 Colonial morphology of strains
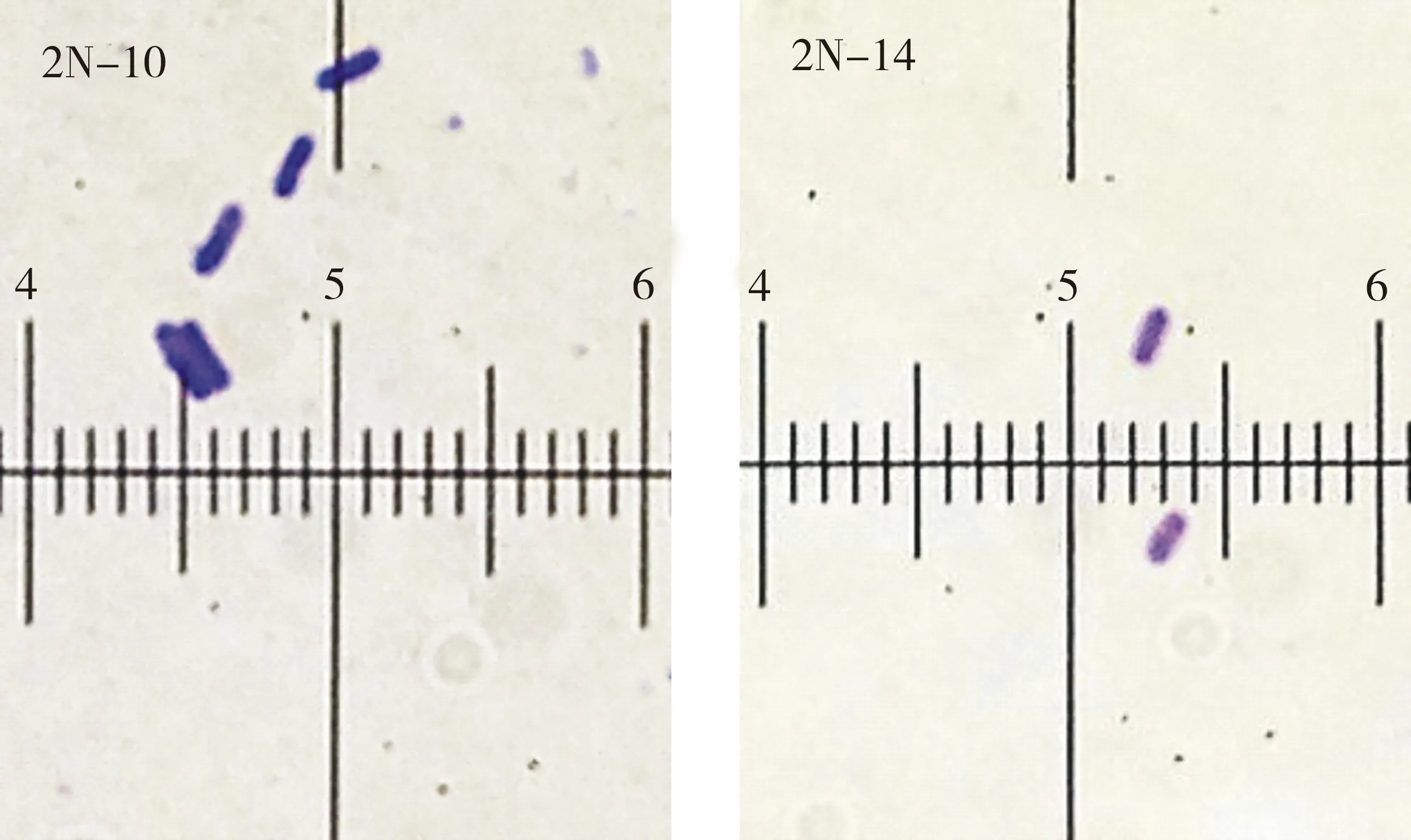
图3 菌株菌体形态Fig.3 Mycelia morphology of strains
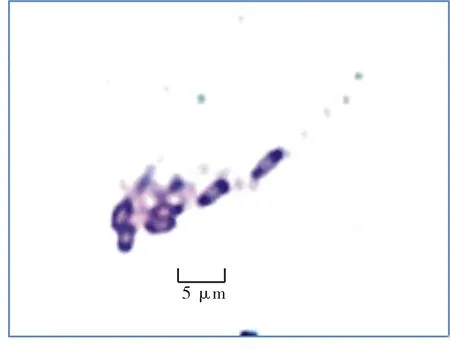
图4 芽孢形态(2N-10)Fig.4 Spore of strain 2N-10
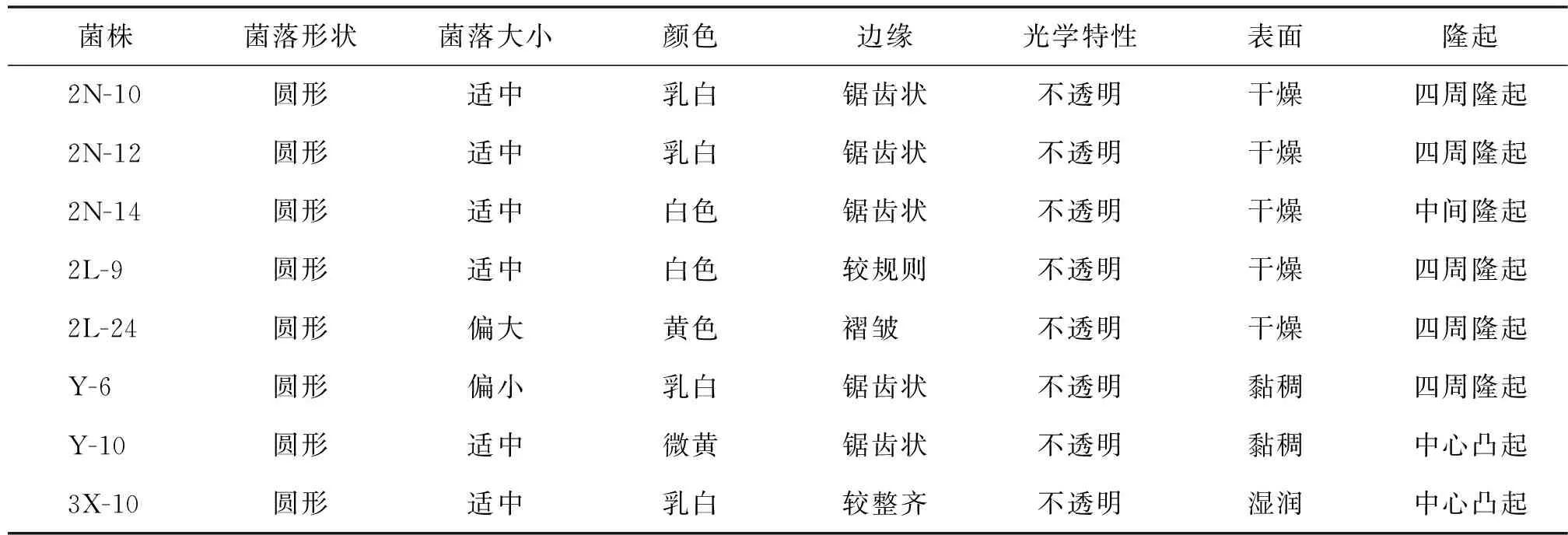
菌株菌落形状菌落大小颜色边缘光学特性表面隆起2N-10圆形适中乳白锯齿状不透明干燥四周隆起2N-12圆形适中乳白锯齿状不透明干燥四周隆起2N-14圆形适中白色锯齿状不透明干燥中间隆起2L-9圆形适中白色较规则不透明干燥四周隆起2L-24圆形偏大黄色褶皱 不透明干燥四周隆起Y-6圆形偏小乳白锯齿状不透明黏稠四周隆起Y-10圆形适中微黄锯齿状不透明黏稠中心凸起3X-10圆形适中乳白较整齐不透明湿润中心凸起
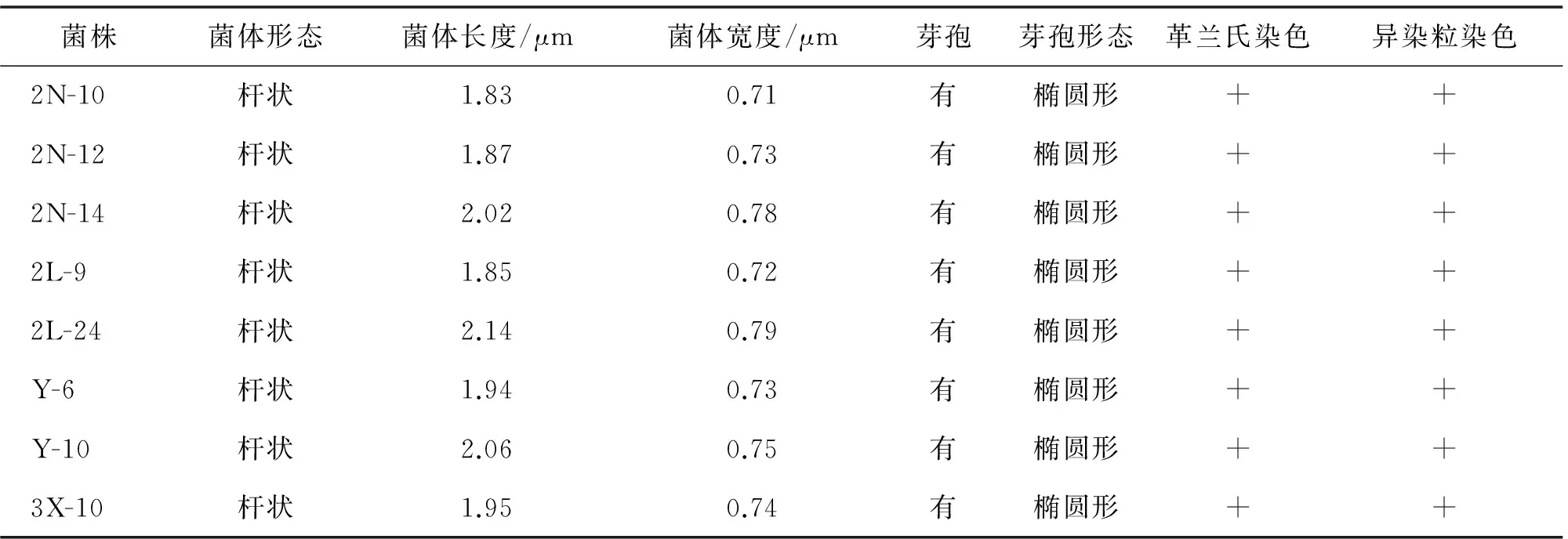
表4 菌株菌体形态特征
2.2.2 菌株的生理生化鉴定
生理生化结果见表5.菌株2N-12、Y-6和Y-10甲基红实验为阳性,其余为阴性;糖类发酵实验中,除2N-12和2N-14菌株外,其余都为阳性;丙二酸利用实验只有Y-6和Y-10菌株为阳性.其余各实验项目结果均一致.
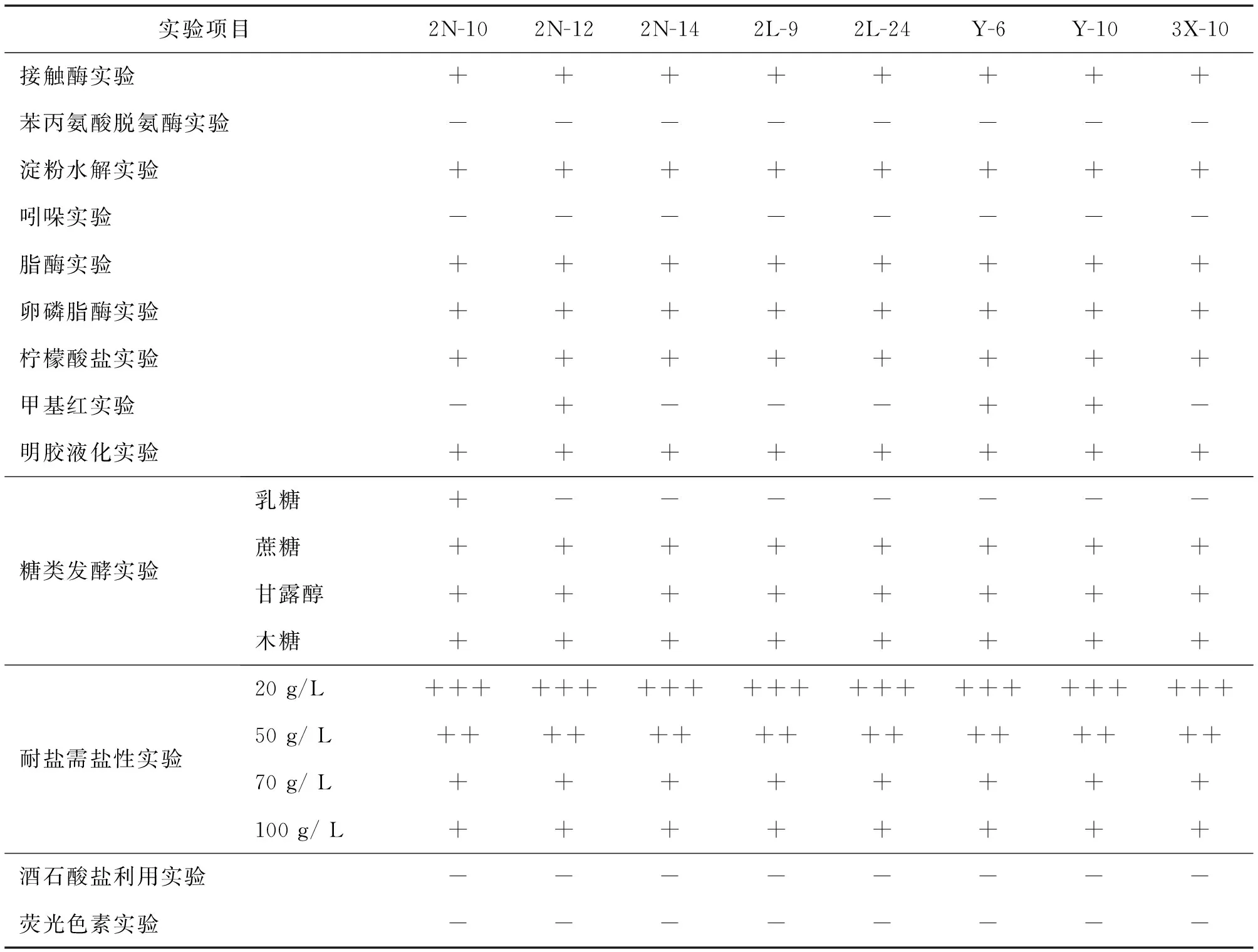
表5 菌株的生理生化特征
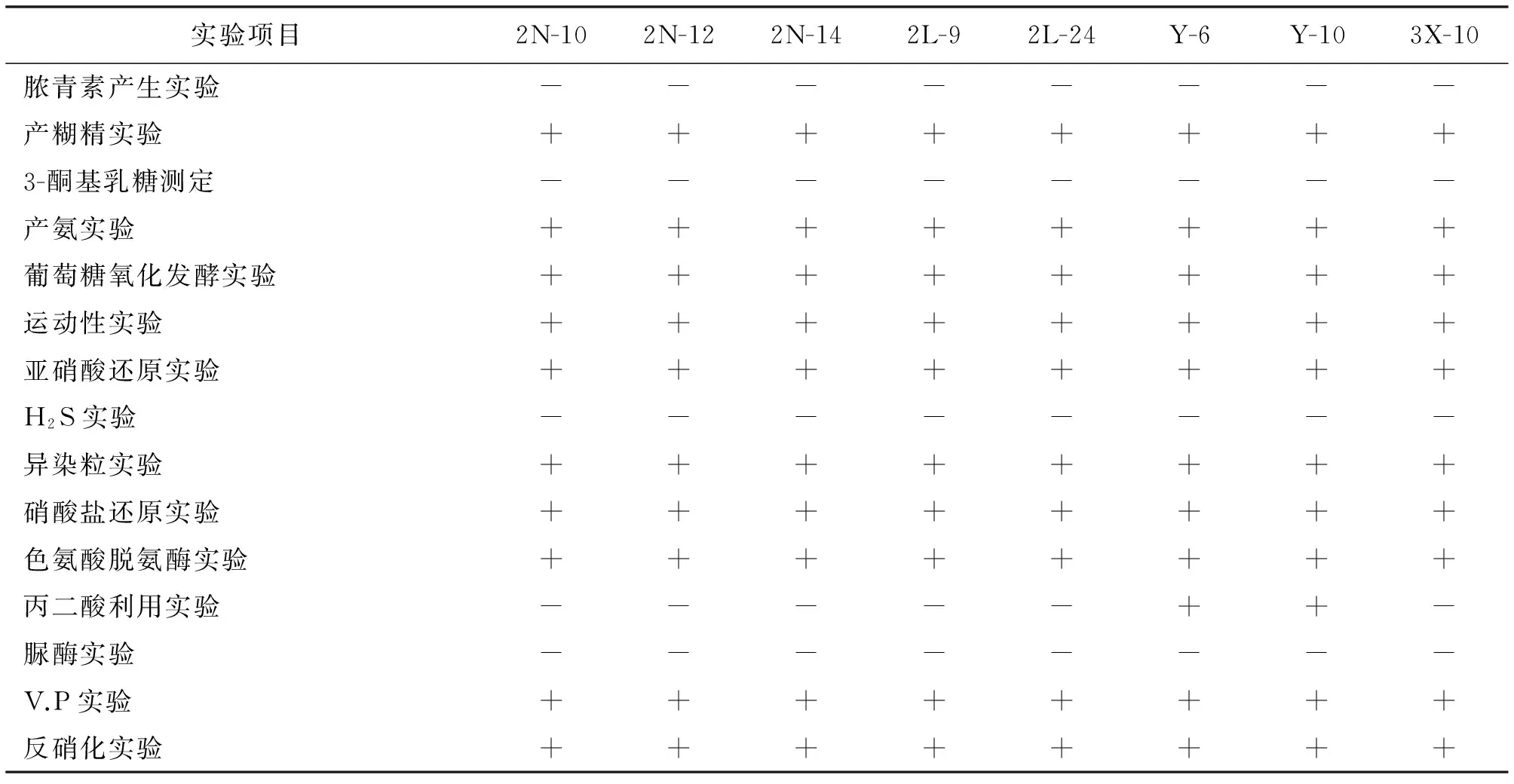
续表5
“+”表示阳性,“-”表示阴性,以加号多少表示菌株活性的强弱.
2.2.3 菌株16S rDNA的分子鉴定结果
以菌株的基因组DNA为模板,经PCR扩增后在10 g/L的琼脂糖凝胶上电泳,结果如图5.由图5可见,在约1 500 bp处有明亮的条带,与预期大小一致.测序结果表明,8株菌株的16S rDNA序列长度都在1 545~1 675 bp.
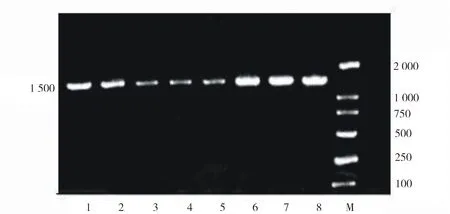
M.DNA Marker(bp)1-8.分别为2N-10、2N-12、2N-14、2L-9、2L-24、Y-6、Y-10和3X-10菌株的16S rDNA基因片段的PCR产物.图5 16S rDNA PCR扩增电泳检测Fig.5 Electrophoresis detection of 16S rDNA PCR amplification
2.2.4 基于16S rDNA序列及系统进化树分析
将测得菌株的序列提交到GenBank中进行BLAST比对,选取较高相似度的标准菌株,利用Mega5软件构建系统发育树,如图6—9.将8株菌株的16S rDNA基因提交到NCBI数据库,得到菌株序列号(KX214610~KX214617),见表6.
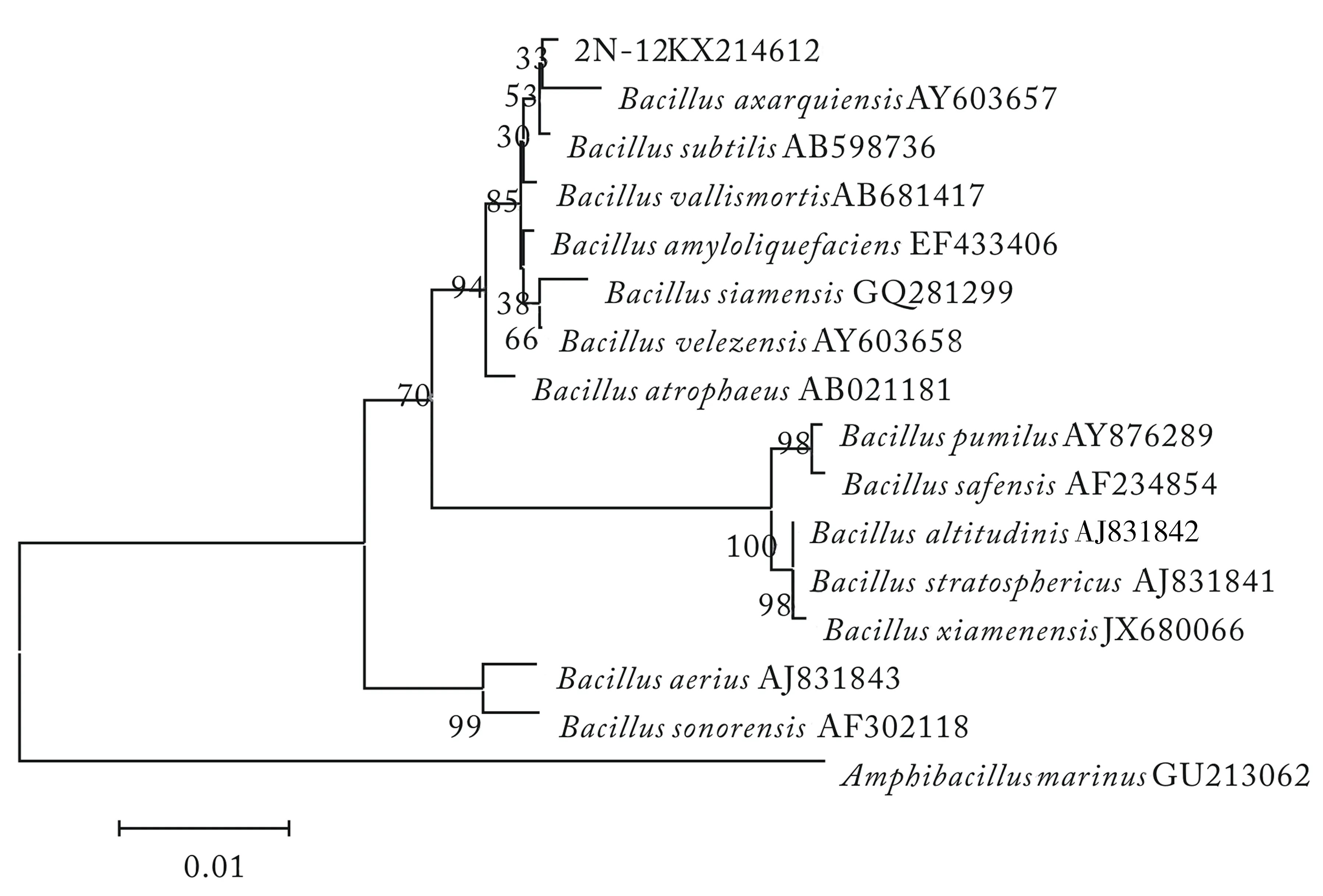
图6 2N-12菌株16S rDNA序列系统发育树结构Fig.6 Phylogenetic tree of 16S rDNA sequence of strain 2N-12
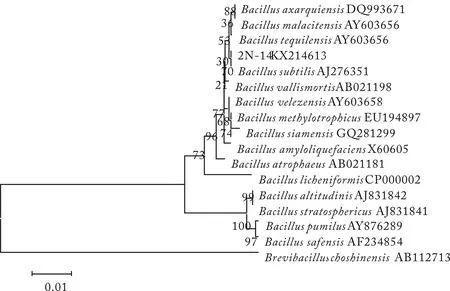
图7 2N-14菌株16S rDNA序列系统发育树结构Fig.7 Phylogenetic tree of 16S rDNA sequence of strain 2N-14
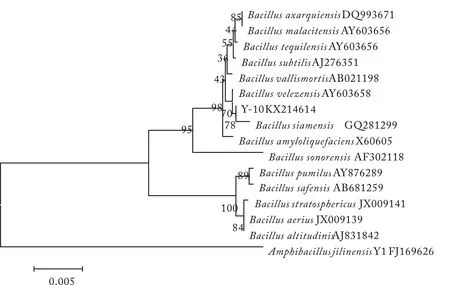
图8 Y-10菌株16S rDNA序列系统发育树结构Fig.8 Phylogenetic tree of 16S rDNA sequence of strain Y-10
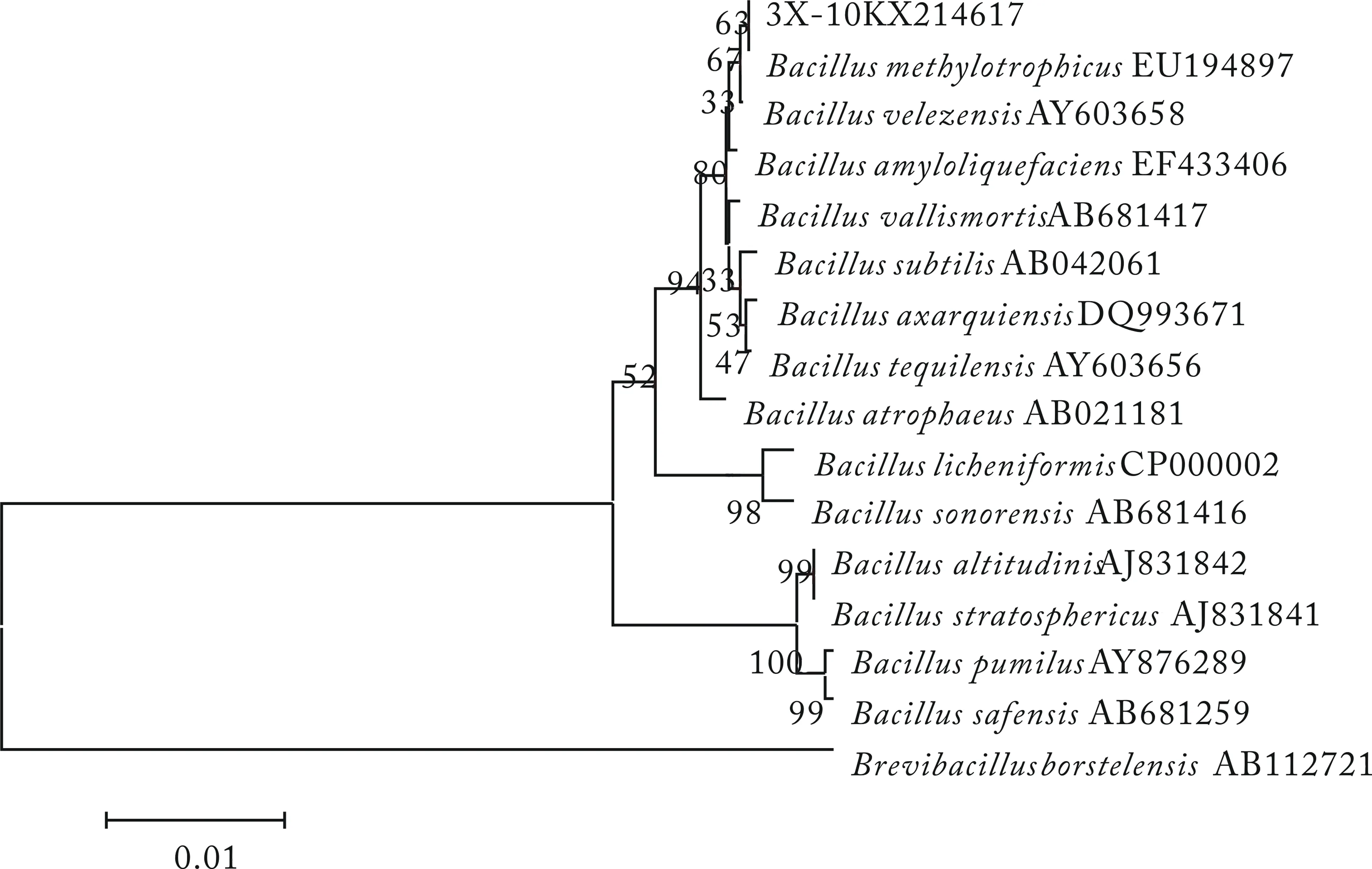
图9 3X-10菌株16S rDNA序列系统发育树结构Fig.9 Phylogenetic tree of 16S rDNA sequence of strain 3X-10
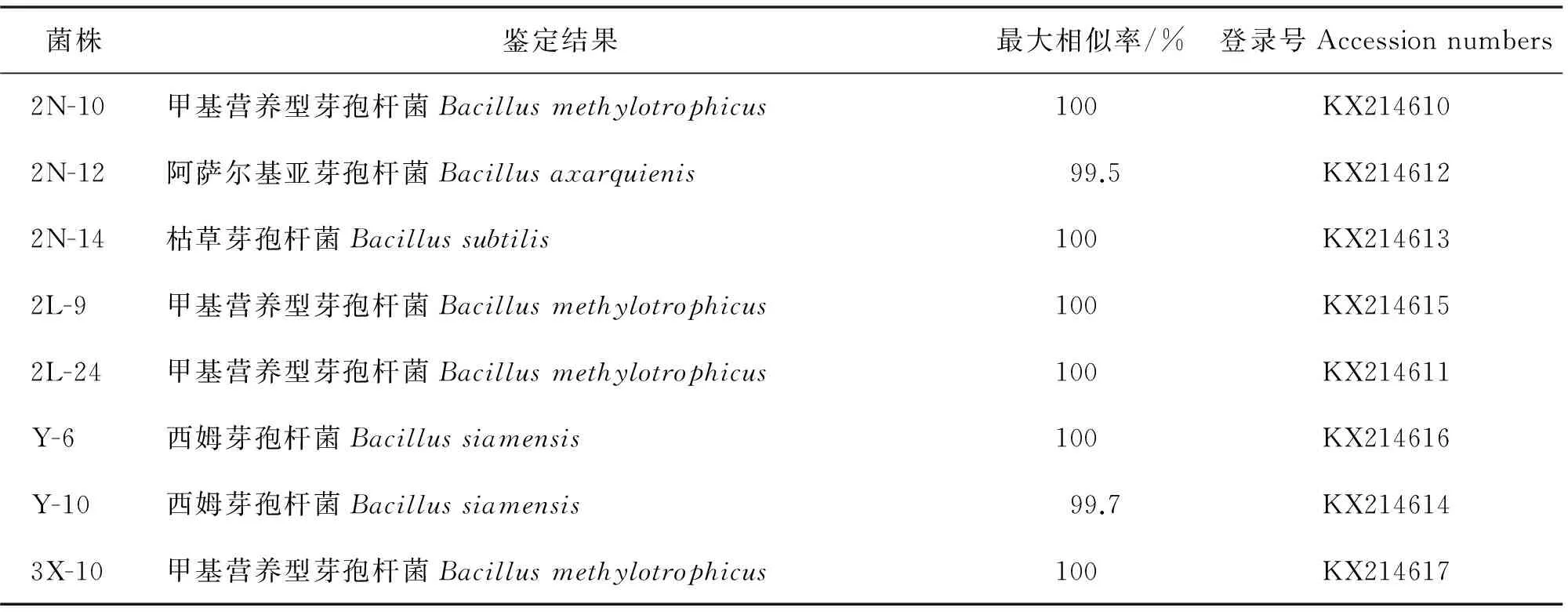
菌株鉴定结果最大相似率/%登录号Accessionnumbers2N-10甲基营养型芽孢杆菌Bacillusmethylotrophicus100 KX2146102N-12阿萨尔基亚芽孢杆菌Bacillusaxarquienis99.5KX2146122N-14枯草芽孢杆菌Bacillussubtilis100 KX2146132L-9甲基营养型芽孢杆菌Bacillusmethylotrophicus100 KX2146152L-24甲基营养型芽孢杆菌Bacillusmethylotrophicus100 KX214611Y-6西姆芽孢杆菌Bacillussiamensis100 KX214616Y-10西姆芽孢杆菌Bacillussiamensis99.7KX2146143X-10甲基营养型芽孢杆菌Bacillusmethylotrophicus100 KX214617
经16S rDNA分子鉴定,结合菌株的形态特征和生理生化实验结果,参照文献[15]和文献[17],发现菌株特征均与芽孢杆菌相近,2N-14为B.subtilis,2N-12为B.axarquienis,Y-6和Y-10为B.siamensis,2N-10、2L-9、2L-24和3X-10为B.methylotrophicus.
3 讨论
目前国内外对大熊猫肠道菌群的研究主要集中在以大肠埃希氏菌(Escherichiacoli)、克雷伯氏杆菌(Klebsiella)、空肠弯曲杆菌(Campylobacterjejuni)为代表的致病菌;而对其肠道纤维素降解菌的研究较少.本实验从大熊猫的粪样中共筛选到了具有较高纤维素酶活的菌株40株,为以后研究大熊猫肠道内降解纤维素的机制提供了更多的菌源.在熊猫体内筛选到产纤维素酶的菌种方面,荣华[21]从大熊猫肠道内分离筛选出1株梭菌属厌氧纤维降解菌PD-2,曹涵文等[22]于福州动物园大熊猫粪便中分离出1株假单胞菌菌株NC020209,而本实验筛选到的纤维降解菌均为芽孢杆菌属,较前2种菌生产更为容易、应用更为广泛.在熊猫体内芽孢杆菌产纤维素酶酶活方面,樊程等[23]从雅安碧峰峡熊猫基地大熊猫粪便中分离得到1株好氧菌株解淀粉芽孢杆菌 NBRC15535,其纤维素总酶活最高仅为0.229 U/mL;周潇潇等[24]为进一步弄清成年大熊猫肠道中芽孢杆菌的分布和寻求大熊猫微生态制剂的菌源,在大熊猫肠道中分离筛选出7株纤维降解菌,分别为4株枯草芽孢杆菌、1株蜡样芽孢杆菌、2株短小芽孢杆菌,但并未进行进一步的酶活测定筛选;赵珊等[25]从四川卧龙自然保护区的新鲜大熊猫粪便内筛选到1株好氧纤维素降解菌蜡样芽孢杆菌(Bacilluscereus,A1),且在最适培养条件下纤维素酶活最高达到0.139 U/mL;而本实验筛选到的产纤维素酶菌株中,酶活在0.250 U/mL以上的有8株菌,分别为枯草芽孢杆菌(B.subtilis)1株,阿萨尔基芽孢杆菌(B.axarquienis)1株,西姆芽孢杆菌(B.siamensis)2株,甲基营养型芽孢杆菌(B.methylotrophicus)4株,高于上述报道.
本实验报道从大熊猫肠道中分离筛选得到具有纤维素降解能力的阿萨尔基芽孢杆菌、西姆芽孢杆菌,丰富了大熊猫肠道菌群的种类.目前对阿萨尔基芽孢杆菌和西姆芽孢杆菌的研究还很少.阿萨尔基芽孢杆菌方面,只有Ruiz-García 等[26]在2005年分离出了阿萨尔基芽孢杆菌的新种的报道,尚未有功能研究的报道,本研究首次报道了阿萨尔基芽孢杆菌具有降解纤维素的功能.西姆芽孢杆菌的研究主要集中在生物防治[27]和新型食品酶源[28]的报道,尚未发现西姆芽孢杆菌对于纤维素降解功能的研究.本实验首次报道阿萨尔基芽孢杆菌和西姆芽孢杆菌具有降解纤维素的功能,为进一步开发2个菌株提供了理论基础.
[1] 娄治平,赖仞,苗海霞.生物多样性保护与生物资源永续利用[J].中国科学院院刊,2012,27(3):359-365.DOI:10.3969/j.issn.1000-3045.2012.03.015.
LOU Z P,LAI R,MIAO H X.Conservation of biodiversity and sustainable utilization of biological resources[J].Bulletin of Chinese Academy of Sciences,2012,27(3):359-365.DOI:10.3969/j.issn.1000-3045.2012.03.015.
[2] LI R,FAN W,TIAN G,et al.The sequence and de novo assembly of the giant panda genome[J].Nature,2010,463(7279):311-317.DOI:10.1038/nature 08696.
[3] 王海娟,潘渠.大熊猫肠道正常菌群降解纤维素的机制[J].中国微生态学杂志,2014,26(2):225-228.DOI:10.13381/j.cnkicjm.201402028.
WANG H J,PAN Q.The mechanism of cellulose metabolism by the giant panda gut microbiome[J].Chinese Journal of Microecology,2014,26(2):225-228.DOI:10.13381/j.cnkicjm.201402028.
[4] 谭志,鲍楠,赖翼,等.野外放归大熊猫和圈养大熊猫肠道正常菌群的研究[J].四川大学学报(自然科学版),2004,41(6):1276-1279.DOI:10.3969/j.issn.0490-6756.2004.06.039.
TAN Z,BAO N,LAI Y,et al.The study on the normal intestinal microflora of the giant panda returned to wild and the giant panda in captivity[J].Journal of Sichuan University (Natural Science Edition),2004,41(6):1276-1279.DOI:10.3969/j.issn.0490-6756.2004.06.039.
[5] 鲁海峰,魏桂芳,李仲逵,等.ERIC-PCR分子杂交技术分析大熊猫肠道菌群结构[J].中国微生态学杂志,2005,17(2):81-84.DOI:10.3969/j.issn.1005-376X.2005.02.001.
LU H F,WEI G F,LI Z K,et al.ERIC-PCR based fingerprinting and molecular hybridization to analyze the characteristics of intestinal microflora of giant panda[J].Chinese Journal of Microecology,2005,17(2):81-84.DOI:10.3969/j.issn.1005-376X.2005.02.001.
[6] 马清义,任建设,史怀平.人工饲养大熊猫消化道正常菌群分离与鉴定研究[J].北京农业,2009,21:56-57.DOI:10.3969/j.issn.1000-6966.2009.21.015.
MA Q Y,REN J S,SHI H P.Isolation and identification of intestinal flora in giant panda[J].Beijing Agriculture,2009,21:56-57.DOI:10.3969/j.issn.1000-6966.2009.21.015.
[7] 马海玲.基于动物粪便的纤维素分解菌筛选及分解纤维素能力研究[D].北京:中国地质大学,2012.
MA H L.Screening cellulose degradating microorganisms from animal wastes and studying of the capable of degradation cellulose[D].Beijing:China University of Geosciences,2012.
[8] WEI F,WANG X,WU Q.The giant panda gut microbiome[J].Trends Microbiol,2015,23(8):450-452.DOI:10.1016/j.tim.2015.06.004.
[9] 祝小,王振华,潘康成,等.产纤维素酶芽孢杆菌筛选及发酵条件的初步研究[J].现代农业科技,2006,11:122-124.DOI:10.3969/j.issn.1007-5739.2006.21.082.
[10] 陈丽燕,张光祥,黄春萍,等.两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J].微生物学通报,2011,38(4):531-538.DOI:10.13344/j.microbiol.china.2011.04.017.
CHEN L Y,ZHANG G X,HUANG C P,et al.Isolation,identification and enzymatic characteristics of cellulose-producing strains with high cellulase activity[J].Microbiology China,2011,38(4):531-538.DOI:10.13344/j.microbiol.china.2011.04.017.
[11] 朱顺妮,王闻,亓伟,等.纤维素酶的研究进展[J].新能源进展,2013,1(1):45-52.DOI:10.3969/j.issn.2095-560X.2013.01.005.
ZHU S N,WANG W,QI W,et al.Research progress in cellulase[J].Advances in New and Renewable Energy,2013,1(1):45-52.DOI:10.3969/j.issn.2095-560X.2013.01.005.
[12] 朱亚静.鹅肠道纤维素酶和蛋白酶活性分析以及纤维素降解菌的筛选[D].南宁:广西大学,2013.
ZHU Y J.Analysis of cellulase and protease and activity of goose intestine and screen on bacteria capable of degrading[D].Nanning:Guangxi University,2013.
[13] 胡艳平,王磊,曹平华,等.纤维素酶产生菌的筛选、其酶学性质及对饲料粗纤维降解效果的研究[J].饲料工业,2013,34(8):21-27.DOI:10.3969/j.issn.1001-991X.2013.08.005.
HU Y P,WANG L,CAO P H,et al.Study of screening of a strain producing cellulase,its enzymatic properties and the degradation rate of crude fiber in the feed[J].Feed Industry,2013,34(8):21-27.DOI:10.3969/j.issn.1001-991X.2013.08.005.
[14] 吴敏峰,耿秀蓉,祝小,等.产纤维素酶芽孢杆菌的分离鉴定[J].饲料工业,2006,27(20):21-24.DOI:10.3969/j.issn.1001-991X.2006.20.007.
[15] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:北京科学出版社,2001.
[16] B.施特马赫.酶的测定方法[M].钱嘉渊译.北京:中国轻工业出版社,1992:103-177.
[17] J.G 霍尔特主编.简明第八版伯杰细菌鉴定手册[M].刘复今编译.济南:山东大学出版社,1988.
[18] KIM S B,YOON J H,KIM H,et al.A phylogenetic analysis of the genussaccharomonosporaconducted with 16S rRNA gene sequences[J].International Journal of Systematic Bacteriology,1995,45(2):351-356.
[19] RAINEY F A,WARD-RAINEY N,KROPPENSTEDT R M,et al.The genus nocardiopsis represents a phylogenetically coherent taxon and a distinct actinomycete lineage:proposal of nocardiopsaceae fam[J].International Journal of Systematic Bacteriology,1996,46(4):1088-1092.DOI:10.1099/00207713-46-4-1088.
[20] HALL B G.Building phylogenetic trees from molecular data with MEGA[J].Molecular Biology and Evolution,2013,30(5):1229-1235.DOI:10.1093/molbev/mst012.
[21] 荣华,邱成书,胡国全,等.一株大熊猫肠道厌氧纤维素菌的分离鉴定、系统发育分析及生物学特性的研究[J].应用与环境生物学报,2006,12(2):239-242.DOI:10.3321/j.issn:1006-687X.2006.02.021.
RONG H,QIU C S,HU G Q,et al.Isolation of cellulolytic anaerobic strain from giant panda′s intestines and its biological characteristics and phylogeny[J].Chinese Journal of Applied & Environmental Biology,2006,12(2):239-242.DOI:10.3321/j.issn:1006-687X.2006.02.021.
[22] 曹涵文,吴珑韬,甘乾福,等.熊猫粪便中纤维素降解菌的筛选与鉴定[J].家畜生态学报,2015,06:19-25.DOI:10.3969/j.issn.1673-1182.2015.06.005.
CAO H W,WU L T,GAN Q F,et al.Isolation and identification of cellulose-degradation bacteria from panda dung[J].Journal of Domestic Animal Ecology,2015,06:19-25.DOI:10.3969/j.issn.1673-1182.2015.06.005.
[23] 樊程,李双江,李成磊,等.大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J].微生物学报,2012,52(9):1113-1121.DOI:10.13343/j.cnki.wsxb.2012.09.004.
FAN C,LI S J,LI C L,et al.Isolation,identification and cellulase production of a cellulolytic bacterium from intestines of giant panda[J].Acta Microbiologica Sinica,2012,52(9):1113-1121.DOI:10.13343/j.cnki.wsxb.2012.09.004.
[24] 周潇潇,何廷美,彭广能,等.大熊猫肠道芽孢杆菌的分离鉴定及其抗逆性研究[J].中国兽医科学,2013,43(11):1115-1121.
ZHOU X X,HE T M,PENG G N,et al.Isolation,identification and resistance analysis of 7Bacillusstrains from the intestinal tract of giant panda[J].Chinese Veterinary Science,2013,43(11):1115-1121.
[25] 赵珊,吕雯婷,刘杰,等.1株大熊猫肠道纤维素降解菌的分离鉴定及其酶学性质[J].微生物学杂志,2015,35(1):73-78.DOI:10.3969 / j.issn.1005-7021.2015.01.014.
ZHAO S,LÜ W T,LIU J,et al.Isolation of cellulose Degradable-Bacteria from Giant Panda′s intestines and its enzymatic characterization[J].Journal of Microbiology,2015,35(1):73-78.DOI:10.3969/j.issn.1005-7021.2015.01.014.
[26] RUIZ GARCIA C,QUESADA E,MARTINEZ CHECA F,et al.Bacillusaxarquiensissp.nov.andBacillusmalacitensissp.nov.,isolated from river-mouth sediments in southern Spain[J].Int J Syst Evol Microbiol,2005,55(3):1279-1285.DOI:10.1099/ijs.0.63567-0.
[27] 冯志珍,李金岭,陈太春,等.番茄疫霉根腐病拮抗细菌 FC12-05 的筛选、鉴定及其抑菌活性初探[J].西北农林科技大学学报 (自然科学版),2012,40(4):107-114.DOI:10.13207/j.cnki.jnwafu.2012.04.021.
FENG Z Z,LI J L,CHEN T C,et al.Screening,identification and antibacterial activity of antagonistic bacteria FC12-05 against phytophthora root rot of tomato[J].Journal of Northwest A & F University(Natural Science Edition),2012,40(4):107-114.DOI:10.13207/j.cnki.jnwafu.2012.04.021.
[28] 纪学芳,师俊玲,张锦华.柠檬苦素降解菌的分离筛选与分类鉴定[J].食品科学,2011,32(15):177-181.
JI X F,SHI J L,ZHANG J H.Isolation and identification of limonin-degrading strains isolated from fermented grains during vinegar fermentation[J].Food Science,2011,32(15):177-181.
(责任编辑:赵藏赏)
Isolation and identification ofBacilluscapable of degrading cellulose from the feces captive giant panda of in north China
WU Hongmin,GUO Wei,GUO Xiaojun,ZHOU Xian,ZHU Baocheng
(College of Life Sciences,Agriculture University of Hebei,Baoding 071001,China)
This study aimed at screening strains ofBacillussp.capable of degrading cellulose and identifying the species of purpose strains.8 dung samples of giant panda were treated in water bath at high temperature.Congo red decolorizing ring method was used to screen the strains before DNS method to test the highest enzyme activity.The results showed that 8 strains of 126 strains isolated in dung of giant panda had highly efficient cellulose-degrading capability.Through morphological,physiological and biochemical analysis and the sequence analysis of 16S rDNA gene,8 strains were identified.The strains are allBacillussp.,including 1Bacillussubtilis(2N-14),1B.axarquienis(2N-12),2B.siamensis(Y-6、Y-10),and 4B.methylotrophicus(2N-10、2L-9、2L-24、3X-10).The test shows that there were many strains (Bacillussp.) capable of cellulose degradation in the dung of giant panda.The giant panda-derivedB.axarquienis,B.siamensiswere isolated and cultivated for the first time,which enriched the research of giant panda intestinal flora and provided new sources of strains for efficient production of cellulose.Exploring the efficiency of cellulose degradation bacteria in the digestive tract of panda is beneficial for the resource utilization of high fiber feed.
giant panda;feces;bacillus;cellulose
10.3969/j.issn.1000-1565.2016.06.010
2015-12-22
河北省科技计划项目(12236606);保定市科学研究与发展计划项目(15ZN017)
武红敏(1990—),女,河北藁城人,河北农业大学在读硕士研究生.E-mail:873659445@qq.com
朱宝成(1962—),男,河北沧州人,河北农业大学教授,博士生导师,主要从事农牧微生物应用技术研究.E-mail:zhu2222@126.com
S858.9
A
1000-1565(2016)06-0623-12

