铀在高岭土上的吸附动力学及热力学研究
梁诗敏,于涛
(1.东华理工大学 省部共建核资源与环境国家重点实验室培育基地,江西 南昌 330013;2.东华理工大学 核科学与工程学院,江西 南昌 330013)
铀在高岭土上的吸附动力学及热力学研究
梁诗敏1,2,于涛1,2
(1.东华理工大学 省部共建核资源与环境国家重点实验室培育基地,江西 南昌 330013;2.东华理工大学 核科学与工程学院,江西 南昌 330013)
采用静态法研究了铀(U(Ⅵ))在高岭土上的吸附特性,探讨了pH、离子强度、接触时间、温度、腐殖酸等对U(Ⅵ)在高岭土上吸附的影响.以宏观吸附实验为基础,对高岭土进行X线衍射(XRD)和扫描电镜(SEM)表征,并讨论了铀(U(Ⅵ))在高岭土上的吸附动力学及热力学行为.结果说明,准二级动力学模型可以用来描述铀在高岭土上的吸附.通过对溶液pH值和离子强度因素的研究,溶液pH值对铀的吸附影响比离子强度对铀的吸附影响更大.在较低pH值下,腐殖酸对吸附有加强的作用;在较高pH值下,腐殖酸对吸附有抑制作用.Freundlich模型可较好地描述高岭土对U(Ⅵ)的吸附过程.高岭土对U(Ⅵ)的吸附为自发且吸热的过程,主要是表面单分子层吸附.
高岭土;铀;吸附;动力学;热力学
放射性废物是由于核技术的开发和利用所带来的[1],核技术的发展在给人类带来了巨大经济效益的同时,也带来了危害.铀矿采冶、核武器生产等核燃料循环表明了科技的进步,但他们产生的放射性废物进入环境中,潜在地危害了人类的健康,如何来处理这些问题成为了全球性难题[2].含铀废水的直接排放会造成土壤和水的污染,对人体健康也会造成影响.因而,污水在排入水体前应进行有效的处理[3].在废水处理中,吸附法[4]是一种经过实践证明了的有效的方法,铀的去除率高,操作简便.而自然界土壤中的黏土矿物是一种很好的吸附材质,它可以将放射性核素长期滞留在一定区域内[5].作为重要的黏土矿物,高岭土是红壤、膨润土的组成成分之一,有相对简单的晶体结构,且具有较好的理化性质.
本文着重对U(Ⅵ)在高岭土上的吸附行为进行研究,讨论吸附动力学和吸附热力学,并探讨U(Ⅵ)在高岭土上的吸附机理.
1 实验部分
1.1 仪器
微量铀分析仪(杭州大吉光电仪器有限公司);数控超声波清洗器(KQ-100DE,昆山市超声仪器有限公司);X线衍射仪(D/max-400,日本日立公司);低速离心机(80-2型,上海安亭科学仪器厂).
1.2 试剂
铀标准溶液,质量浓度为1 000 ng/mL;高岭土悬浮液,质量浓度为1 g/L;腐殖酸溶液,质量浓度为1 g/L;NaCl溶液,1 mol/L;LiCl溶液,1 mol/L;KCl溶液,1 mol/L,CaCl2溶液,1 mol/L;实验过程中所有溶液配置均采用超纯水.
1.3 实验流程
U(Ⅵ)在高岭土上的吸附实验按照实验要求分别在4个温度下进行.在某一温度下,首先分别取2 mL的高岭土悬浮液及0.5 mL的铀标准溶液置于一定数量的250 mL锥形瓶,根据不同的实验条件,再分别加入一定量的HA、LiCl、NaCl、KCl或CaCl2溶液,定容至50 mL,恒温振荡一定时间.U(Ⅵ)的吸附达到平衡后,移取15 mL溶液于离心管中,在一定速度下离心10 min,再取上清液5 mL,以微量铀分析仪分析U(Ⅵ)的含量,计算U(Ⅵ)在高岭土上的吸附百分数,进而求出U(Ⅵ)的吸附量.
用下面的(1)式来计算U(Ⅵ)在高岭土上的吸附百分数[6]
(1)
其中,c0(ng/mL)为吸附前溶液中U(Ⅵ)的质量浓度,ceq(ng/mL)为吸附平衡时上清液中U(Ⅵ)的质量浓度.U(Ⅵ)在平衡时的吸附量(q,mol/g)由式(2)计算,平衡时的分配系数(Kd,L/g)由式(3)计算[7]
(2)
(3)
其中,V(L)是水溶液的体积,m(g)是吸附剂的质量.
2 结果与讨论
2.1 高岭土的SEM与XRD表征
结晶较好的高岭土通常呈六边形层片状结构[8].从图1可以看出,该高岭土颗粒的形貌主要为六边形层片状结构,不同结构的粒径不同,通常为0.1~1 μm.颗粒的表面凹凸不平,有较多突起及沟壑,颗粒周围紧密伴生着其他细粒矿物.
XRD测试在D/max-400型X线衍射仪上进行.图2为高岭土的X线衍射分析图.由图2可以看出,样品中的主要矿物成分为高岭土,此外,样品中还含有一定量的石英.

图1 高岭土的扫描电子显微镜(SEM)图像Fig.1 SEM micrographs of kaolin
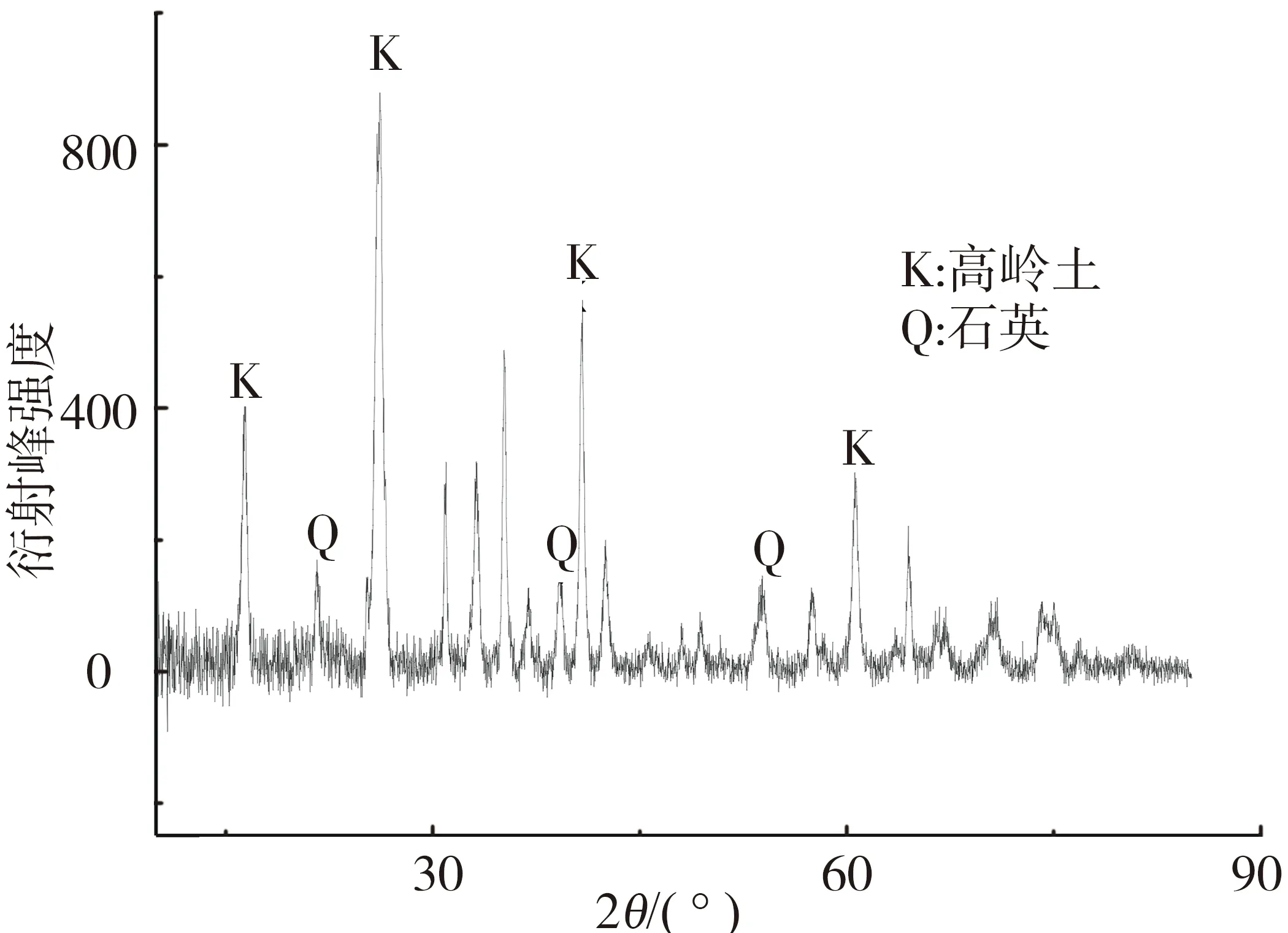
图2 高岭土的X线衍射(XRD)分析Fig.2 XRD patterns of kaoline
2.2 pH及离子强度对U(Ⅵ)在高岭土上吸附的影响
pH是影响U(Ⅵ)在高岭土上吸附的重要因素.以固体悬浮液的pH值为横坐标,以铀在高岭土上的吸附率为纵坐标作图,固体悬浊液中U(Ⅵ)的质量浓度([U(Ⅵ)]=1 000 ng/mL)在不同离子强度(2、5 mL的NaCl)上的吸附实验结果见图3.
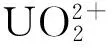
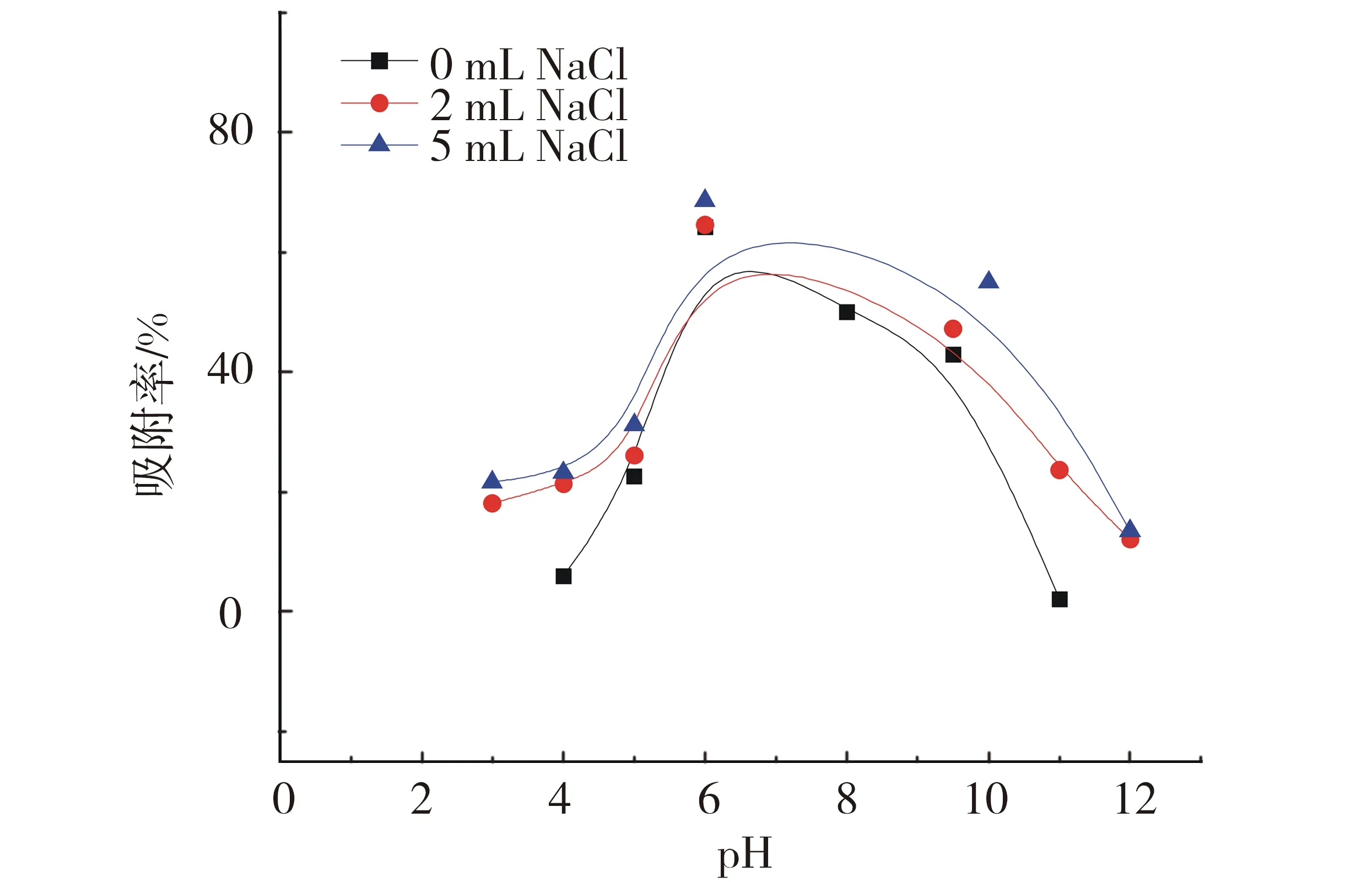
T=(293.15±1)K,ρ(固体吸附剂)=0.04 g/L,cU(Ⅵ)initial=4.20×10-6 mol/L.图3 pH及离子强度对U(Ⅵ)在高岭土上吸附行为的影响Fig.3 Effect of pH and ionic strength on the adsorption of U(Ⅵ) on kaolin
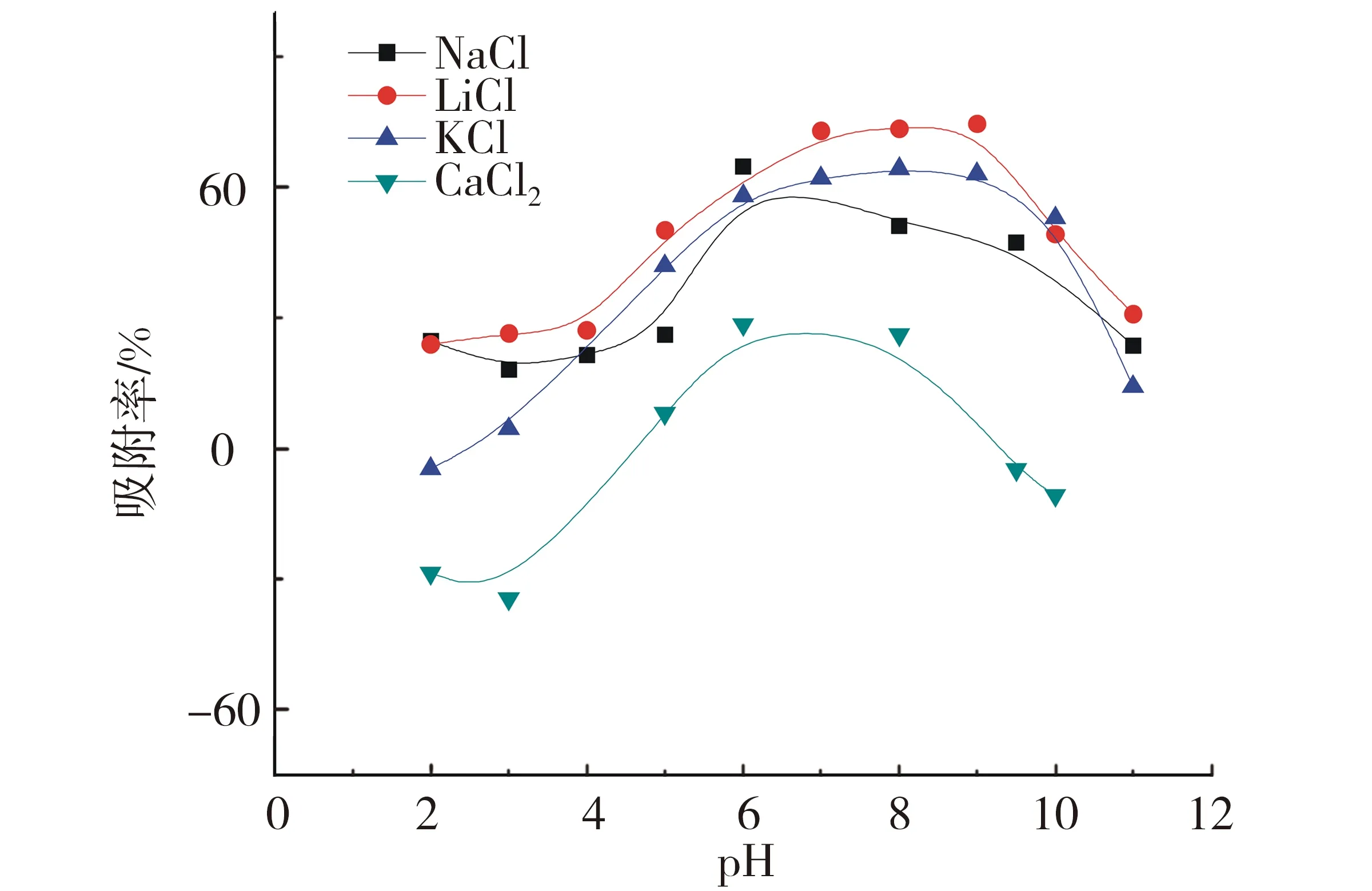
T=(293.15±1)K,ρ(固体吸附剂)=0.04 g/L,cU(Ⅵ)initial=4.20×10-6 mol/L.图4 阳离子对U(Ⅵ)在高岭土上的吸附行为的影响Fig.4 Adsorption of U(Ⅵ) on kaolin as a function of different cations
由图4可见,在相同浓度的条件下,LiCl与KCl随着pH的增加其吸附率接近,LiCl、KCl与NaCl这3个一价阳离子的变化趋势基本一致,而CaCl2随pH的增加变化波动较大.实验结果表明,离子强度对U(Ⅵ)在高岭土上的吸附的影响基本相同.Ca2+的影响波动较大,主要原因可能是Ca2+与反应过程中加入的荧光增强剂发生反应.
2.3 腐殖酸(HA)对U(Ⅵ)在高岭土上吸附的影响
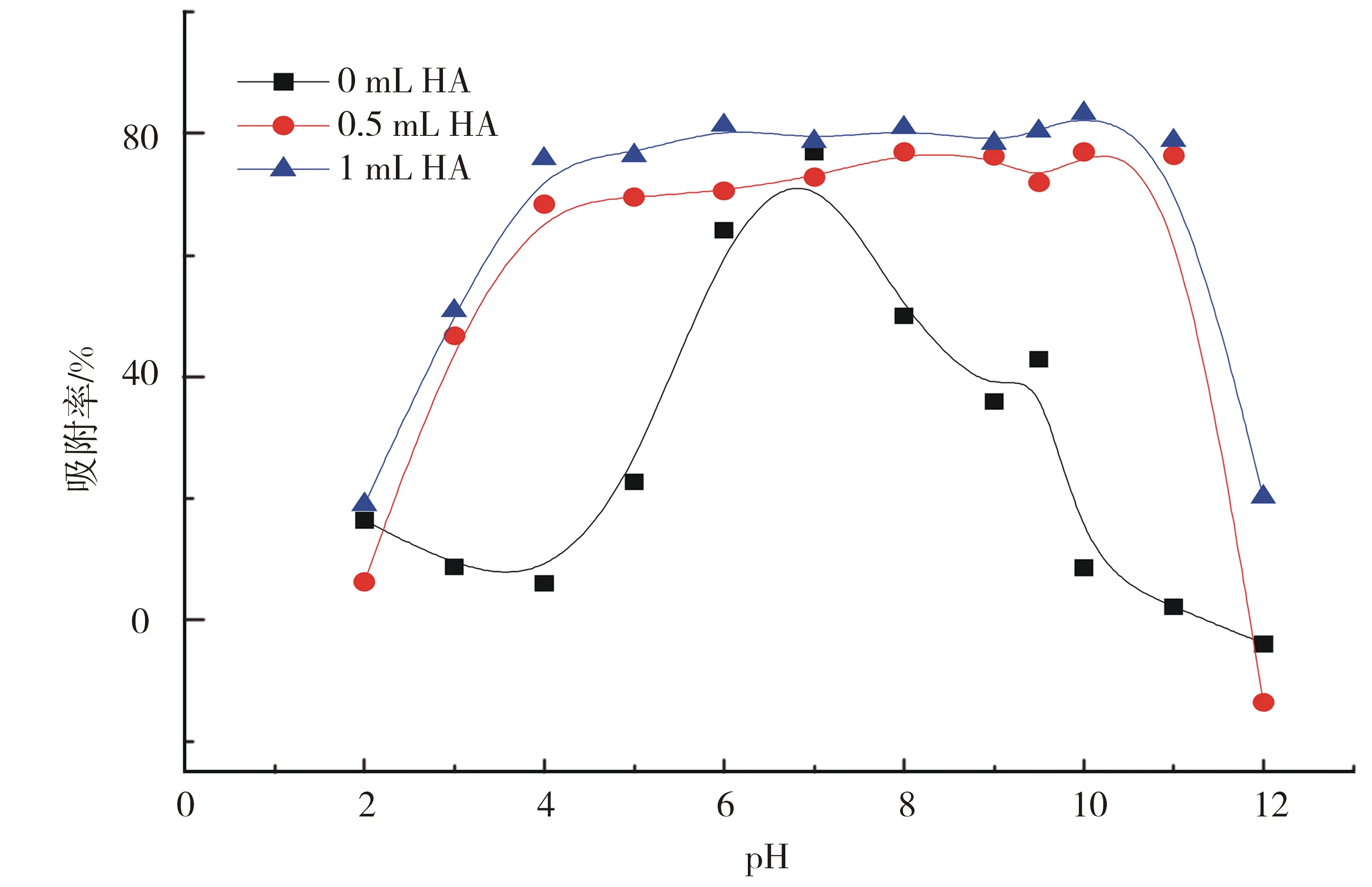
T=(293.15±1)K,ρ(固体吸附剂)=0.04 g/L,cU(Ⅵ)initial=4.20×10-6mol/L.图5 腐殖酸对U(Ⅵ)在高岭土上的吸附行为的影响Fig.5 Adsorption of U(Ⅵ) on kaolin as a function of humic acid
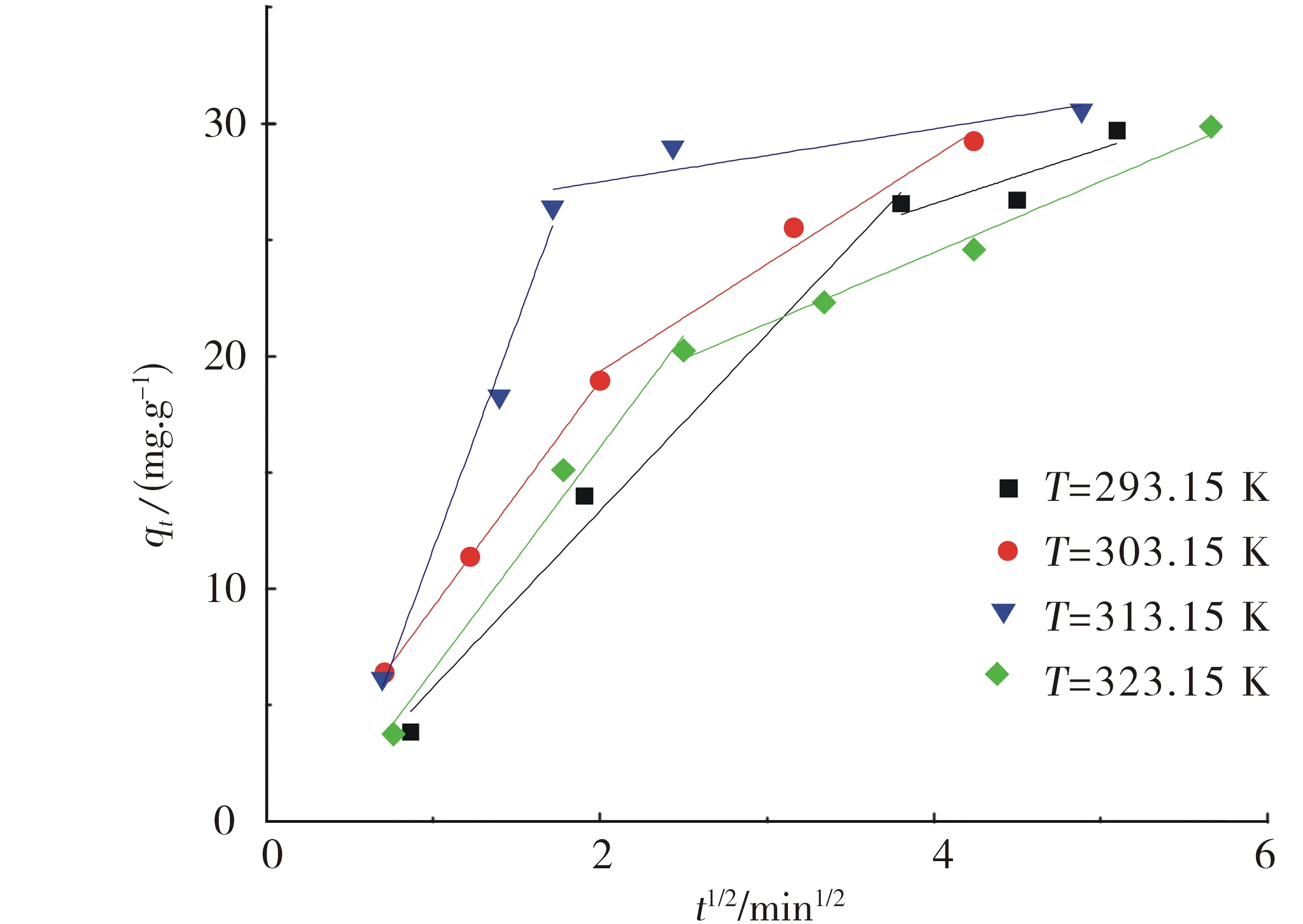
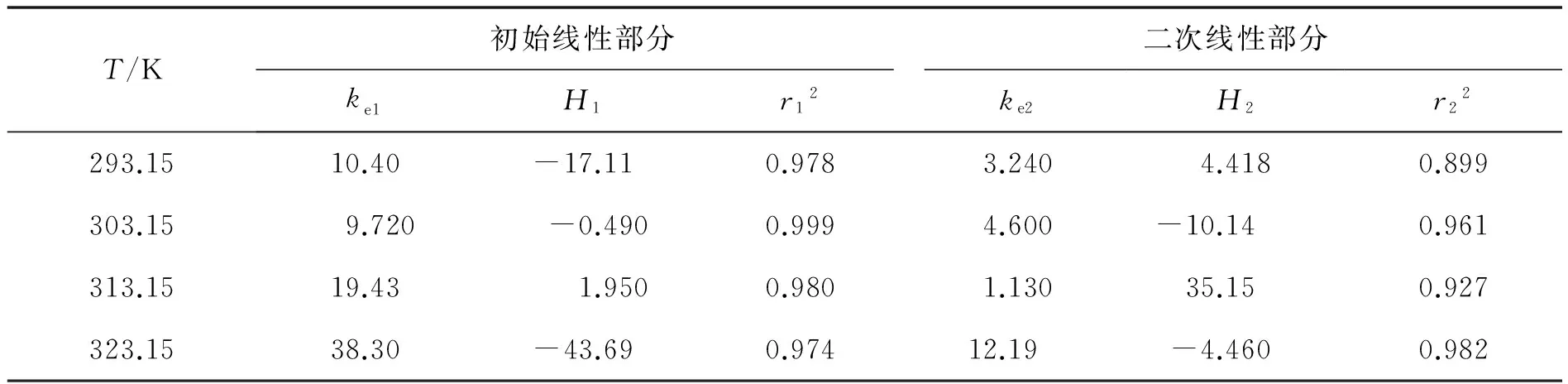
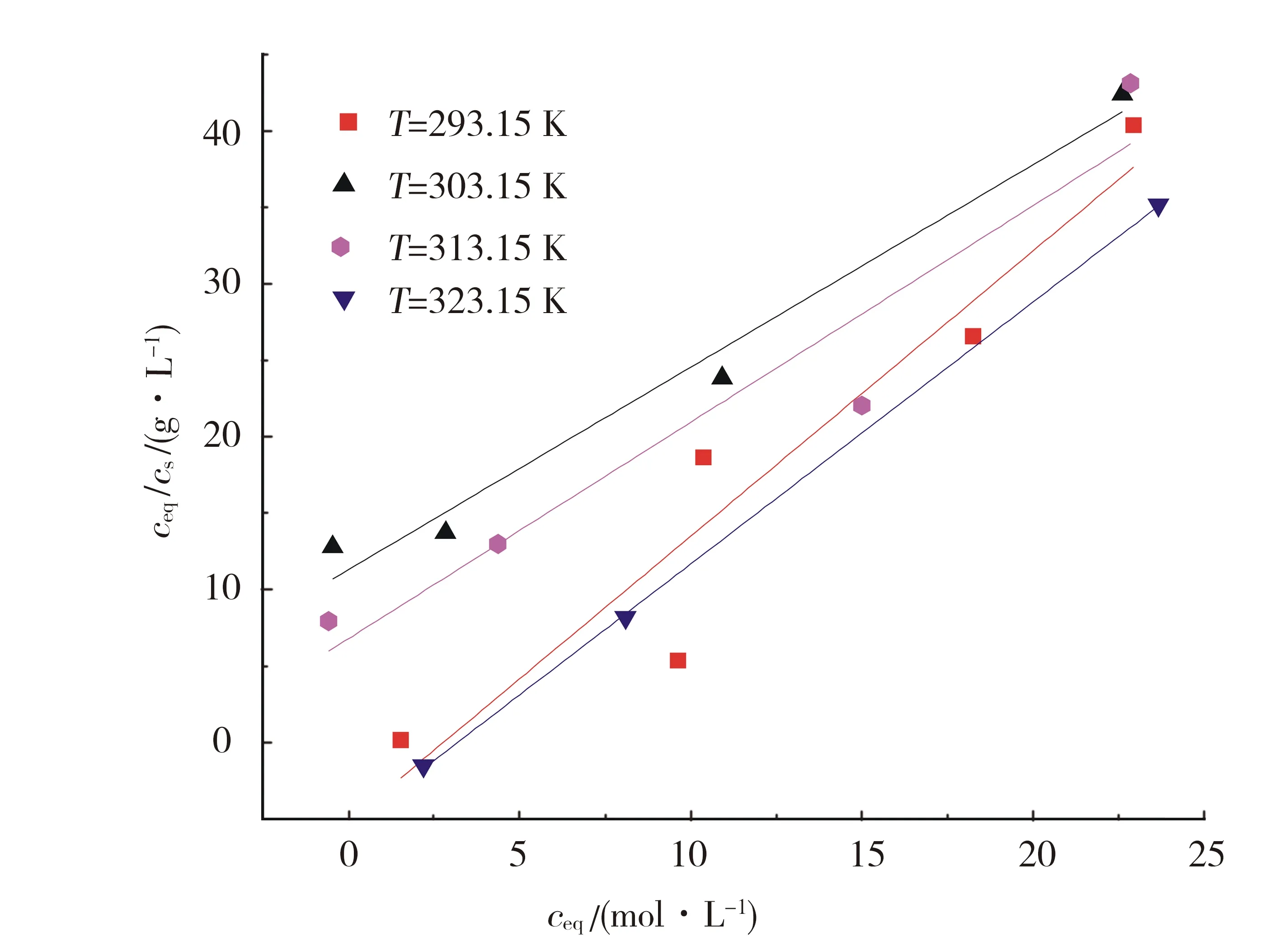
腐殖酸对放射性核素的吸附行为会有很大的影响.本实验用不同浓度的腐殖酸(VHA=0,0.5,1 mL)来研究高岭土对铀的吸附影响.图5为不同浓度的腐殖酸(HA)对铀在高岭土上的吸附的影响.通过图5可以得到,在不同腐殖酸存在的情况下,吸附效率与无腐殖酸时相比得到明显的增强,1 mL的腐殖酸比0.5 mL的腐殖酸稍微加强.在pH 2~5内,在腐殖酸存在的情况下,悬浮液的pH值越高,高岭土对铀的吸附效率增强;在pH>10时,随着悬浮液的pH的上升,腐殖酸对铀的吸附作用的影响减弱;在5 2.4 接触时间对U(Ⅵ)在高岭土上吸附的影响 2.4.1 U(Ⅵ)在高岭土上的吸附动力学模型 U(Ⅵ)在高岭土上的吸附动力学过程可以采用准一级动力学及准二级动力学方程来进行描述[10],以动力学理论为基础来探讨铀的吸附反应过程. U(Ⅵ)在高岭土上吸附的准一级动力学线性模型 1n(qe-qt)=1nqe-k1t. (4) U(Ⅵ)在高岭土上吸附的准二级动力学线性模型 (5) 此处,qt(mg/g)是在相应时间t时铀在高岭土上的吸附量,qe(mg/g)是吸附反应后的平衡吸附量.k1(h-1)是准一级动力学的吸附速率常数.k2(g/(mg·h))是准二级动力学的吸附速率常数. 平衡时间对铀在高岭土上的吸附行为影响见图6.由图6a可以得到,高岭土对U(Ⅵ)的吸附在10 h左右可达到平衡状态,吸附率在10 h之后基本趋于稳定. qe、k1、k2由准一级和准二级动力学模型的拟合直线计算得来的:以ln(qe-qt)对t作图,通过对直线斜率和截距的计算,通过图6b,可求得k1和qe.计算结果如下:T=293.15 K,R2=0.977,qe=0.012 mg/g,k1=0.109 6 h-1.以t/qt对t作图,通过图6c可求得k2及qe的值.计算结果如下:T=293.15 K,R2=0.988,qe=0.081 mg/g,k2=15.625 g/(mg·h). a.高岭土上的吸附率;b.吸附的准一级动力学;c.吸附的准二级动力学.T=(293.15±1)K,ρ(固体吸附剂)=0.04 g/L.图6 U(Ⅵ)在高岭土上的吸附的准一级动力学与准二级动力学Fig.6 Effect of the pseudo-first-order kinetic and the pseudo-second-order kinetic on the adsorption of U(Ⅵ) on kaolin. pH=5.5±0.05 ,ρ(固体吸附剂)=0.04 g/L.图7 不同温度下U(Ⅵ)在高岭土上吸附的韦伯-莫里斯内扩散模型拟合曲线Fig.7Fitted curves of Weber-Morris of U(Ⅵ) adsorption on kaolin at different temperatures 通过对实验结果进行分析,所得到的动力学实验数据结果比较符合准二级动力学模型,这可以说明准二级动力学方程比准一级动力学方程更好地描述铀在高岭土上的吸附过程.这是因为准二级动力学模型不仅考虑了外部扩散、表面吸附的问题,而且考虑了它的内部扩散作用,吸附反应是一个复杂、综合的过程. 2.4.2 U(Ⅵ)在高岭土上吸附过程的韦伯-莫里斯内扩散模型 高岭土对铀的吸附动力学模型还可用韦伯-莫里斯内扩散模型来描述,韦伯-莫里斯内扩散模型常用来分析反应中的控制步骤,方程式可用式(6)表示[11-12]: (6) 式中,ke为内扩散率常数,mg/(g·min1/2);H是涉及到厚度、边界层的常数;qt表示t时刻的吸附量,mg/g.qt对t1/2作图,如果是直线且经过原点,则说明内扩散由单一速率控制.将韦伯-莫里斯内扩散模型数据分2段进行线性拟合,所做实验曲线见图7,由韦伯-莫里斯内扩散模型得到的相关常数如表1所示. 表1 不同温度下U(Ⅵ)在高岭土上吸附的韦伯-莫里斯内扩散模型的相关系数 高岭土的吸附过程分为吸附剂的表面吸附和粒子的内部扩散过程2个吸附过程,从图7可以得到,韦伯-莫里斯内扩散模型所得到的2段曲线线性拟合情况较好,说明高岭土的主要吸附过程为粒子的内部扩散过程.但韦伯-莫里斯内扩散模型拟合得到的直线都没有经过原点,说明内扩散过程不是控制高岭土吸附过程的唯一步骤,高岭土对铀的吸附过程比较复杂,表面吸附扩散过程不可忽略. 2.5 不同温度对U(Ⅵ)在高岭土上吸附的影响 用吸附等温线可以来判断高岭土吸附铀现象的本质.本文采用Langmuir等温吸附方程和Freundlich等温吸附方程来进一步研究高岭土对铀的吸附过程,等温吸附方程如下[13]: lgcs=lgα+nlgceq. (7) Langmuir等温吸附方程 (8) pH=5.5±0.05,ρ(固体吸附剂)=0.04 g/L.图8 不同温度下U(Ⅵ)在高岭土上吸附的Langmuir吸附等温线Fig.8 Langmuir isotherms for the adsorption of U(Ⅵ) on kaolin at different temperatures 其中,cs为吸附反应平衡时的吸附量(mol/L);ceq为离心分离后最终上清液的浓度(mol/L);cs max是平衡时最大的吸附容量(mol/g),与吸附位有关;b是和吸附温度有关的吸附平衡常数;n是与温度、体系有关的常数,其值大小表示浓度对吸附量影响的强弱;a为吸附容量(mol/g),随温度的升高而降低;cs对ceq作图,可计算得到吸附等温线下的kd,即kd值为其斜率. 2.5.1 U(Ⅵ)在高岭土上吸附的Langmuir吸附等温线 图8为不同温度下,U(Ⅵ)在高岭土上的Langmuir吸附等温线.由图8可见,随着温度的升高,吸附等温线的高度不断降低,ceq/cs的值变小,进而可以说明高温有利于吸附反应的进行.当温度为323.15 K时,随ceq增大,ceq/cs的值增大,表明U(Ⅵ)在固相中的分布增速没有液相中那么快,因此ceq/cs的值会出现增大的趋势. 由式5和图8可得出Langmuir等温吸附方程的相关参数,其计算结果如表2所示. 表2 U(Ⅵ)在高岭土上吸附的Langmuir吸附等温线的相关参数 2.5.2 U(Ⅵ)在高岭土上吸附的Freundlich吸附等温线 由图9可见,4个温度下的Freundlich等温线依温度高低作上下分布,323.15 K时等温线位置最高,293.15 K时位置最低.由图9可见,温度越高,越有利于吸附反应进行.同时,随温度升高,各温度下的kd分别为5.66、25.81、474.24和4 984.25 L/g.可见,kd的值总体上随温度的升高而增大,这也说明高温有利于吸附反应的进行.U(Ⅵ)在高岭土上吸附的热力学函数由下式计算[14]: a.高岭土上的吸附率;b.Freundlich吸附等温线.pH=5.5±0.05,ρ(固体吸附剂)=0.04 g/L.图9 不同温度下U(Ⅵ)在高岭土上吸附的Freundlich吸附等温线Fig.9 Freundlich isotherms for the adsorption of U(Ⅵ) on kaolin at different temperatures (9) (10) ΔH0=ΔG0+TΔS0, (11) 其中,T为开氏温度,R为理想气体常数.将计算结果列于表3. 表3 U(Ⅵ)在高岭土上的吸附热力学函数(ΔG0,ΔS0,ΔH0) 由表3计算结果可知,吸附热力学函数的ΔH0大于零,ΔG0小于零,说明铀在高岭土上的吸附行为是一个自发的且吸热得过程.ΔG0的绝对值随着温度的升高而逐渐变大,由此可知温度可以促进高岭土对铀的吸附反应的进行. 由图8、9和表2、3可见,Freundlich等温吸附方程更好地拟合了实验数据,相关系数都达到0.9以上;Freundlich模型能够更好地对铀在高岭土上的吸附过程进行描述. 本文通过静态法研究了不同条件下U(Ⅵ)在高岭土上的吸附行为特性,初步得到了以下结论: 1) pH对U(Ⅵ)在高岭土上的吸附行为有很大的影响,高岭土吸附U(Ⅵ)的吸附率自pH2~7迅速上升,吸附率在pH>7时随着pH值的升高而降低,U(Ⅵ)的最大吸附量为悬浊液pH=7时对应的值. 2) 离子强度对U(Ⅵ)在高岭土上吸附的影响不是很大.说明铀在高岭土的吸附过程中产生了配位化合物.不同离子对高岭土上的吸附过程影响大致相同. 3) 在pH 2~5内,在腐殖酸存在的情况下,悬浮液的pH越高,高岭土对铀的吸附效率增强;在pH>10时,随着悬浮液的pH的上升,腐殖酸对铀的吸附作用的影响减弱;在5 4) 高岭土对U(Ⅵ)的吸附约10 h可达到吸附平衡状态,吸附率在10 h之后基本趋于稳定.准二级动力学方程比准一级动力学方程更好的描述铀在高岭土上的吸附过程. 5) 温度会促进高岭土对铀的吸附,温度越高,吸附率越高.由热力学函数计算结果,可知U(Ⅵ)在高岭土上的吸附是吸热且自发的过程.Freundlich等温吸附方程更好地拟合了实验数据,相关系数都达到0.9以上.高岭土对铀的吸附为单分子层吸附. [1] 罗上庚.核废物的安全和环境影响[J].安全与环境学报,2001,1(02):16-20. LUO S G.Safety and environmental impact of nuclear waste[J].Journal of safety and Environment,2001,1(02):16-20. [2] LI Q F,LIU M X,KANG J M,et,al.Advances in interaction between micro organ-ism and radioactive nuclide[J].Environmental Scienceand Technology,2008,31(10):67-70.DOI:10.3969/j.issn.1003-6504.2008.10.017. [3] 周书葵,曾光明,刘迎九,等.改性羧甲基纤维素对铀吸附机理的试验研究[J].中国环境科学,2011,31(9):1466-1471. [4] 陆朝阳,沈莉莉,张全兴.吸附法处理染料废水的工艺及其机理研究进展[J].工业水处理,2004,24(3):12-16. LU Z Y,SHEN L L,ZHANG Q X.Research development of technics and mechanism of dye wastewater treatment by adsorption[J].Industrial Water Treatment,2004,24(3):12-16. [5] LI S Y,XIE S B,WANG J L,et,al.Adsorption properties of clay for uranium in waste water[J].Chemical Environmental Protection,2006,26 (6):459-462. [6] INOUE S,KIRIYAMA K,HATANNAKA Y,et al.Adsorption properties of an activated carbon for 18 cytokines and HMGB1 from inflammatory model plasma[J].Colloids and Surfaces B:Biointerfaces,2015,126:58-62.DOI:10.1016/j.colsurfb.2014.12.015. [7] REN X M,WANG S W,YANG S T.Influence of contact time,pH,ionic strength and temperature on sorption of U(Ⅵ) onto MX-80 bentonite[J].J.Radioanal Nucl.Chem.,2010,283(1):253-259.DOI:10.1007/s10967-009-0323-0. [8] 吴自强.高岭土应用技术[J].化学建材,1996,12(2):88-89. [9] EVANS N,WARWICK P,LEWIS T,et al.Influence of humic acid on the sorption of U(Ⅵ) to kaolin[J].Environmental Chemistry Letters,2011,9 (1):25-30.DOI:10.1007/s10311-009-0241-y. [10] 宋文玉,降青梅,刘亚东,等.铬(Ⅲ) 离子催化铈(Ⅳ)离子氧化异丁醇的反应动力学及机理[J].河北大学学报(自然科学版),2004,24(6):594-599. SONG W Y,JIANG Q M,LIU Y D,et,al.Kinetics and mechanism of chromium (Ⅲ) ion catalysis cerium Ⅳ) ions oxidation isobutanol[J].Journal of Hebei University(Natural Science Edition),2004,24(6):594-599. [11] SHAUHA M S,SARWAR M I,QADEER R,et,al.Adsorption of strontium ions from aqueous solution on Pakistani coal[J].Journal of Radioanalytical and Nuclear Chemistry,2005,265(1):73-79.DOI:10.1007/s10967-005-0789-3. [12] AKSU Z.Application of biosorption for the removal of organic pollutants:A review[J].Process Biochemistry,2005,40 (3-4):997-1026.DOI:10.1016/j.procbio.2004.04.008. [13] 熊正为,王玉清,郭成林,等.蒙脱石吸附铀机理实验研究[J].湖南师范大学(自然科学学报),2007,30(3):75-79. XIONG Z W,WANG Y Q,GUO C L,et,al.Experimental study on the mechanism of adsorption of montmorillonite[J].Journal of natural science of Hunan Normal University,2007,30(3):75-79. [14] XIE Z F,HE X C,XIA J H.Adsorption thermodynamics and dynamic of polyamide to picric acid[J].Chem Res,2003,12(4):53-56. (责任编辑:梁俊红) Kinetic and thermodynamic study of U(Ⅵ) adsorption onto kaolin LIANG Shimin1,2,YU Tao1,2 (1.State Key Laboratory Breeding Base of Nuclear Resources and Environment,East China University of Technology,Nanchang 330013,China;2.School of Nuclear Science and Engineering,East China University of Technology,Nanchang 330013,China) By static adsorption experiments,the effects of pH,ionic strength,adsorption time,solid-liquid ratio,temperature,humic acid on the adsorption of U(Ⅵ) onto kaolin were studied.Based on macroscopic adsorption experiments,the adsorption process was analyzed by thermodynamics and kinetics methods,and the kaolin samples were characterized by X-ray diffraction and scanning electron microscopy.The results show that pseudo-second-order kinetic model can be used to describe the adsorption of uranium on kaolin.Through the study of pH and ionic strength,the effect of pH on the adsorption of uranium is greater than the effect of the ionic strength on the adsorption of uranium.The presence of HA reduces the adsorption in a high pH range,while enhances the adsorption at low pH values.The adsorption of U(Ⅵ) onto kaolin could be described by Freundlich isothermal adsorption equation.The adsorption of U(Ⅵ) onto kaolin is an endothermic process,mainly occurs on the surface as a monomolecular layer. kaolin;U(Ⅵ);adsorption;kinetics;thermodynamics 10.3969/j.issn.1000-1565.2016.06.006 2016-08-12 国家自然科学基金资助项目(21561001) 梁诗敏(1993—),女,湖北鄂州人,东华理工大学在读硕士研究生.E-mail:1530043655@qq.com 于涛(1979—),男,吉林白城人,东华理工大学副教授,主要从事环境放射化学的研究.E-mail:xiaoshan770@163.com O64 A 1000-1565(2016)06-0596-08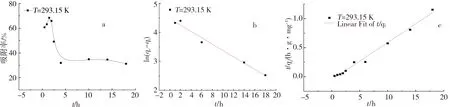
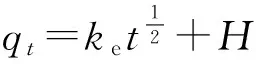


3 结论

