离子反应学习中的“四要”
柴勇
离子反应是中学化学的重要内容,也是历年高考的必考考点,下面将离子反应学习中要深刻理解和掌握的知识总结如下,希望对同学们的学习有所帮助。
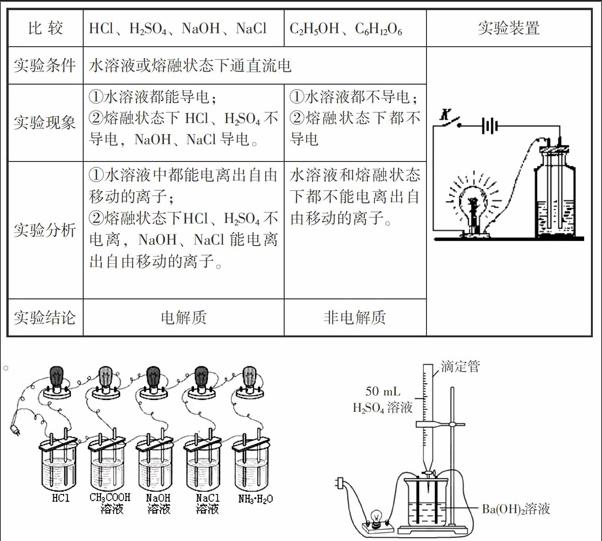
一、两个实验要会做 目的方法细分析
1. 化合物导电性实验。
2.导电性强弱测定实验。
按图装置把仪器连接好,然而把相同条件下的HCl、CH3COOH、NaOH、NaCl、NH3·H2O五溶液分别倒在烧杯中,接通电源,观察灯泡发光的明亮程度。
现象:HCl、NaOH、NaCl灯泡亮度 相同,CH3COOH、NH3·H2O 灯泡亮度相同 ;且HCl、NaOH、NaCl灯泡亮度比CH3COOH、NH3·H2O 强。
结论:①离子所带电荷数相同时,溶液的导电性与离子浓度成正比,与离子种类无关;②HCl、NaOH、NaCl易电离,溶液中自由移动的离子浓度大,属于“强电解质”;CH3COOH、NH3·H2O不易电离,溶液中自由移动的离子浓度小,属于“弱电解质”。
【例1】下列状态的物质,既属于电解质又能导电的是
( )
A. 酒精 B. 氯化钾晶体 C. 液氯 D. 熔融的氢氧化钠
解析:电解质是在水溶液或熔融状态下能导电的化合物,酒精在两种状态下均不导电,液氯是单质,故A、C均不是电解质;氯化钾晶体中的K+、Cl-无法自由移动,因此无法导电。答案:D
【例2】为证实Ba(OH)2溶液和H2SO4溶液反应是离子反应,实验设计和实验过程如下:如图连接好装置,向烧杯中加入25 mL 1mol·L-1的Ba(OH)2溶液和2滴酚酞试剂,再不断地滴加1 mol·L-1的H2SO4溶液,并轻轻振荡。试完成下列内容:
(1)实验现象及分析:①溶液颜色变化为:__________,原因:__________。
②灯泡亮度变化:__________,原因:__________。
③溶液变浑浊,原因__________。
(2)实验结论:稀硫酸溶液和Ba(OH)2溶液反应的实质是__________。(用离子方程式解释)
解析:要证实H2SO4溶液和Ba(OH)2溶液的反应是离子反应,则须证明发生反应的离子浓度发生了变化,而离子浓度变化和溶液导电性是有联系的,分析反应原理及实验设计过程不难作答。
答案:(1)①由红色逐渐变为浅红,最后颜色退去 Ba(OH)2电离出的OH-与H2SO4电离出的H+中和生成H2O,使烧杯中的c(OH-)减小,红色逐渐退去 ②随着H2SO4溶液的不断加入,呈现由明到暗以至熄灭,再逐渐变亮的变化 开始时,溶液中的离子浓度逐渐减小,故灯泡变暗,当烧杯中的Ba(OH)2完全反应时灯泡熄灭,再加H2SO4,离子浓度又变大,灯泡又变亮 ③Ba2+与SO42-结合生成BaSO4沉淀 (2)2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
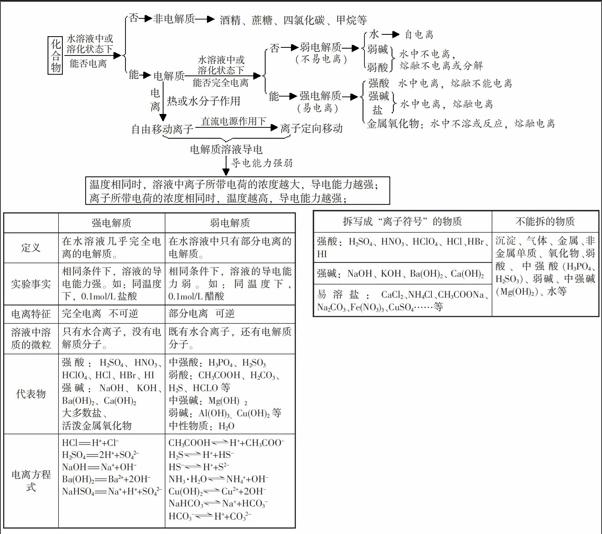
二、四个概念(电解质、非电解质、强电解质、弱电解质)要辨析,认真对比解习题
提醒:1. 金属单质也能导电,但它们不是化合物,所以它们既不是电解质,也不是非电解质。
2. NH3、SO2、CO2等物质溶于水中,本身不能拆开(电离)成阴、阳离子,而是它们与水反应生成了NH3·H2O、H2SO3、H2CO3,生成的NH3·H2O、H2SO3、H2CO3发生电离产生阴、阳离子,所以,NH3、SO2、CO2等是非电解质,而NH3·H2O、H2SO3、H2CO3等是电解质。
提醒:1. 电离方程式书写时,除正确书写物质的化学式和离子符号外,还必须:一要考虑用“=”还是“?”; 二要考虑“一步”还是“分步”;三要考虑等号两边“质量守恒”和“电荷守恒”。
2. BaSO4、CaCO3、AgCl等虽难溶于水,但溶解于水的部分能完全电离,所以BaSO4、CaCO3、AgCl不但是电解质,而且还是强电解质。但由于溶解于水的量太少,溶液中自由移动的离子浓度太小,故溶液的导电性极差。
【例3】下列说法正确的是( )
A. NaCl晶体中含有Na+、Cl-,所以NaCl晶体能导电
B. CO2溶于水能导电,所以CO2是电解质
C. BaSO4难溶于水,故将BaSO4放入水中存在电离平衡
D. Cl2的水溶液能够导电,Cl2既不是电解质也不是非电解质
解析:NaCl晶体中Na+、Cl-不能自由移动,故不能导电;CO2属于非电解质;BaSO4是强电解质,不存在电离平衡。答案:D
【例4】某固体化合物A不导电,但熔融或溶于水都能完全电离。下列关于物质A的说法中,正确的是( )
A. A是非电解质 B. A是强电解质
C. A是离子化合物 D. A是弱电解质
解析:由化合物A,固体不导电,熔融状态,能完全电离,说明A为离子化合物;又在水溶液中完全电离,说明A为强电解质。答案:B C
三、离子方程要会写,是对是错细甄别
有关离子方程式的正误,大致可以从以下几个方面来判断,这也正确书写离子方程式的要求。
1. 离子反应是否符合客观事实,不可主观臆造反应在产物及反应。如2Fe+6H+=2Fe3++3H2↑就不符合客观事实。
2.“=”、“? ”、“↓”、“↑”的使用是否正确。可逆反应用“?”表示,不可逆反应可用“=”表示。
3. 化学式拆写是否正确。这是书写离子方程式步骤中最关键的一步,拆写应注意以下几点:①不用离子方程式表示的离子反应类型:不在溶液中进行的任何反应通常都不用离子方程式表示。②注意“拆写”要求:
③微溶物的写法:一般来说,微溶物的澄清溶液写成离子形式;浑浊或沉淀时写成化学式,如澄清石灰水表示为“Ca2++2OH-”,而石灰乳则表示为“Ca(OH)2”。例:向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O;向石灰乳中通入通入少量CO2:Ca(OH)2+CO2=CaCO3↓+ H2O。④可溶性多元弱酸酸式盐的酸式根一律保留酸式根的形式。如NaHCO3溶液应拆成“Na++HCO3-”,而不能拆成“Na++H++CO42-”。故:NaHCO3 溶液与KOH溶液混合:HCO3- +OH- =H2O+CO32-;而强酸的酸式盐——如:NaHSO4一步电离成“Na++H++SO42-”,故:NaHSO4溶液与KOH溶液混合:H+ + OH- =H2O。
4. 看是否漏掉离子反应。如Ba(OH)2溶液与硫酸铜溶液反应,既要写Ba2+与SO42-的离子反应,又要写Cu2+与OH-的离子反应。
5. 是否遵循三大守恒,即质量守恒、电荷守恒和得失电子守恒,如:Ag++Cu= Ag++Cu2+(错误),2Ag++Cu=2Ag+Cu2+(正确)。
6. 看反应物或产物的配比是否正确。如稀H2SO4与Ba(OH)2溶液反应:H++OH-+SO42-+Ba2+=BaSO4↓+H2O(错误),2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O(正确)。
7. 看是否符合题设条件及要求:①溶液酸碱性条件。有些物质在不同条件下存在形态不同,如反应产物有碳酸盐时,则CO32-与HCO3-取决于溶液碱性强弱,强碱溶液中写CO32-,弱碱溶液中(如CO2过量时)则写HCO3-。②温度条件。如:(NH4)2SO4与NaOH溶液反应,只有浓溶液且加热条件下,才可写成NH3↑,否则写成NH3·H2O。例:(NH4)2SO4 溶液与NaOH溶液混合:NH4++OH-=NH3·H2O;(NH4)2SO4溶液与NaOH溶液混合加热:NH4+ +OH-[=][△][]NH3 ↑ + H2O。③浓度条件。例如:浓H2SO4与稀H2SO4写法不同。④注意实验操作条件。“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序等对反应方程式的影响不同。如:往Na2CO3溶液中加入少量稀盐酸的离子方程式为:CO32-+H+=HCO3-;往Na2CO3溶液中加入过量稀盐酸的离子方程式为:CO32-+2H+=CO2↑+H2O。
8. 正确书写酸式盐与强碱溶液间反应的离子反应方程式——采用“少定多变法”:所谓的“少定”即量少的反应物,其离子计量数确定为1,而“多变”即过量的反应物,其计量数根据反应的需要确定,不受化学式中的比例制约,是可变的。如:Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2+ +2HCO3-+2OH-=CaCO3↓+CO32-+2H2O;Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+ H2O。
9. 几个特殊反应中涉及到的“量”的离子反应方程式:如:Mg(HCO3)2溶液与过量的NaOH溶液反应,不可忽视Mg(OH)2比MgCO3溶解度更小,对应的离子反应方程式为:Mg2++ 2HCO3- +2Ca2++4OH- = 2CaCO3↓+2H2O + Mg(OH)2↓(正确),Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O(错误);如:明矾 (KAl(SO4)2 · 12H2O) 与Ba(OH)2 溶液反应,不能忽视Al(OH)3的两性:少量Ba(OH)2溶液时:2Al3+ + 3SO42- + 3Ba2++6OH- = 3BaSO4↓+ Al(OH)3↓,足量Ba(OH)2溶液时:Al3+ +2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O;如:NH4HSO4溶液与足量的Ba(OH)2反应,不可忽视NH3·H2O也是弱电解质,离子方程式为:NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3·H2O+H2O。
【例5】下列离子方程式正确的是( )
A. 向100 mL 0.1 mol/L的FeSO4溶液中加入0.01 mol Na2O2固体:4Fe2++4Na2O2+6H2O=8Na++4Fe(OH)3↓+O2↑
B. 向明矾溶液中逐滴加入Ba(OH)2溶液至SO2-4恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O?2C6H5OH+CO32-
D. 向20 mL 0.5 mol/L FeBr2溶液中通入448 mL Cl2(标准状况):2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
解析:B项明矾溶液中Al3+与SO42-的物质的量之比是1∶2,要使Ba2+完全沉淀,Al3+与OH-的物质的量之比是1∶4,Al3+恰好转化为[Al(OH)4]-,故B错误;C中苯酚钠与CO2反应,无论CO2的量多与少,都是生成HCO3-,且不是可逆反应,故C错误;D中n(FeBr2) ∶ n(Cl2) = 1∶2,Cl2过量,而离子方程式中Fe2+、Br-间的量不符合1∶2的关系,故D错误,正确的应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-。答案:A
【例6】下列离子方程式书写正确的是( )
A. 少量的CO2通入NaOH溶液中:CO2+OH-=HCO3-
B. 小苏打溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O
C. 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH-
D. 铜粉加入到FeCl3溶液中:Cu+2Fe3+=2Fe2++Cu2+
解析:本题主要考查离子方程式的书写。A项,应生成CO32-;B项,CH3COOH是弱电解质,不可拆;C项,S2-水解应分步进行;D项,该离子方程式符合客观事实,原子、得失电子、电荷均守恒,正确。答案:D
四、离子共存要判断,排除障碍得真解
1. 由于发生复分解反应,离子不能大量共存:①有气体产生——如:H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。②有沉淀生成——如: Ca2+、Mg2+、Ba2+等与SO42-、SO32-、CO32-等不能大量共存,主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);Mg2+、Al3+、Cu2+、Fe2+、Fe3+等与OH-不能大量共存是因为:Cu2++2OH-=Cu(OH)2↓,Fe3+ + 3OH- = Fe(OH)3↓等;③有弱电解质生成——如:OH-、ClO-、F-、CH3COO-、PO43-、HPO42-、H2PO4-等与H+不能大量共存,主要由于OH-+H+=H2O、CH3COO-+H+=CH3COOH等;一些弱酸的酸式根或NH4+不能与OH-大量共存是因为:HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O。此类离子反应总是朝着使溶液中某些离子浓度降低的方向进行!
2. 由于发生氧化还原反应,离子不能大量共存:①一般情况下,具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如:I-、S2-、HS-和Fe3+不能大量共存是由于:2I-+2Fe3+=I2+2Fe2+、2Fe3++ S2-=S↓+2Fe2+、2Fe3++3S2-=S↓+2FeS↓。②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如:NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在下不能共存;如:SO32-、S2O32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生:2S2-+SO32-+6H+=3S↓+3H2O、2S2-+S2O32-+6H+=4S↓+3H2O不能共存。如:ClO-与S2-不论是在酸性条件下还是在碱性条件下都不能大量共存。
3. 由于形成络合离子,离子不能大量共存:中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况。如:Fe3+ 和SCN-由于Fe3++SCN-=[Fe(SCN)]2+ 等络合反应的发生而不能大量共存。
4. 一些容易发生水解的离子,在溶液中的存在是有条件的:如:AlO2-、S2-、HS-、CO32-、HCO3-、SO32-、HSO3-、ClO-、F-、CH3COO-、PO43-、SiO32-等存在于碱性溶液,而不存在于酸性溶液。如:Mg2+、Al3+、Cu2+、Fe2+、Fe3+、NH4+等存在于酸性溶液,而不存在于碱性溶液。而上述两组离子一般不能同时存在在同一溶液中,即离子间能发生“双水解”反应。因为:3CO32-+2Al3++3H2O=3CO2↑+2AI(OH)3↓,3AlO2-+Al3++6H2O=4Al(OH)3↓等。
5. 注意题目要求:①看清“一定大量共存”“可能大量共存”、还是“不能大量共存” 等要求。②若溶液无色——则Cu2+(蓝)、Fe3+(棕黄)、Fe2+(浅绿)、MnO4-(紫)等有色离子不能存在。③溶液中有H+——溶液呈酸性;紫色石蕊试液变红;溶液pH<7;加入铝粉后放出H2等。溶液中有OH-——溶液呈碱性;紫色石蕊试液变蓝;溶液pH>7;加入铝粉后放出H2等。
【例7】下列各组离子可能大量共存的是( )
A. pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 含有大量OH-的无色溶液中:Na+、Cu2+、[Al(OH)4]-、SiO32-
D. 常温下水电离出的 c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SiO32-
解析:选项A中,pH=1的溶液是酸性溶液,Fe2+被MnO4-氧化,HCO3-在酸性溶液中也不能大量存在。选项B中,与金属铝反应放出氢气的溶液有两种可能,一是酸性溶液,二是碱性溶液,但在酸性溶液中,由于NO3-存在,不能产生氢气;碱性溶液中,NH4+与OH-又不能大量共存。选项C中,Cu2+有颜色。选项D中,c(H+)·c(OH-)=10-20,则常温下水电离出的c(H+)=c(OH-)=10-10mol·L-1若是酸性溶液,S2-与SO32-不能大量共存,但碱性溶液中可以大量共存。答案:D
【例8】下列各组离子可能大量共存的是( )
A. pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 含有大量OH-的无色溶液中:Na+、Cu2+、[Al(OH)4]-、SiO32-
D. 常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
解析:选项A中,pH=1的溶液是酸性溶液,Fe2+被MnO4-氧化,HCO3-在酸性溶液中也不能大量存在。选项B中,与金属铝反应放出氢气的溶液有两种可能,一是酸性溶液,二是碱性溶液,但在酸性溶液中,由于NO3-存在,不能产生氢气;碱性溶液中,NH4+与OH-又不能大量共存。选项C中,Cu2+有颜色。选项D中,c(H+)·c(OH-)=10-20,则常温下水电离出的c(H+)=c(OH-)=10-10mol·L-1若是酸性溶液,S2-与SO32-不能大量共存,但碱性溶液中可以大量共存。答案:D
跟踪训练:
1. 在水溶液中能大量共存的一组离子是( )
A. Fe2+、Al3+、ClO-、Cl- B. K+、Cu2+、OH-、NO3-
C. NH4+、Na+、Br-、SO42- D. Mg2+、H+、SiO32-、SO42-
2. 能正确表示下列反应的离子方程式为( )
A. 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C. 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3-
D. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
3.下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3-;②无色溶液中:K+、Na+、MnO4-、SO42-;③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+;④酸性溶液中:Fe2+、Al3+、NO3-、Cl-;⑤由水电离出的[OH-]=1×10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
A. ①⑤ B. ②③ C. ②④ D. ③⑤
4. 浓度均为0.1 mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
A. BaCl2、NaOH、NaHCO3 B. Na2CO3、MgCl2、H2SO4
C. AlCl3、NH3·H2O、NaOH D. Ba(OH)2、CaCl2、Na2SO4
跟踪训练答案:
1. C 解析:结合离子的性质,从离子反应发生的条件入手分析,离子之间若能发生反应,则不能大量共存。特别注意还原性离子(如Fe2+等)与氧化性离子[如ClO-、NO3-(H+)等]因发生氧化还原反应而不能大量共存。A项Fe2+具有强还原性,ClO-具有强氧化性,二者能发生氧化还原反应;B项Cu2+能与OH-反应生成Cu(OH)2沉淀;D项H+能与SiO32-反应生成H2SiO3沉淀。
2. D解析:Fe2+和S2-都具有还原性,可被硝酸氧化为Fe3+和SO42-,A错误。由于NaOH过量,OH-与NH4+和HCO3-都反应,正确的离子方程式为NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O,B错误。少量SO2通入苯酚钠溶液中生成苯酚和亚硫酸钠,正确的离子方程式为2C6H5O-+SO2+H2O=2C6H5OH+SO32-,C错误。CaCO3是难溶物,醋酸是弱酸,均不拆写,醋酸钙是易溶于水的盐,拆写,D项离子方程式正确。
3. A 解析:②中MnO4-显紫红色;③中“加入Al能放出H2的溶液”显酸性或碱性,HCO3-都不能存在;④中Fe2+、NO3-在酸性溶液中能发生氧化还原反应,故不能大量共存;⑤中“由水电离出的[OH-]=1×10-13 mol·L-1的溶液”显酸性或碱性,Na+、Ba2+、Cl-、Br-都可以大量共存。
4. B解析:A项,NaOH与NaHCO3恰好完全反应:HCO3-+OH-=CO32-+H2O,生成的CO32-与Ba2+恰好完全反应生成沉淀:Ba2++CO32-=BaCO3↓;B项,Na2CO3与H2SO4恰好完全反应:CO32-+2H+=CO2↑+H2O,无沉淀生成;C项,NH3·H2O、NaOH完全与AlCl3反应生成Al(OH)3沉淀:3NH2·H2O+3OH-+2Al3+=3NH4++2Al(OH)3↓,且AlCl3有剩余;D项,一定有BaSO4沉淀生成:Ba2++SO42-=BaSO4↓。
责任编辑 李平安

