反向电渗流非水毛细管电泳法快速测定微量赤霉素
郭振朋, 王晓瑜, 陈 义,2*(. 中国科学院化学研究所, 活体分析化学院重点实验室, 北京 0090; 2. 北京分子科学国家实验室, 北京 0090; . 中国烟草总公司郑州烟草研究院, 河南 郑州 45000)
邹汉法研究员纪念专辑(下)·研究论文
反向电渗流非水毛细管电泳法快速测定微量赤霉素
郭振朋1, 王晓瑜3, 陈 义1,2*
(1. 中国科学院化学研究所, 活体分析化学院重点实验室, 北京 100190; 2. 北京分子科学国家实验室, 北京 100190; 3. 中国烟草总公司郑州烟草研究院, 河南 郑州 450001)
赤霉素是一类重要的植物激素,是结构相似的弱酸性二萜类化合物。针对毛细管电泳法分离、测定赤霉素速度慢、效率不佳等问题,该文发展了一种可快速测定微量活性赤霉素的非水毛细管电泳-紫外检测法。以聚环氧乙烷动态涂布毛细管,利用正离子使电渗流反向,将含10 mmol/L醋酸铵的甲醇-水(95∶5, v/v)作为缓冲体系,在0.08%(v/v)醋酸含量下,分离8种内源性赤霉素。结果表明,赤霉素出峰时间的相对标准偏差(RSD)≤2.1%(日内)或≤4.3%(日间),峰面积的RSD≤4.5%(日内)或≤6.9%(日间),检出限(S/N=3)为1.04~2.20 mg/L,相关系数为0.998 2~0.999 3,回收率为87.2%~93.5%。该方法简单、快速、稳定,以含醋酸铵的甲醇水溶液为缓冲体系,预先考虑了质谱测定的需要,可用于实际样品如麦芽中赤霉素的分析,具有一定的应用价值。
非水毛细管电泳;电渗流;动态涂层;赤霉素
赤霉素(GAs)是一类重要的植物激素,广泛存在于高等植物中,并在植物的生长、发育中起重要的调控作用,如种子的萌发、根和茎的伸长、花的发育、果实的生长等[1-3]。分析植物组织或器官中GAs的含量对研究植物的生长发育及其调控具有重要意义。目前对GAs的分析主要采用气相色谱(GC)法和高效液相色谱(HPLC)法,但其操作繁复、样品消耗量大[4-8]。研究者探索了以毛细管电泳(CE)法快速、高效地分离多种微量GAs的方法,如Ge等[9-11]建立的水相CE法可基线分离11种GAs,但其分析时间超过20 min,而出峰时间窗口只有4 min。主要原因是GAs为结构相似的含羧基的化合物,需利用其在酸性缓冲液中离解度的差异实现分离,而采用正向电渗流(EOF)的CE法难以实现其快速分离。因此,可发展反向EOF的CE法来加速分离GAs,其中,阳离子涂层的水相CE法是一种选择,但其不易调控反向EOF的大小,且难以与高灵敏的质谱联用;相比而言,非水毛细管电泳(NACE)法更具有研究开发的价值。
Belder等[12]用聚乙二醇(PEG)物理涂布毛细管内壁,在采用甲醇、乙腈等非水介质缓冲液时,管壁上的PEG分子能吸附溶液中的阳离子,因而改变EOF的大小甚至方向,但其操作复杂、耗时,且涂层随电泳次数的增加而逐渐剥落,重复性较差;Cottet等[13]尝试采用聚环氧乙烷(PEO)对毛细管管壁进行动态吸附涂覆,在非水介质中实现了对EOF大小和方向的调控,并考察了PEO的相对分子质量对EOF的影响。
本文利用PEO动态涂层毛细管,以含10 mmol/L醋酸铵的甲醇-水(95∶5, v/v)作为缓冲溶液,通过调节和优化缓冲液中电解质阳离子的种类及浓度改变和调控EOF的方向和大小,建立了NACE分离麦芽中8种重要的内源性赤霉素的分析方法。
1 实验部分
1.1 仪器、试剂与材料
P/ACE MDQ电泳仪、Allegra 64R离心机(美国Beckman公司); KQ5200DE超声波清洗器(昆山超声仪器有限公司); MD200-1氮吹仪(杭州奥盛仪器有限公司);未涂层石英毛细管(30 cm×75 μm,有效长度20 cm,河北永年光纤厂); Cleanert PAX-SPE固相萃取(SPE)小柱(天津博纳艾杰尔科技有限公司)。
GA1、GA3、GA4、GA5、GA7、GA12、GA20和GA53标准品(纯度>90%)均购自捷克OlChemIm公司;PEO(Mr: 106)购自美国Sigma公司;二甲基亚砜(DMSO)、醋酸、醋酸钾、醋酸铵、醋酸钠、醋酸锂、碳酸氢铵、甲醇、乙腈(分析纯)均购自北京化学试剂公司。实验用水为Milli-Q(美国Millipore公司)制备的超纯水。
用甲醇-水(1∶1,v/v)配制质量浓度均为1.0 g/L的各GAs标准储备液,于-20 ℃储存;将各GAs标准储备液混合,用甲醇-水(1∶1,v/v)稀释成不同质量浓度的GAs混合标准溶液。用100 mmol/L盐酸配制质量分数为0.2%的PEO涂层溶液。将1 mol/L醋酸铵(或醋酸锂、醋酸钠、醋酸钾)、10%(v/v)的醋酸、超纯水、甲醇(或乙腈)按所需比例混合,制备成电泳缓冲液,每日现用现配,用0.45 μm聚四氟乙烯滤膜过滤。
1.2 电泳操作
分别用1 mol/L盐酸、PEO涂层溶液和电泳缓冲液各冲洗毛细管3 min,在1 379 Pa(0.2 psi, 2 s)压力下将样品引入毛细管,于25 ℃和-15 kV条件下分离,在200 nm波长下进行紫外吸收检测。由P/ACE工作站采集并处理检测数据,样品采集频率为4 Hz,以DMSO为标志物测定EOF的速度。
1.3 麦芽样品前处理
称取10 g小麦种子,于25 ℃用自来水浸泡24 h,使发芽。取发芽的麦种置于研钵中,用液氮冷冻并研碎后,转移至锥形瓶中,加入50 mL甲醇-水-甲酸溶液(15∶4∶1, v/v/v),于4 ℃浸泡24 h,超声5 min,过滤,以10 000 g离心10 min,取上清液,经氮气吹干后,用1 mol/L盐酸调节pH至2.5,用10 mL乙酸乙酯萃取,共3次,合并乙酸乙酯相,用氮气吹干后,加入3 mL 25 mmol/L碳酸氢铵水溶液溶解,待上样。
1.4 NACE样品制备
依次用5 mL甲醇、25 mmol/L碳酸氢铵水溶液活化Cleanert PAX-SPE柱后,上样,依次用5 mL碳酸氢铵水溶液、甲醇淋洗,用1 mL酸化甲醇(含0.2 mol/L甲酸)洗脱,收集洗脱液,经氮气吹干后,用40 μL甲醇-水(1∶1, v/v)溶解,待NACE分析。
2 结果与讨论
2.1 毛细管电泳参数的优化
本文采用相对分子质量较高的PEO对毛细管进行动态涂层,并系统地考察了缓冲液溶剂、阳离子的种类及含量等因素对EOF大小和方向的影响,建立了在NACE中简单调控EOF的方法。
2.1.1缓冲液种类和含量的选择
在NACE中,电泳缓冲液中有机溶剂的种类和含量对动态涂层的稳定性及EOF的调控具有明显影响。如表1所示,采用不同缓冲液,其EOF的大小有明显差异。当电解质不变时,纯甲醇或乙腈溶液容易导致EOF反向,但其大小均随有机相比例的降低而减小。当甲醇或乙腈所占比例分别低于85%(v/v)或90%(v/v)时,EOF极不稳定,检测基线的噪声大幅增加。原因为PEO涂层的稳定性随溶剂极性的增大而降低。在有机相含量相同的情况下,采用乙腈水溶液时的电渗流大于采用甲醇水溶液,因此在多数情况下宜选用乙腈水溶液作为缓冲液。但对于GAs,其淌度在酸性非水缓冲液中均较小,EOF过大反而对其分离不利。综合考虑EOF稳定性与分离速度,本文选择甲醇-水(95∶5, v/v)作为电泳缓冲液。

表1 电泳缓冲液中有机溶剂含量对EOF大小的影响Table 1 Effect of the contents of organic solvents inrunning buffer on the electroosmotic flows (EOFs)
All the running buffers contained 10 mmol/L ammonium acetate. * Base-line fluctuated drastically and EOF was not steady.
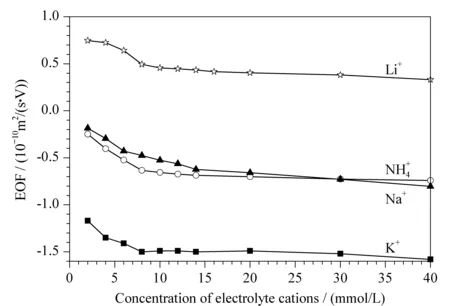
图1 不同电解质阳离子对EOF的影响Fig. 1 Effect of the different electrolyte cations on EOFs Capillary dynamically coated with polyethylene oxide (PEO); running buffer was methanol-water (95∶5, v/v).
2.1.2电解质阳离子的选择
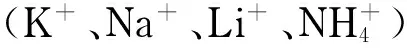

图2 缓冲液中醋酸含量对GAs标准品分离度的影响Fig. 2 Effect of the content of acetic acid in runningbuffer on the resolution of gibberellins (GAs) standard samples The volume percentages of acetic acid in running buffer: a. 0; b. 0.02%; c. 0.04%; d. 0.08%; e. 0.16%; f. 0.32%. Running buffer consisted of 10 mmol/L ammonium acetate in methanol-water (95∶5, v/v). Running voltage: -15 kV. 1. GA5; 2. GA20; 3. GA3; 4. GA7; 5. GA1; 6. GA4; 7. GA53; 8. GA12.
2.2 GAs的分离
根据2.1节,本实验选择醋酸铵-醋酸缓冲体系考察GAs的分离条件。利用PEO动态涂层毛细管,以甲醇-水(95∶5, v/v)为缓冲液溶剂,固定醋酸铵的浓度为10 mmol/L,考察缓冲液中醋酸含量对8种GAs分离效果的影响。与Li+类似, H+也不与管壁的PEO涂层结合,因此在一定范围内改变醋酸的含量对EOF的大小没有影响,但会影响GAs中羧基的电离。如图2所示,通过调节醋酸含量,使结构类似、淌度相近的GAs在非水条件下表现出不同的解离度或表观淌度,从而调节其分离度。8种GAs的出峰时间随醋酸含量的增加而增加;但分离度随醋酸含量的增加先逐渐增大(见图2a~2d),而后有部分GAs的分离度下降(如图2e中GA7与GA1,图2f中GA7与GA1、GA53与GA12)。当醋酸含量为0.08%(v/v)时,8种GAs分离情况最好,能在9 min内达到基线分离(见图2d)。而利用非涂层的正向电渗NACE法分离8种GAs时,在正分离电压条件下,120 min内只能分离得到5种GAs(见图3);在负分离电压下,120 min内未检测到GAs。
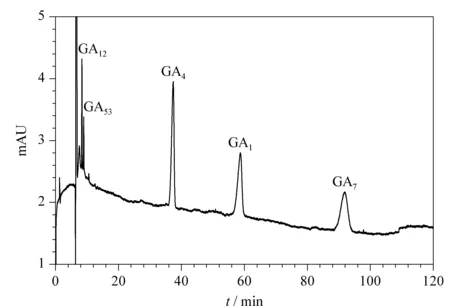
图3 未涂层时GAs标准品的NACE电泳图Fig. 3 Electropherogram of the GAs standard samples measured by a bare capillary with nonaqueous capillary electrophoresis (NACE) Running buffer consisted of 10 mmol/L ammonium acetate and 0.08% (v/v) acetic acid dissolved in methanol-water (95∶5, v/v). Running voltage:+15 kV.
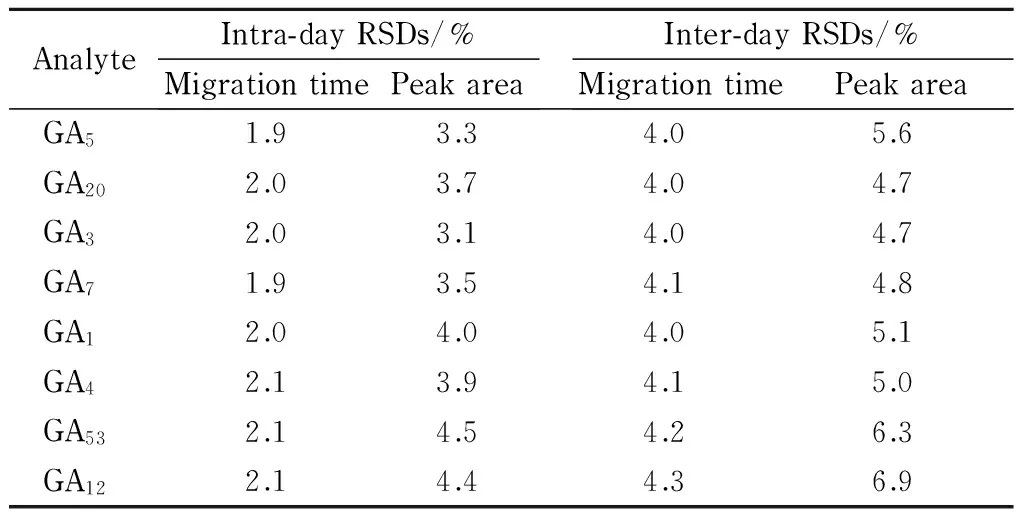
表2 GAs混合标准溶液的日内、日间迁移时间和峰面积的相对标准偏差(n=6)Table 2 Intra-day and inter-day relative standarddeviations (RSDs) of migration times and peak areas for the GAs mixed standard solutions (n=6)
2.3 精密度、检出限和回收率
按本文所述方法对GAs混合标准溶液进行分析,各GAs迁移时间的相对标准偏差(RSD)≤2.1%(日内)或≤4.3%(日间),峰面积的RSD≤4.5%(日内)或≤6.9%(日间)(见表2)。对系列质量浓度的GAs混合标准溶液进一步分析,得到方法的检出限(LOD,S/N=3)为1.04~2.20 mg/L;各GAs在线性范围内线性关系良好,相关系数(r2)>0.998(见表3)。向刚研碎的麦芽中加入0.5 μg的GA1、GA3、GA5、GA12、GA20、GA53, 0.7 μg GA4和0.3 μg GA7的标准品,按本文所述方法处理,其加标回收率为87.2%~93.5%, RSD<10%,符合定量分析的要求。
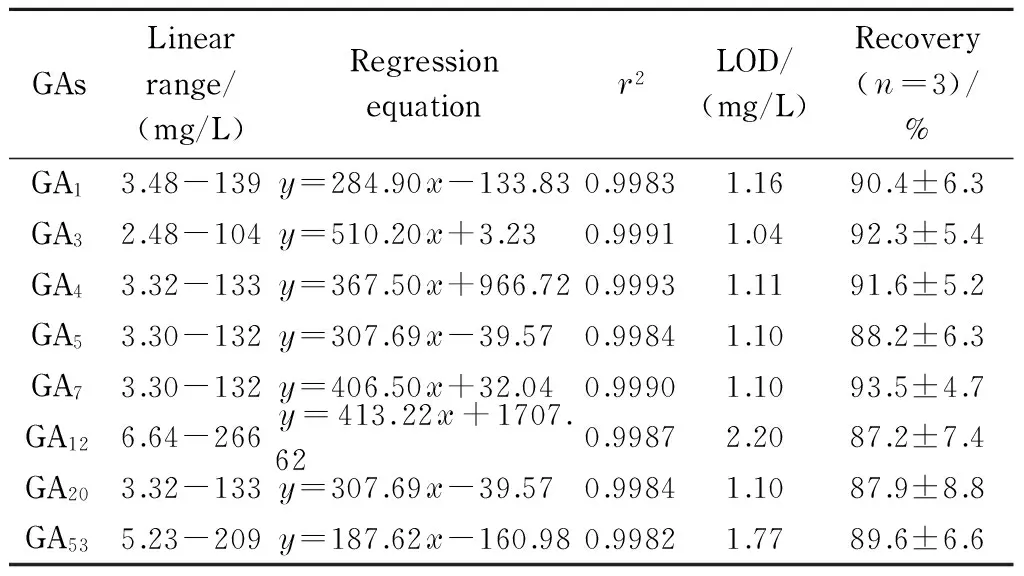
表3 GAs的线性范围、回归方程、相关系数(r2)、检出限和加标回收率Table 3 Linear ranges, regression equations, correlationcoefficients (r2), limits of detection (LODs) and recoveries of the GAs spiked standard samples
y: peak area;x: mass concentration, mg/L.
2.4 实样样品分析
按本文所述方法对培育的麦芽进行样品前处理,并测定麦芽中赤霉酸的含量,其中只检测出GA3,含量为0.475 μg。麦芽中GAs的电泳图见图4。本文所建立的反向电渗流NACE法可快速定量分析GAs,具有推广价值。
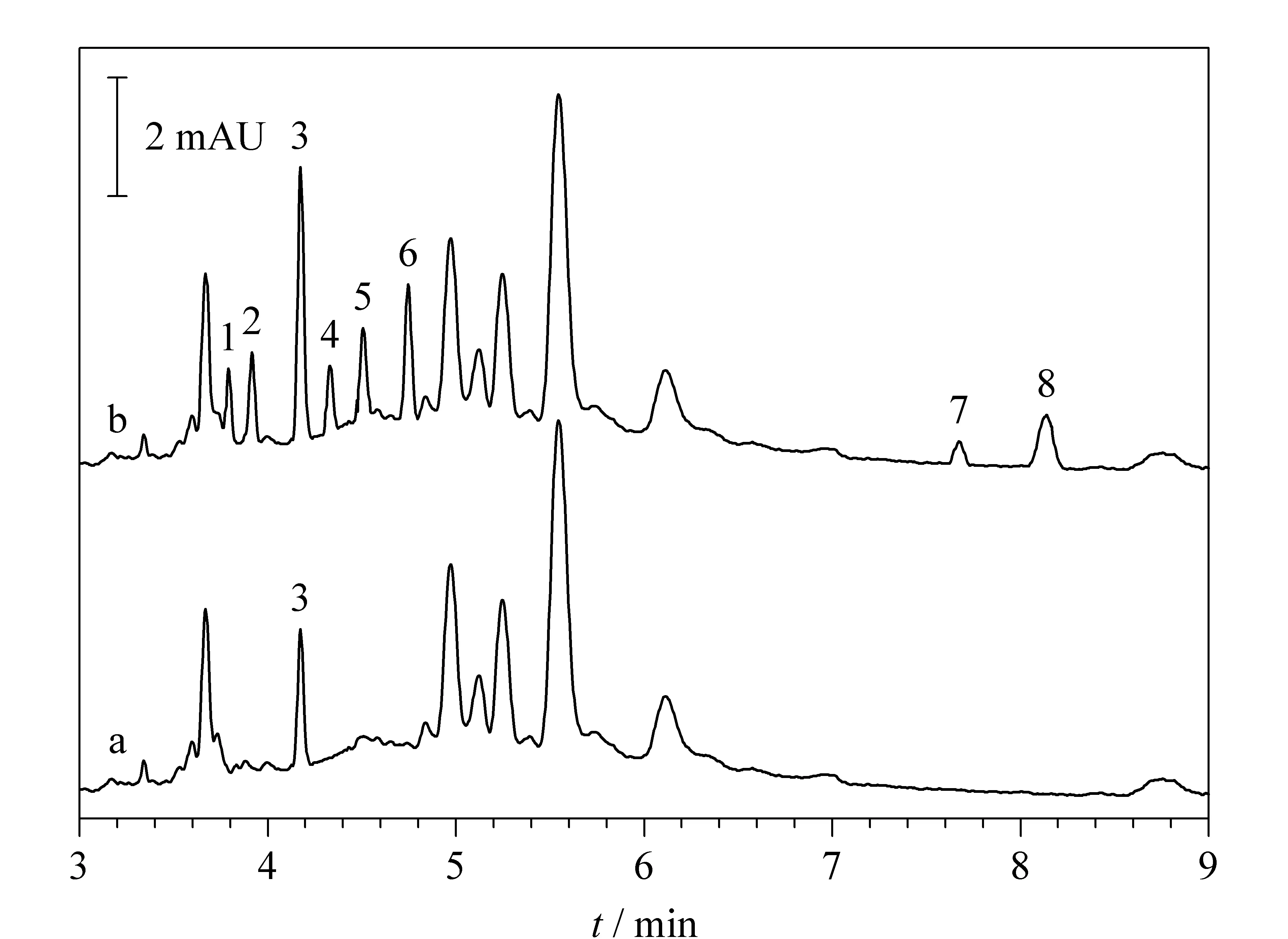
图4 麦芽中(a)未添加和(b)添加GAs标准品的电泳图Fig. 4 Electropherograms of GAs for (a) not spikedand (b) spiked standard samples in germinating wheat seeds Samples were spiked with 0.5 μg GA1, GA3, GA5, GA12, GA20, GA53, 0.7 μg GA4and 0.3 μg GA7. Peaks 1-8 and separation conditions are the same as in Fig. 2d.
3 结论
本文针对目前毛细管电泳法分离、测定赤霉素速度慢、效率不佳等问题,建立了PEO动态涂层反向EOF非水毛细管电泳快速分离8种内源性GAs的分析方法。所建方法简单、快速、稳定,能用于麦芽等实际样品中GAs的含量测定。该方法采用含醋酸铵-醋酸的甲醇-水缓冲溶液,预先考虑了质谱测定的需要,具有一定推广性。
[1] Mander L N. Nat Prod Rep, 2003, 20(1): 49
[2] Hedden P, Thomas S G. Biochem J, 2012, 444: 11
[3] Shani E, Weinstain R, Zhang Y, et al. Proc Natl Acad Sci U S A, 2013, 110(12): 4834
[4] Ayele B T, Magnus V, Mihaljevic S, et al. J Plant Growth
Regul, 2010, 29(2): 194
[5] Wang L, Wu Q, Duan C F, et al. Chinese Journal of Chromatography, 2011, 29(9): 923
王璐, 吴倩, 段春凤, 等. 色谱, 2011, 29(9): 923
[6] Urbanova T, Tarkowska D, Novak O, et al. Talanta, 2013, 112: 85
[7] Li D, Guo Z, Chen Y. Mol Plant, 2016, 9: 175
[8] Zhang X N, Lu M H, Xu L F, et al. Chinese Journal of Chromatography, 2015, 33(8): 786
张晓娜, 卢明华, 徐林芳, 等. 色谱, 2015, 33(8): 786
[9] Ge L Y, Peh C Y C, Yong J W H, et al. J Chromatogr A, 2007, 1159(1/2): 242
[10] Ge L Y, Yong J W H, Tan S N, et al. Electrophoresis, 2008, 29(10): 2126
[11] Tan S N, Yong J W H, Ge L Y, Chromatogr, 2014, 1(4): 211
[12] Belder D, Husmann H, Warnke J. Electrophoresis, 2001, 22(4): 666
[13] Vayaboury W, Kirby D, Giani O, et al. Electrophoresis, 2005, 26(11): 2187
Rapid determination of micro gibberellins by non-aqueouscapillary electrophoresis with reversed electroosmotic flow
GUO Zhenpeng1, WANG Xiaoyu3, CHEN Yi1,2*
(1.CASKeyLaboratoryofAnalyticalChemistryforLivingBiosystems,InstituteofChemistry,ChineseAcademyofSciences,Beijing100190,China; 2.BeijingNationalLaboratoryofMolecularScience,Beijing100190,China; 3.ZhengzhouTobaccoResearchInstituteofChinaNationalTobaccoCorporation,Zhengzhou450001,China)
A non-aqueous capillary electrophoresis (NACE) method for the rapid determination of micro gibberellins (GAs) was established. Dynamically poly(ethylene oxide) coated capillary was used, and electroosmotic flow (EOF) was reversed by using positive ions and adjusted by regulation the types and concentrations of the positive ions, running buffer, and pH of the buffer. With a buffer of 95% (v/v) methanol containing 10 mmol/L ammonium acetate at an acidity of 0.08% (v/v) acetic acid, the EOF was successfully reversed to separate the eight GAs in less than 10 min. Its applicability was validated by the determination of GAs in germinating wheat seeds, with relative standard deviations (RSDs) ≤2.1% (intra-day) or ≤4.3% (inter-day) for migration times, and RSDs ≤4.5% (intra-day) or ≤6.9% (inter-day) for peak areas. The limits of detection (S/N=3) were in the range of 1.10-2.20 mg/L, with correlation coefficients (r2) of 0.998 2-0.999 3. The recoveries of the spiked samples were between 87.2% and 93.5%. The established method is simple, rapid, stable, and compatible with mass spectrometry, so it is valuable to be further studied.
non-aqueous capillary electrophoresis (NACE); electroosmotic flow (EOF); dynamic coating; gibberellins (GAs)
10.3724/SP.J.1123.2016.08042
2016-08-31
国家自然科学基金项目(21235007,21475136,91117010).
Foundation item: National Natural Science Foundation of China (Nos. 21235007, 21475136, 91117010).
O658
:A
:1000-8713(2017)01-0065-05
*通讯联系人.Tel:(010)62618240,E-mail:chenyi@iccas.ac.cn.

