滴滴涕污染土壤的生物修复技术
孙丽娜, 吕良禾, 张鸿龄
(沈阳大学 污染环境的生态修复与资源化技术实验室, 辽宁 沈阳 110044)
滴滴涕污染土壤的生物修复技术
孙丽娜, 吕良禾, 张鸿龄
(沈阳大学 污染环境的生态修复与资源化技术实验室, 辽宁 沈阳 110044)
依据国内外近10年来有关滴滴涕(DDT)污染土壤生物修复研究的成果,综述了被滴滴涕污染土壤的物理、化学、生物降解途径、机理及其优缺点,并从植物、微生物修复角度,进一步阐述了植物与微生物联合作用促进污染土壤中DDT降解的途径、机理及其应用,并讨论了植物-微生物联合修复今后的研究重点.
滴滴涕; 土壤; 植物修复; 微生物
土壤是生命赖以生存的物质基础,人类的一切生命活动都离不开土壤.长期以来,随着经济的快速发展及人口数量的不断增长,对作物产量的需求也日益增加,导致肥料和农药的施用量不断增大.虽然自20世纪80年代起,滴滴涕、七氯、氯丹等杀虫剂已停止生产使用,但使用期间所造成的严重污染短期内仍无法消除.据统计,我国每年农药的使用量达(50~60)万t,农药喷洒过程中约有40%~50%会落在土壤表层,20%~30%直接进入大气, 10%~20%粘附于植物表面,随后随着挥发和雨水淋洗等途径再次进入农田.中国约有1 600万hm2农田土壤受到农药污染,约16%~20%的农产品中农药超标.随着工业化和城市化进程的飞速发展,环境中DDT类有机污染物的排放量也在持续增加.
目前,国内外对重金属农田污染研究较多,而对于有机氯农药DDT农田污染治理方面的研究较少,其他研究多是针对DDT污染源的确定以及污染情况的调研,对合适的治理机制和有效的修复技术不够重视,而微生物-植物联合修复是目前最有发展潜力的一种土壤修复技术.
1 滴滴涕污染现状及危害
有机氯农药(OCPs)由于毒性强烈、稳定性强和难以降解的特性,在土壤中的危害已成为一个亟待重视和解决的问题.据悉,全国至少有(1 300~1 600)万hm2耕地受到农药污染,污染状况与农药施用地区的自然条件和农药本身的理化性质息息相关[1].农业部的调查结果表明,高达31.1%的蔬菜存在农药超标现象,且DDT的检出率较高[2].经过生物自然降解,DDT在我国大部地区的残留量均有所下降,但由于其难降解性和高生物富集性,迄今为止DDT的残留量仍维持在较高的水平,严重威胁农产品质量安全.
近年来,我国农产品因有机氯农药污染所引发的贸易纠纷逐年上升,因DDT超标所导致的中药和农产品出口受阻事件也较频繁,农产品安全已刻不容缓[3].
2 滴滴涕污染土壤的修复研究动态
我国滴滴涕污染土壤修复技术的研发历程分为 3个阶段:①20世纪70~80年代及以前,土壤治理方式为物理修复,但物理法能量消耗高,需要专门设备;②20世纪90年代,土壤治理方式为化学、物理修复,但化学法处理破坏性大,土壤团粒结构难以保全,且化学、物理修复均存在二次污染问题;③21世纪以来,生物修复技术逐渐成为我国污染土壤修复技术体系的主角.自20世纪90年代植物修复技术兴起以来,生物修复技术已成为应用最广、发展最快、研究最多的修复技术之一.对DDT污染土壤的生物修复研究工作主要集中在以下方面.
2.1 滴滴涕的生物可降解性
微生物主要通过共代谢降解 DDT,共代谢机制为还原性脱氯,主要表现形式为DDT 烷基上的氯在还原性脱氯酶的作用下以氯化氢的形式脱去.在好氧条件下DDT主要生成DDE,在厌氧条件下,DDT 通过脱氯作用生成DDD,且都伴随有二氧化碳产生[4].国内外有许多学者报道过有关的微生物降解情况,主要有粘质沙门氏菌、铜绿假单胞菌、无色杆菌、产碱杆菌等.当今环境化学研究的趋势之一就是根据这种原理修复沉积物和土壤有机污染.
2.2 降解滴滴涕的微生物种群的筛选与驯化
滴滴涕高效降解菌株的筛选和构建,是微生物修复技术首要解决的问题,DDT因其高生物毒性、低生物可利用性和环境持久性被称之为持久性有机污染物.细菌具有很强的环境适应能力,且一些细菌在长期的适应过程中发生了基因突变,进化出了适应新环境的能力,这就是自然的驯化和选择过程[5].
2.3 滴滴涕生物降解的环境因素
外部环境因素的改变对微生物的生长和降解能力有很大影响,如pH值、水分含量、氧含量和温度等,这些自然因素在环境中处于持续变化状态,对微生物的降解能力将产生直接影响.绝大部分微生物的pH值范围均界于6~8之间,也是生物修复应用和研究最集中的范围.由于设施农业土壤环境复杂多变,很多微生物受外界环境的影响而呈碱性或酸性,为提高设施农业土壤的修复效率,可对土壤的pH值进行调整,且效果显著.
温度的影响主要有两方面,一方面微生物的生长和代谢受温度直接影响,另一方面温度可以改变污染物的理化性质,间接影响微生物的生长和代谢进程[6-7].通常20~40 ℃时最适宜微生物的生长和代谢,温度过高或过低都可能削弱微生物的代谢活性和生长活性,朱丹等研究表明温度对环境因素的影响高于pH值[8].
土壤类型在生物修复技术的应用中往往被忽略,却是修复效果的一个关键性影响因素,土壤类型决定了土壤的渗透性,而渗透性的强弱决定了生物修复能否成功,如易形成土壤团块的黏质土不适合进行生物修复,而难以结块的砂质土适于生物修复.
2.4 生物修复中的协同效应
为增强修复效果,可以利用化学-生物反应的协同作用,如某些化学处理常伴随生物修复同时进行.共代谢的营养问题对DDT降解菌而言至关重要,因此共代谢营养物质是微生物修复DDT污染土壤中的关键因素.Golovleva等研究发现,向土壤中施入甘油和十六烷可加快DDT的降解速率.Gray等研究发现木屑、稻草、旧报纸、鸡粪肥料等有机废弃物可刺激土壤中的土著微生物,提升DDT的降解率.而添加有机废弃物进行生物堆置处理的土壤,如交替使用好氧及厌氧条件进行处理,可以去除95%以上的DDT污染物.
2.5 生物修复机理研究
生物修复技术处理滴滴涕污染土壤,降解机理主要有两方面:一方面土壤中的有机化合物具有生物可降解性;另一方面土壤中的微生物存在代谢和产生酶的功能,可以对土壤中的有机化合物进行转化和降解[9].
3 生物修复类型
利用植物吸收或微生物(如真菌、细菌)去除有机污染物的修复是生物修复,与物理化学修复相比,生物修复成本低廉、操作简单、不易产生二次污染,因而受到广泛关注[10].
3.1 植物修复
植物修复是一种利用植物的固定、提取、过滤、降解、挥发等作用去除有机污染物或将其转化为无毒物质的修复技术,是一项经济、有效的土壤有机污染治理方法.土壤中的DDT经植物一系列生理、生化作用得以净化.其生理、生化作用主要有吸附作用、吸收作用、降解作用、转移作用、挥发作用和超积累等,在降解和清除环境中有机污染物的同时,植物对DDT的去除还可以通过根际微生物的协同作用实现.植物修复技术具有经济、实用和美观等特点,植物修复是一种经济、安全、有效的土壤有机污染治理技术.
3.1.1 修复植物的选择
植物种类的筛选是影响植物修复效果的重要因素.通常分枝顶生根覆盖表面积大的植物对土壤中滴滴涕的积累和降解速率更快,含有更多过氧化氢酶、酚氧化酶、抗坏血酸氧化酶等具有特异降解功能氧化酶的植物,对滴滴涕的去除也有更明显的促进作用.且无论是分枝顶生根表面积还是特异性降解酶,单子叶植物均强于双子叶植物,因此单子叶植物多比双子叶植物的降解率高,如Jason研究发现同为南瓜属的西葫芦和南瓜对DDE的吸收量相差两个数量级,其中南瓜对DDE的吸收能力较强.而在修复植物的选择中,植物的某些生理特征也可以作为植物选择的标准,如植物的保水能力、根系活力、生长速率和叶绿素等.Huang等研究指出高羊茅草具有较高的含水量和根生物积累量,叶绿素含量水平和叶绿素a/b值维持在较高的水平,对修复植物的生长极为关键.植物修复体系中须根体系同样是一项重要的评价标准,更强大的须根具有更大的表面积,能扎入更深的土壤,提供更多的营养,选择适宜的植物可以有效提高植物修复的效果[11].
3.1.2 植物修复土壤有机污染物的机理
植物修复土壤有机污染物的主要机制有:植物直接吸收有机污染物;植物释放酶和分泌物降解有机污染物;植物强化根际微生物的降解三大方面.
(1) 植物直接吸收有机污染物.植物从土壤中直接吸收滴滴涕,是植物去除土壤中滴滴涕的主要机制之一,主要包含固定、转运、吸收、挥发和降解等.植物有两种吸收方式分别是主动吸收和被动吸收,有机污染物从土壤中进入植物体的途径也有两种:一种是利用植物地上部分吸收空气中的污染物,另一种是利用植物根系直接从土壤中吸收污染物.这两种途径均可降低土壤中DDT的含量.而DDT蓄积于植物体内后,需对收获植物进行处理,避免二次污染.安凤春研究了10种不同植物,发现它们均能不同程度对滴滴涕进行吸收;植物的体内降解主要是通过酶反应完成的,这是继DDT转化后植物脱毒的又一重要机制,Mo等研究墨西哥类蜀黍、黑麦草和玉米等植物,发现墨西哥类蜀黍对滴滴涕的转移率最高,可达70.3%[12];植物的挥发作用,是将土地中的滴滴涕污染物吸收进入植物体内,再将其中可挥发性物质释放进入大气.
(2) 植物释放酶和分泌物去除土壤有机污染物.根系分泌物(rootexudates)是植物在根系活动中向外界环境分泌的各种有机化合物的总称.滴滴涕大量蓄积于植物根际,由于滴滴涕具有疏水性,难以被植物根系转运和吸收,而根际释放的分泌物可以改变滴滴涕的亲水性,根际分泌物通常在此类有机污染物修复中占主导作用.此外, 植物根系分泌的酶,包括大量降解酶, 如硝基还原酶、脱卤素酶、腈水解酶、过氧化氢酶和漆酶等,这些酶在土壤中可以维持较高的降解活性,为DDT的降解提供帮助.
(3) 根际强化微生物对有机污染物的矿化作用.特殊的环境条件促使根际成为植物修复滴滴涕污染过程中最活跃的区域,生态学重要的研究内容之一就是研究根系分泌物对根际微生物的影响.结果表明根际与非根际微生物种群间有显著差异,证实了植物根际强化微生物的矿化作用[13].某些与植物形成共生作用的菌根真菌在土壤微生物作用下,将土壤中的有机态DDT污染物转化为无机态化合物,去除在普通环境条件下,不能被微生物降解的DDT.
植物修复的优点是可以大面积修复、耗资低廉、不易产生二次污染等,缺点主要有超富集植物生物量的限制、生长期的限制、根系的限制、超富集植物的筛选及收获植物的处理等.
3.2 微生物修复
微生物修复指微生物利用有机污染物为唯一碳源和能源,或与其他有机物质进行共代谢等方式进行污染修复的技术[14].
3.2.1 专性降解菌
按照菌种的产生途径对滴滴涕降解菌进行分类,主要有外来菌、土著菌和基因工程菌.受环境条件的限制,虽然某些土著菌具有降解滴滴涕的能力,但由于其在种群和数量上的劣势,土著菌往往生长缓慢、培养期较长、抗干扰能力较弱且降解活性极易受污染物影响,对滴滴涕污染土壤的修复效果不明显.而基因工程菌发展的最大问题在于安全的不确定性,国际上对是否应用和发展这项技术仍有争论,导致基因工程菌在实际应用中受到诸多限制.与之相比,从DDT污染土壤中分离出专性降解菌更为实用,有研究表明,与依赖外源微生物降解滴滴涕污染土壤的修复技术相比,提升土著微生物活力的方法更加经济、科学和安全[15].
3.2.2 植物根际促生菌
植物根系对微生物的强化作用主要体现在两方面:一方面为微生物提供氧气,保证微生物在根系区域的好氧作用;另一方面为微生物提供营养,保证根际各菌群正常的生长繁殖,并刺激降解微生物增强其降解能力.有研究表明在种类和数量方面,非根际微生物均与根际微生物不同.根际微生物以细菌为主,常见的有产碱杆菌、节杆菌、黄杆菌、色杆菌和假单胞菌等,绝大部分根际微生物具有降解能力.根际微生物的数量常高于非根际微生物,最高可达千倍(平板计数)[16].
4 滴滴涕污染土壤的植物-微生物联合修复
微生物修复是当今环境化学领域研究的热点之一,但微生物对环境变化的响应比较强烈,环境条件的改变能大大影响微生物的修复效果,因此单纯的微生物修复并非是解决滴滴涕污染的根本途径.上述微生物修复的缺点,植物修复可以避免,且随着研究的拓展与深入,人们发现植物也具有较好的修复效果,植物因易培养、来源丰富、具有较高的经济效益等优点而越来越受到重视,但高浓度的滴滴涕常对植物的生长产生抑制,一定程度上制约了植物修复的广泛应用.因此植物-微生物联合修复滴滴涕污染土壤是必然的发展趋势, 植物不但直接吸收滴滴涕,植物根系也为微生物生长提供了最佳场所,反过来,微生物的降解能力增强也使植物有更适宜的生长空间,这样的植物-微生物联合修复体系可以促进滴滴涕的降解、矿化如图1所示.
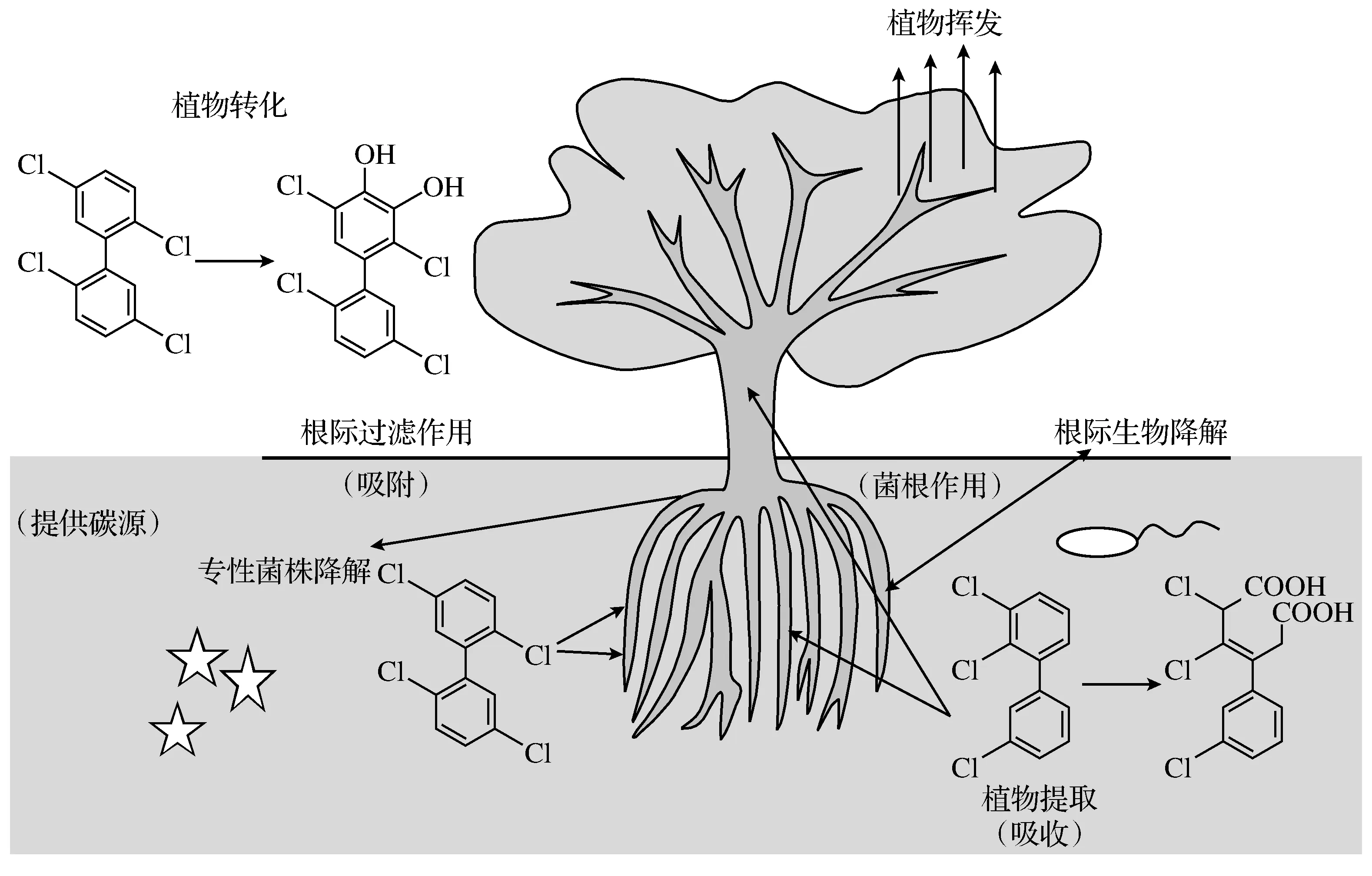
图1 植物与微生物联合降解DDT的途径及机理
4.1 植物与专性菌株的联合修复
滴滴涕具有较差的生物可降解性和较高的稳定性,这类有机污染物的降解方式通常是共代谢降解,且代谢活动所需的碳源和能源均需要其他化合物提供,滴滴涕难以成为微生物降解的唯一碳源和能源.近年来有关滴滴涕研究的报道,多是利用强化培养或本身具有高效降解作用的外源微生物去除土壤中的滴滴涕.将专性菌株施入种植植物的土壤中,植物为专性菌株的生长繁殖提供场所;植物根系分泌物为专性菌株的共代谢作用提供天然的碳源促进滴滴涕的降解,赵慧敏等研究发现外加碳源物质可以大大缩短滴滴涕脱氯降解的滞后,Bumpus等发现增加作为碳源的葡萄糖含量,白腐真菌对DDT的降解率有一倍的提升[17];根部脱落物和分泌物可为专性菌株提供营养物质,强化植物-微生物的联合降解作用,并刺激根际微生物的生长繁殖;根系产生的有机碳可以增强微生物对滴滴涕的矿化作用,并阻止滴滴涕向地下水转移[18].
微生物与植物根系共同作用提升滴滴涕降解菌的活性,有利于土壤中滴滴涕污染的降解;微生物通过降解作用提升了滴滴涕的生物可利用性,减轻了滴滴涕对植物的毒性,提高了植物对DDT的耐受性[19].植物-微生物联合修复技术弥补了单一修复方式的种种不足,使得植物-微生物联合修复可以应用于大面积田间修复. 近年来,DDT污染土壤田间修复的实例还较少,Glick指出,专性降解菌在实验室纯培养条件下可以达到高效降解效果,但无法在实际应用中达到同样的效果,植物与微生物联合修复技术是克服这种缺陷的有效手段[20].
目前,进行植物与微生物联合修复DDT污染土壤的相关研究还较少,杜丽亚等研究了不同pH下微生物对滴滴涕降解的影响,发现在微碱性条件下降解效果更显著[21].江春玉等从有机污染土壤中筛选出了一个超强抗性的细菌,通过土壤实验发现,其对印度芥菜和油菜的生长具有显著促进作用,与对照相比,其干重分别增加了21.14%~76.13%和18.10%~23.16%,证明高抗专性菌株的加入在植物修复有机污染土壤中显著提高了有机污染物的去除效率.因此,探寻具有植物促生作用的高抗专性菌株也是植物-微生物联合修复DDT技术的一个重要研究方向.
4.2 植物与菌根的联合修复
根际是植物根系直接影响的土壤范围,微生物繁殖所需的营养物质大多来源于植物生长过程中根的脱落物, 同时根系旺盛的代谢活动所产生的醇类、糖类、酶类和酸类物质可以调节根系区域土壤的水分条件、温度条件和微通气条件,Siciliano等研究发现当植物接种菌根后,其生物量及修复效率均有所提升.Gerhardt等研究表明经过上述物质调节的根系土壤比未经调节的非根际土壤更有利于微生物生长.其次,植物可以传输氧气进入根中,改善根际介质缺氧的条件,增强好氧微生物的活性,降解菌生长所需的碳源和氮源均可由植物根系分泌物提供,DDT在有植被覆盖的土壤中的降解速率高于在裸露土壤中的降解速率.
植物-微生物联合修复DDT污染土壤,修复作用主要在植物根际而非植物体内发生,因此,根际调控是研究植物修复DDT污染土壤技术的关键所在.根际区域可能的降解机理包括:①根系的生长可以改良土壤的理化性质;②增加微生物种群数量及多样性;③根系酶促反应降解DDT污染;④根系分泌物可以产生降解DDT污染物所需的代谢降解基质;⑤植物可以加速DDT污染物的腐殖化进程;⑥根系可以提高DDT污染物的迁移转化、植物吸收、土壤吸附等能力.微生物应用于植物-微生物联合修复的关键在于植物根际的高效降解菌的构建,保证降解菌存活、繁殖并且成长为优势菌群.较多研究表明降解菌能否在根系区域成功繁殖取决于土壤微生物的协同与拮抗作用,微生物的理化性质、pH和土壤温度对联合修复有很大的影响[22].Teng等研究表明苜蓿菌根真菌与根瘤菌存在协同增效作用,可以显著提高其修复能力,White也发现接种菌根真菌后各植物的富集量平均增加了4.4倍[23].有研究表明在实际应用中首要的问题是保持高效降解菌的存活率,繁殖速度及降解活性,其次是植物-微生物联合作用的协调统一和生态安全的控制.此外,由于植物菌根可以产生特异的酶和强酸,有研究认为植物酶为污染物转化的关键物质,这些酶和强酸具有强力的酶解和酸溶解能力,能为植物生长提供所需营养物质和促生长激素,植物联合菌根修复DDT的作用也倍受青睐[24-25].
5 展 望
植物-微生物联合技术通过扬长避短,最大限度地弥补了植物与微生物单独在滴滴涕污染修复中的不足.但由于滴滴涕污染土壤植物-微生物修复体系的构建相对困难,使得植物-微生物修复技术在实际应用中较少,今后还需进行以下工作:
(1) 筛选、驯化高效滴滴涕降解菌,土壤是微生物的源和库,加大滴滴涕降解微生物的筛选工作,对植物-微生物联合修复技术至关重要.
(2) 继续搜寻、筛选超富集植物,我国拥有丰富的野生植物资源,而到滴滴涕污染高的地区寻找超富集植物是筛选滴滴涕超富集植物的一条捷径.
(3) 不同植物与微生物匹配的结果差异较大,在植物-微生物联合降解滴滴涕的过程中,筛选出可以缩短修复进程的高效工艺组合,是植物-微生物联合修复技术研究中的一个新方向.
(4) 进行现场大田试验,现场验证植物-微生物联合修复滴滴涕污染的效果,为修复技术的推广和发展提供更为贴近事实、可信的实验数据,促进复合污染修复技术更早更快投入实际应用.
[ 1 ] 李彦荣,魏玉杰,谢忠清,等. 武威平原区饮用水源地土壤六六六和滴滴涕残留特征研究[J]. 干旱区资源与环境, 2016,30(4):197-202. (LI Y R,WEI Y J,XIE Z Q,et al. Characteristics of HCH and DDT residues in centralized drinking water sources soil of the Wuwei plain area[J]. Journal of Arid Land Resources and Environment, 2016,30(4):197-202.)
[ 2 ] SUDHARSHAN S,NAIDU R,MALLAVARAPU M,et al. DDT remediation in contaminated soils: a review of recent studies[J]. Biodegradation, 2012,23(6):851-863.
[ 3 ] 张鸿龄,孙丽娜,孙铁珩,等. 浑河水环境中多环芳烃(PAHs)污染来源解析[J]. 沈阳大学学报(自然科学版), 2013,25(2):87-91. (ZHANG H L,SUN L N,SUN T H,et al. Sources of polycyclic aromatic hydrocarbons (PAHs) in surface water from Hunhe River[J]. Journal of Shenyang University(Natural science), 2013,25(2):87-91.
[ 4 ] 姜海钰. 某DDT污染场地健康风险评价及修复技术筛选研究[D]. 青岛:青岛理工大学, 2014. (JIANG H Y. Health risk assessment for a brownfield contaminated by DDT and study on screening of remediation techniques[D]. Qingdao: Qingdao Technological University, 2014.)
[ 5 ] XU D H,LIU G X. The effects of DDT on the feeding, respiration, survival, and reproduction of Sinocalanus tenellus (Copepoda: Calanoida)[J]. Acta Oceanologica Sinica, 2014,33(9):133-138.
[ 6 ] 谢慧. 土壤中DDT和DDE的生物强化降解及对土壤微生物群落结构的影响[D]. 泰安:山东农业大学, 2013. (XIE H. Enhanced Biodegradation of DDT and DDE in the soil and its effect on the microbial community structure diversity of the soil[D]. Taian:Shandong Agricultural University, 2013.)
[ 7 ] LIU C Y,XU X H,FAN J L. Accelerated anaerobic dechlorination of DDT in slurry with hydragric acrisols using citric acid and anthraquinone-2,6-disulfonate(AQDS)[J]. Journal of Environmental Sciences, 2015,38(12):87-94.
[ 8 ] 朱丹,关健飞,张珊珊,等. 一株DDT降解菌的鉴定及其生物学特性[J]. 安全与环境学报, 2016,16(2):319-323. (ZHU D,GUAN J F,ZHANG S S,et al. Identification and biological characterization of a DDT degrading bacterium strain[J]. Journal of Safety and Environment, 2016,16(2):319-323.)
[ 9 ] 周际海,袁颖红,朱志保,等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015(2):343-351. (ZHOU J H,YUAN Y H,ZHU Z B,et al. A review on bioremediation technologies of organic pollutants contaminated soils[J]. Ecology and Environment Sciences, 2015(2):343-351.)
[10] 潘淑颖,马光辉,常勇,等. 土壤中DDT的微生物修复研究[J]. 安徽农业科学, 2013,41(3):1058-1060. (PAN S Y,MA G H,CHANG Y,et al. Study of microbes degradation of DDT in soil[J]. Journal of Anhui Agricultural Sciences, 2013,41(3):1058-1060.)
[11] 李思雯,李鹏,孙丽娜,等. 紫花苜蓿对DDT污染土壤的修复[J]. 沈阳大学学报(自然科学版), 2016,28(2):105-110. (LI S W,LI P,SUN L N,et al. Phytoremediation of DDT-contaminated soil by Medicago sativa[J]. Journal of Shenyang University(Natural Science), 2016,28(2):105-110.)
[12] 高艳菲. 六六六和滴滴涕污染场地土壤的修复[D]. 南京:南京农业大学, 2011. (GAO Y F. Remediation of contaminated soil with BHCs and DDTs[D]. Nanjing :Nanjing Agricultural University, 2011.)
[13] 张福金,何江,吕昌伟,等. 作物根系对土壤中老化HCH-DDT的富集作用[J]. 农业环境科学学报, 2014,33(7):1265-1272. (ZHANG F J,HE J, LYU C W,et al. Accumulation of aged HCH-DDT by corn(ZeamaysL.)and wheat(TriticumaestivumL.)roots from soils[J]. Journal of Agro-Environment Science, 2014,33(7):1265-1272.)
[14] 李登宇. 表面活性剂强化微生物修复DDT污染土壤研究[D]. 沈阳:沈阳大学, 2016. (LI D Y. Study on enhancing microbe remediation of DDT contaminated soil by surfactants[D]. Shenyang: Shenyang University, 2016.)
[15] 肖鹏飞,李玉文,KONDO R. Tween60和SDS强化白腐真菌修复DDT污染土壤[J]. 中国环境科学, 2015,35(12):3737-3743. (XIAO P F,LI Y W,KONDO R. Enhancement of Tween60 and SDS for bioremediation of DDT-contaminated soil by white rot fungus[J]. China Environmental Science, 2015,35(12):3737-3743.)
[16] NING Y Z,DANG H,LIU G L,et al. ATP-binding cassette transporter enhances tolerance to DDT in Tetrahymena[J]. Science China Life Sciences, 2015,58(3):297-304.
[17] 赵曦,黄艺,敖晓兰. 持久性有机污染物(POPs)的生物降解与外生菌根真菌对POPs的降解作用[J]. 应用与环境生物学报, 2007,13(1):140-144. (ZHAO X, HUANG Y, AO X L. Biodegradation of persistent organic pollutants (POPs) and potential capability of ectomycorrhizal fungi[J]. Chinese Journal of Applied & Environmental Biology, 2007,13(1):140-144.)
[18] MAO X,JIANG R,XIAO W,et al. Use of surfactants for the remediation of contaminated soils: a review[J]. Journal of Hazardous Materials, 2015,285:419-435.
[19] 王京秀,张志勇,万云洋,等. 植物-微生物联合修复石油污染土壤的实验研究[J]. 环境工程学报, 2014,8(8):3454-3460. (WANG J X,ZHANG Z Y,WAN Y Y,et al. Experimental study on plant-microbial remediation of oil-contaminated soil[J]. Chinese Journal of Environmental Engineering, 2014,8(8):3454-3460.)
[20] BETANCUR-CORREDOR B,PINO N J,CARDONA S,et al. Evaluation of biostimulation and Tween80 addition for the bioremediation of long-term DDT-contaminated soil[J]. Journal of Environmental Sciences, 2015,28(2):101-109.
[21] 杜丽亚,章钢娅,靳伟. 不同pH值条件下微生物和胡敏酸对有机氯农药降解的影响[J]. 江苏农业科学, 2005(5):120-123. (DU L Y,ZHUANG G Y,JING W. Influence of microorganism and humic acid on organochlorine pesticides under different pH conditions[J]. Jiangsu Agricultural Sciences, 2005(5):120-123.)
[22] 倪贺伟. 阴-非离子混合表面活性剂强化植物-微生物联合修复多环芳烃污染土壤[D]. 杭州:浙江大学, 2014. (NI H W. Enhancing plant-microbe associated remediation of PANS contaminated soil by anionic-nonionic mixed surfactants[D]. Hangzhou:Zhejiang University, 2014.)
[23] 黄化刚. 镉-锌/滴滴涕复合污染土壤植物修复的农艺强化过程及机理[D]. 杭州:浙江大学, 2012. (HUANG H G. Processes and mechanisms of agronomic factors for enhancing phytoremediation of Cd-Zn/DDTs co-contaminated soils[D]. Hangzhou:Zhejiang University, 2012.)
[24] WU Z P,WU W D,ZHOU S L,et al. Mycorrhizal inoculation affects Pb and Cd accumulation and translocation in pakchoi(BrassicachinensisL.)[J]. Pedosphere, 2016,26(1):13-26.
[25] HOSEINZADE H,ARDAKANI M R,SHAHDI A,et al. Rice(OryzasativaL.) nutrient management using mycorrhizal fungi and endophytic Herbaspirillum seropedicae[J]. Journal of Integrative Agriculture, 2016,15(6):1385-1394.
【责任编辑: 胡天慧】
Bioremediation Technology of DDT Contaminated Soil
SunLina,LyuLianghe,ZhangHongling
(Key Laboratory of Regional Environmental and Eco-remediation (Ministry of Education), Shenyang University, Shenyang 110044, China)
Based on the related studies domestic and abroad during last decade, the DDT contaminated soil, physical chemistry and biodegradation pathways, and the mechanism of their advantages and disadvantages are reviewed. From the angle of phytomicroorganism repair method, the phytomicroorganism further expounds together to promote the role of DDT contaminated soil degradation pathway, mechanism and application. Future reseach priorities in the phytomicroorganism repair are also discussed.
DDT; soil; phytoremediation; microorganism
2016-06-21
国家重点基础研究计划资助项目(2014CB441106); 辽宁省青年学者成长计划资助项目(LJQ2014134); 沈阳市科技计划资助项目(F14-133-9-00).
孙丽娜(1960-),女,辽宁北票人,沈阳大学教授,博士生导师.
2095-5456(2016)06-0446-07
X 52
A

