有氧运动训练前后循环血液中microRNA-146a和222的动态变化及其对心血管功能的调节作用
曲振琳,李 萌,刘 凯
(1.山东外贸职业学院基础教学部,山东青岛 266100;2.山东省青岛市第八人民医院心内科 266000;3.山东省青岛市市立医院运动医学康复中心 266000)
有氧运动训练前后循环血液中microRNA-146a和222的动态变化及其对心血管功能的调节作用
曲振琳1,李 萌2,刘 凯3
(1.山东外贸职业学院基础教学部,山东青岛 266100;2.山东省青岛市第八人民医院心内科 266000;3.山东省青岛市市立医院运动医学康复中心 266000)
目的 探讨有氧运动训练对运动员循环血液中特异微小RNAs(miRNAs)的影响,研究关键miRNA在心血管对运动适应过程中的调节作用。方法 选取10名大学新生作为研究对象进行为期8周的有氧运动训练,另外在有氧运动训练前后研究对象分别进行一次急性力竭运动。在训练前后的急性力竭运动中测定研究对象心血管功能相关指标,同时测定研究对象训练前后静息状态及急性力竭运动后循环血液中miR-133a、miR-21、miR-146a、miR-199a、miR-15a和miR-222 6个心血管功能相关的miRNA的水平。结果 有氧运动训练后,研究对象静息状态miR-146a、miR-222、miR-21、miR-15a和miR-199a水平均显著高于训练前(P<0.05);与有氧运动训练前后的静息状态相比,急性力竭运动使miR-146a和miR-222显著升高(P<0.05);有氧运动训练前,急性力竭运动使miR-21和miR-15a显著升高(P<0.05),但是有氧运动训练后急性力竭运动与静息状态的miR-21和miR-15a水平差异无统计学意义(P>0.05);训练前后静息状态和急性力竭运动中研究对象miR-133a水平差异无统计学意义(P>0.05)。进一步线性相关分析发现研究对象血浆中miR-146a表达量与VO2max水平呈正相关(r=0.842,P<0.01),miR-222表达改变量与EF改变量呈正相关(r=0.920,P<0.01)。结论 运动员循环血液中动态变化的miRNAs可以作为反映训练效果的标志物,miR-146a和miR-222在机体有氧运动训练的心血管功能适应起着生理调节介质的作用。
有氧运动;心血管;微RNAs
长期有氧运动训练会使运动员心血管系统发生适应性改变,包括心肌细胞线粒体合成增多、心肌细胞重构及心肌血管增生[1-3]。运动员训练过程中心血管的适应程度直接影响着训练的效果及能力的发挥。因此,改善和提高训练过程中运动员的心血管适应效果是运动医学专家关注的关键问题。虽然很多研究已经阐述了长期有氧运动训练对机体运动能力及身体健康的作用,但是造成这种适应改变的深层次细胞和分子机制还尚不明朗。
微小核糖核酸(miRNA)虽然只占人类基因总数的 2%,却调控着人类 30%以上的基因表达[4-5]。至今,研究者们在各物种中发现了7 597种miRNA,其中,在人体中发现并已经通过实验研究证实的就有 692 种[6]。对miRNA的发现使研究者们对基因表达调控有了全新的认识,目前已是生物科学领域颇受关注的焦点。近来,研究者在运动医学领域发现微小RNAs(microRNAs,miRNAs)在运动员对训练的适应过程中起着非常重要的细胞内固有调节作用,包括血管增生、炎性反应、线粒体代谢、心肌和骨骼肌收缩、组织细胞肥大等等[7-9]。Zhang等[7]研究认为循环血液中miRNAs在心血管疾病的发生和发展中起着重要的作用,同时某些miRNAs还可以作为预测心血管疾病的标志物和治疗的靶位点。Cheng等[10]发现运动可以使机体各组织和器官细胞缺血、缺氧产生应激,细胞应激可以诱导特异性miRNA的表达,这些miRNA可以被释放到血液循环中并随着血液循环到达靶器官,通过对靶基因的调控来影响机体对运动的适应。
本研究在前人研究的基础上猜测长期有规律的有氧运动可以诱导机体产生特异表达的miRNA,它们通过对靶器官的调节作用影响机体心血管功能。由此,首先通过阅读相关参考文献筛选出6个候选基因,它们是心肌和骨骼肌收缩相关的miR-133a[11]和miR-21[12],细胞缺氧适应相关的miR-146a[13]和miR-15a[6],血管生成相关的miR-199a[14]和miR-222[6]作为候选分析miRNAs,再用实时定量的PCR来测定机体在不同有氧运动训练前后它们的表达量。最后通过miRNA与心血管功能指标表达的相关分析,找出有氧运动训练后反映机体心血管适应能力的标志物,同时为研究机体对有氧运动训练适应的分子机制提供新的思路。
1 资料与方法
1.1 一般资料 研究对象为某大学2013年9月刚入学的非运动专业的男性新生,汉族。试验开始前排除以前有长期有氧运动训练史、有生活环境而导致的长期耐力性活动史、有家族性心肺疾病史及近期有服用合成类固醇代谢药物者,并无吸烟史、高血压且已熟练掌握蛙泳技术,可以能够进行长时间的有氧运动。共招收15名受试者参加,因试验的周期较长(持续8周),直至试验结束后,实际完成人数为10名。研究对象的年龄(19.3±0.5)岁,身高(174.3±7.8)cm,体质量(69.4±3.3)kg,在试验期间,研究对象未患任何疾病,没有进行其他任何大强度、大运动量的训练。本研究得到青岛大学附属医院伦理委员会的批准,受试者在试验前已得知本次研究的目的及内容,并且是自愿参加。
1.2 方法
1.2.1 有氧运动训练方案 有氧训练方案根据刘佳[15]、高欢[16]的训练研究方法适当调整进行。有氧运动持续时间为10周,其中有包括适应性训练2周和8周有氧运动训练。研究对象首先要通过严格的身体机能、泳姿与游泳水平等项目的筛选,检测合格者进入每周3次、共2周的适应性训练。由本次试验的负责人向受试者讲解自我控制运动强度、心率的测量、动作划频等与试验相关的问题并指导参与者尽快熟练掌握。研究对象要在训练前后的静息状态及随后的急性力竭运动后立即抽取4 mL静脉血,使用EDTA进行抗凝,将各装取血液样本的试管在4 ℃、2 000 g转速下离心10 min,分离试管上层的血浆于-80 ℃的冰箱里保存备用。所有参与者除了每次训练课必要的准备和整理活动之外,水中的有效锻炼量为1 200 m,运动强度为60%~70%心率储备(HRR),每次训练课前对研究对象进行安静时血压与心率的测量,以监测研究对象机体状态情况。研究对象除了这项运动训练,不再安排进行其他的运动训练。
1.2.2 生理学指标的测定
1.2.2.1 一般生理指标的测定 受试者身高、体质量、动脉血压、静脉血压和心率在训练前后各测定一次,具体标准参照中国国民体质测量标准要求实施,两次测试时的条件基本一致,并且由同一运动人体科学专业的研究生完成。
1.2.2.2 最大耗氧量(VO2max)和心血管功能指标的测定 有氧运动训练前后各进行一次急性力竭运动,同时在运动中测定研究对象VO2max及相应的心肺功能指标,其具体方法简要叙述如下:(1)调整跑台(Quasar 专业级运动跑台,德国)坡度为0,让所有受试者空腹在跑台上试跑5 min,以适应跑台的运动方式;(2)正式试验时,采用递增运动负荷的方式,0~1 min,跑台坡度保持为0,速度逐渐增加至7.5 km/h,受试者由自然散步逐步变为跑步,保持2 min;(3)从第3分钟开始,跑台速度增至10.0 km/h,坡度仍为0,保持2 min;(4)从第5分钟开始,跑台速度增至12.0 km/h,此速度为适宜的极限下负荷速度,坡度还为0,保持5 min;(5)从第10分钟开始,跑台速度增至12.5 km/h,同时跑台坡度增加2%;(6)从第11分钟往后,跑台坡度每分钟递增2%,并且速度每分钟递增0.5 km/h,直至受试者精疲力竭无法再坚持下去[17]。在此过程中分别使用气体代谢分析系统(Moxus,美国)测定摄氧量绝对值(VO2)、通气阈(VE),使用超声心动图仪(ALOKA,型号:SSC-290,中日合资)测定最大心率(HRmax)、心脏最大每搏输出量(SVmax)、心脏最大输出量(COmax)、心脏最大射血分数(EFmax)和心脏最短射血时间(ETmin)。在急性力竭试验中,当连续两次吸氧量变化在5%或在150 mL/min或2 mL·kg-1·min-1以下,呼吸商接近1.1,受试者筋疲力尽再也无法跟上跑台速度时的VO2即定义为VO2max。
1.2.3 实时定量PCR检测候选miRNA的表达量 选用6个候选miRNA,分别为miR-133a、miR-21、miR-146a、miR-199a、miR-15a和miR-222。每个研究对象不同时间点的血浆样品是用血浆提取总RNA,因为血浆是保存在-80 ℃中,因此在提取前应该首先在37 ℃的温度下解冻,随后采用TRIzol试剂(产品编号:R0016,碧云天生物技术有限公司)说明书的步骤,提取出血浆中的总RNA[18-24]。应用紫外分光光度计测定总RNA的吸光度A260值和A280值,用A260值计算总RNA浓度,计算A260/A280值检测提取的总RNA的纯度;最后用琼脂糖凝胶电泳进一步检测RNA质量。
接下来以每个样本血浆总RNA 2 μg作为初始模板,按照说明书配制总反应体系20 μL,应用第一链cDNA合成试剂盒(60906-10型,上海科兴生物科技有限公司)在核酸扩增仪(ABI9700型,上海智岩科学仪器有限公司)进行逆转录合成cDNA。随后取1 μL上述合成的cDNA为模板,以U6作为内参,每个检测样本做3个复孔,在实时荧光定量PCR系统(7900HT Fast,美国ABI公司)进行实时定量PCR,具体步骤严格按照说明书进行。试验中所用引物均由美国ABI公司合成。采用2-ΔΔCT法计算样品中miRNA的相对含量(倍数),CT代表PCR反应检测到的荧光强度值显著大于背景值的循环数,ΔCt代表样本Ct值减去同一种样本内参基因Ct所得的差值,ΔΔCt代表上述试验样本ΔCt减去对照样本ΔCt的差值。
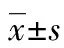
2 结 果
2.1 研究对象的基本情况 有氧运动训练前后,研究对象BMI和动脉血压方面差异无统计学意义(P>0.05);有氧运动训练后研究对象安静状态下静脉血压和心率(HR)均低于训练前,其中静脉血压下降了10.4%,HR下降了11.9%,差异均有统计学意义(P<0.05)。见表1。

表1 研究对象有氧运动训练前后的基本情况
2.2 有氧运动训练前后研究对象心血管功能状况 训练前后研究对象VE、HRmax、COmax和ETmin差异无统计学意义(P>0.05);训练后研究对象VO2max、SVmax和EFmax均高于训练前,差异均有统计学意义(P<0.05)。最大摄氧量的相对值训练前后分别为52.07±12.31、60.76±11.89,差异无统计学意义(P=0.126)。见表2。

表2 研究对象有氧运动训练前后急性力竭运动过程中心肺功能指标水平
2.3 有氧运动训练前后研究对象循环血液中miRNA动态变化情况 有氧运动训练前,研究对象急性力竭运动后循环血液中miR-146a、miR-222、miR-21和miR-15a表达水平与静息状态相比差异均有统计学意义(P<0.05),而miR-199a和miR-133a差异均无统计学意义(P>0.05)。在有氧运动训练后,研究对象静息状态下,循环血液中miR-146a、miR-222、miR-21、miR-15a和miR-199a表达水平均高于训练前(P<0.05),同时与训练前急性力竭运动后水平相当。miR-133a在训练前后静息状态下差异无统计学意义(P>0.05)。有氧运动训练后,研究对象进行急性力竭运动发现循环血液中miR-146a、miR-222表达水平均显著高于训练前后静息状态(P<0.05);miR-21、miR-15a和miR-199a表达水平均显著高于训练前静息状态(P<0.05),但是与训练后静息状态比较差异无统计学意义(P>0.05);miR-133a与训练前静息状态比较差异无统计学意义(P>0.05)。见表3。

表3 有氧运动训练前后研究者循环血液中miRNA水平
2.4 研究对象循环血液中miRNA与心血管功能指标的相关关系 结果发现,研究对象血浆中miR-146a表达量与其VO2max水平呈正相关(P<0.01),miR-222表达改变量与EF改变量呈正相关(P<0.01)。见图1、2。

图1 训练前后循环血液中miR-146a水平与VO2max的相关关系

图2 训练前后循环血液中miR-222改变量与EF改变量的相关关系
3 讨 论
本研究探讨了有氧运动训练对运动员循环血液中特异miRNAs的影响,以及关健miRNA在心血管对运动适应过程中的调节作用。结果发现运动员循环血液中动态变化的miRNAs可以作为反映训练效果的标志物,miR-146a和miR-222在机体有氧运动训练的心血管功能适应起着生理调节介质的作用。
Safdar等[25]在大鼠中研究发现miRNAs通过基因转录后调节作用参与了大鼠耐力训练中的骨骼肌适应。Nielsen等[26]在10名年轻健康男性中研究发现在12周耐力训练前急性运动会导致miR-133a和miR-1表达增加,但是12周耐力训练后研究者再进行急性运动,上述肌肉特异性miRNAs并没有发生变化。Davidsen等[8]发现抗阻训练会导致特异miRNAs在肌肉组织中富集从而使肌肉组织增生肥大。然而迄今为止,在有氧运动训练中探讨运动员循环血液中的miRNAs的调节作用和功能的研究很少。本研究发现运动会导致机体循环血液中miRNAs表达量发生变化,并且这种变化不仅与单次急性力竭运动有关,还和长期有氧运动训练有关联。
本研究中选择心肌和骨骼肌收缩相关的miR-133a和miR-21,细胞缺氧适应相关的miR-146a和miR-15a,血管生成相关的miR-199a和miR-222作为候选分析miRNAs,并且检测了它们在循环血液中的表达量。miR-133a表达量均较低,为低表达水平miRNAs;miR-15a、miR-146a和miR-222表达量均较高,为中等表达水平miRNAs;miR-21、miR-199a表达量最高,为高表达水平miRNAs。这与Mitchell等[27]在健康非运动员人群中检测到的范围是一致的,同时与Fichtlscherer等[28]在冠心病队列人群中检测的范围也在人群正常变异范围内一致。这就保证了笔者检测方法的正确性,为接下来分析不同时间点下相关miRNAs的动态变化打下了基础,虽然可能具有种族差异,但是仅在本研究数据反映来看,是非常一致的,这只是从一个侧面上支持与反映笔者本次的研究检测是正确的。研究中发现急性力竭运动使运动员循环血液中miR-146a和miR-222表达量显著增加,这可能是因为急性力竭运动使机体骨骼肌和心肌细胞缺氧产生应激,从而诱导机体骨骼肌或心肌细胞产生大量miR-146a,miR-146a可以通过结合到靶基因肿瘤坏死因子受体相关蛋白6(TRAF6)和白细胞介素-1受体相关激酶1(IRAK1)上抑制相关炎性蛋白的表达,从而发挥抗细胞缺氧造成的炎性反应[24];同时,会降低细胞周期调节蛋白基因的表达,从而在促进机体血管生成中发挥重要作用[29]。本研究还发现,研究对象血浆中miR-146a表达量与其VO2max水平显著正相关,这可能是因为受试者循环血液中miR-146a水平越高者更容易耐受运动造成细胞缺氧,同时促进机体产生适应性变化更大程度的携带氧。训练前后血浆中miR-222表达改变量与EF改变量显著正相关,这可能是因为miR-222在机体内起着促进血管增生的作用[29]。有氧运动训练后miR-222产生越多者,其越能促进心肌组织中血管增生,从而使心肌细胞获得足够的氧气和能量,这样心肌细胞在运动中收缩得更有力,因此EF也就越大。
通过检测有氧运动训练前后运动员静息和急性力竭状态下循环血液中miRNAs表达水平,笔者发现:运动员循环血液中miRNAs在生理应激和运动适应过程中呈现不同的表达水平。因此,运动员循环血液中动态变化的miRNAs可以作为反映运动适应和应激的标志物。miR-146a和miR-222在机体有氧运动训练的心血管功能适应起着生理调节介质的作用。这项研究结果为使运动员的心血管系统更好地适应高强度有氧运动训练及保护运动员免受急性运动损伤提供了新的思路和方向。
[1]UhlemannM,MöbiuswinklerS,FikenzerS,etal.CirculatingmicroRNA-126increasesafterdifferentformsofenduranceexerciseinhealthyadults[J].EuroJPrevCardiol,2014,21(4):484-491.
[2]KimKH,KimYJ,OhnJH,etal.Long-termeffectsofsildenafilinaratmodelofchronicmitralregurgitation:benefitsofventricularremodelingandexercisecapacity[J].Circulation,2012,125(11):1390-1401.
[3]OlverTD,FergusonBS,LaughlinMH.Molecularmechanismsforexercisetraining-inducedchangesinvascularstructureandfunction:skeletalmuscle,cardiacmuscle,andthebrain[J].ProgMolBiolTranSci,2015,135:227-257.
[4]HaM,KimVN.RegulationofMicroRNABiogenesis[J].NatureRevMolCellBiol,2014,15(8):509-524.
[5]YatesLA,NorburyCJ,GilbertRJC.ThelongandshortofmicroRNA[J].Cell,2013,153(3):516-519.
[6]田迎.血清及体液中微小核糖核酸的检测,表达及临床意义分析[D].南京:南京师范大学,2009.
[7]ZhangC.MicroRNAsinvascularbiologyandvasculardisease[J].JCardiovascTranslRes,2010,3(3):235-240.
[8]DavidsenPK,GallagherIJ,HartmanJW,etal.HighresponderstoresistanceexercisetrainingdemonstratedifferentialregulationofskeletalmusclemicroRNAexpression[J].JApplPhysiol,2011,110(2):309-317.
[9]WilliamsAH,LiuN,VanRooijE,etal.MicroRNAcontrolofmuscledevelopmentanddisease[J].CurrOpinCellBiol,2009,21(3):461-469.
[10]ChengY,ZhuP,YangJ,etal.Ischaemicpreconditioning-regulatedmiR-21protectsheartagainstischaemia/reperfusioninjuryviaanti-apoptosisthroughitstargetPDCD4 [J].CardiovascRes,2010,87(3):431-439.
[11]陆永光,李浪.微小核糖核酸与冠心病关系的研究进展[J].中国循环杂志,2010,25(6):484-486.
[12]钟建利,杨巍.微小分子核糖核酸与动脉粥样硬化发生发展的关系[J].心血管病学进展,2012,33(1):70-73.
[13]熊玮,董少红,袁建辉,等.微小RNA-146a影响血管平滑肌细胞增殖和凋亡的机制[J].中国组织工程研究,2012,16(20):3715-3719.
[14]许旭东,宋晓伟,荆清,等.微小RNA-199a对大鼠心肌肥厚的影响[J].中华心血管病杂志,2011,39(5):446-450.
[15]刘佳.游泳运动后血压反应及有氧运动的影响效果研究[D].北京:北京体育大学,2011.
[16]高欢.汉族优秀游泳运动员VDR基因SNP与有氧运动能力的关联研究[D].上海:华东师范大学,2007.
[17]席翼,张得保,王国军,等.跑节省化评价有氧耐力及其训练效果实验研究[J].中国运动医学杂志,2008,27(1):15-19.
[18]CarèA,CatalucciD,FelicettiF,etal.MicroRNA-133controlscardiachypertrophy[J].NatMed,2007,13(5):613-618.
[19]DewsM,HomayouniA,YuD,etal.AugmentationoftumorangiogenesisbyaMyc-activatedmicroRNAcluster[J].NatGenet,2006,38(9):1060-1065.
[20]王忠波,吴燕红,周琪,等.温泉游泳训练对飞行员心脏功能和大脑中动脉血流动力学指标的影响[J].中国疗养医学,2010,19(8):673-676.
[21]PolisenoL,TuccoliA,MarianiL,etal.MicroRNAsmodulatetheangiogenicpropertiesofHUVECs[J].Blood,2006,108(9):3068-3071.
[22]EulalioA,ManoM,DalFerroM,etal.FunctionalscreeningidentifiesmiRNAsinducingcardiacregeneration[J].Nature,2012,492(7429):376-381.
[23]UrbichC,KuehbacherA,DimmelerS.RoleofmicroRNAsinvasculardiseases,inflammation,andangiogenesis[J].CardiovascRes,2008,79(4):581-588.
[24]TaganovKD,BoldinMP,ChangKJ,etal.NF-kappaB-dependentinductionofmicroRNAmiR-146,aninhibitortargetedtosignalingproteinsofinnateimmuneresponses[J].ProcNatlAcadSciUSA,2006,103(33):12481-12486.
[25]SafdarA,AbadiA,AkhtarM,etal.miRNAintheregulationofskeletalmuscleadaptationtoacuteenduranceexerciseinC57Bl/6Jmalemice[J].PLoSOne,2009,4(5):e5610.
[26]NielsenS,ScheeleC,YfantiC,etal.MusclespecificmicroRNAsareregulatedbyenduranceexerciseinhumanskeletalmuscle[J].JPhysiol,2010,588(Pt20):4029-4037.
[27]MitchellPS,ParkinRK,KrohEM,etal.CirculatingmicroRNAsasstableblood-basedmarkersforcancerdetection[J].ProcNatlAcadSciUSA,2008,105(30):10513-10518.
[28]FichtlschererS,DeRosaS,FoxH,etal.CirculatingmicroRNAsinpatientswithcoronaryarterydisease[J].CircRes,2010,107(5):677-684.
[29]FanY,WeiW,ZhouC,etal.MiR-221/222promotehumangliomacellinvasionandangiogenesisbytargetingTIMP2 [J].TumourBiolJIntSociOncodBiolMed,2015,36(5):3763-3773.
Dynamic change of microRNA-146a and 222 in blood circulation before and after aerobic exercise and its regulation role to cardiovascular function
QuZhenlin1,LiMeng2,LiuKai3
(1.DepartmentofBasicEducation,ShandongForeignTradeVocationalCollege,Qingdao,Shandong266100,China; 2.DepartmentofCardiology,theEighthPeople′sHospitalofQingdaoCity,Qingdao,Shandong266000,China; 3.SportsMedicineandRehabilitationCenter,QingdaoMunicipalHospital,Qingdao,Shandong266000,China)
Objective To explore the effects of aerobic exercise training on the circulating miRNAs and their roles in cardiovascular adaption induced by aerobic exercise training.Methods Ten freshmen were enrolled.All subjects performed an 8 weeks swimming training.VO2maxand cardiovascular function were measured in acute exhaustive before and after the aerobic endurance training.The key circulating miRNs (miR-133a,miR-21,miR-146a,miR-199a,miR-15a and miR-222) were measured at rest and immediately following acute exhaustive exercise in competitive male freshmen before and after the aerobic training.Results Distinct patterns of c-miRNA response to exercise were observed and adhere to 4 major profiles:after aerobic exercise training,the levels of miR-146a,miR-222,miR-21,miR-15a and miR-199a at rest were significant higer than before training(P<0.05).The levels of miR-146a and miR-222 were up-regulated by acute exercise before and after aerobic exercise training(P<0.05).Before the aerobic training,acute exhaustive exercise increased miR-21 and miR-15a significantly(P<0.05),however,there was no difference between the miR-21 and miR-15a levels in acute exhaustive exercise and resting state after aerobic exercise training (P>0.05).There was no difference in the level of miR-133a between resting state and acute exhaustive exercise before and after training (P>0.05).Further linear correlation analysis showed that the miR-146a expression in plasma was significantly positively correlated with VO2maxlevel (r=0.842,P<0.01),the change of miR-222 expression in plasma before and after training was significantly positively correlated with EF (r=0.920,P<0.01).Conclusion MiRNAs can be used as a marker to reflect the effect of training,miR-146a and miR-222 play a role in physiological regulation of the cardiovascular function of aerobic exercise training in the body.
aerobic exercise;cardiovascular;microRNAs
曲振琳(1977-),讲师,硕士,主要从事体育教学与训练研究。
��·临床研究
10.3969/j.issn.1671-8348.2016.36.013
R
A
1671-8348(2016)36-5081-04
2016-07-18
2016-10-16)

