人源抗VEGFR-2/As2O3-PEG-PLA隐形纳米粒的构建及质量控制研究
钟志惟,王 栋,殷香保,邬林泉,黄长文,黄明文,周 凡
(南昌大学第二附属医院肝胆外科,南昌 330006)
人源抗VEGFR-2/As2O3-PEG-PLA隐形纳米粒的构建及质量控制研究
目的 探讨三氧化二砷(As2O3)纳米新剂型的制备和质量控制。 方法 以聚乙醇化聚乳酸(PEG-PLA)为载体材料,W/O/W型超声乳化制备As2O3纳米粒,同时偶联具有肝癌靶向作用的VEGFR-2,最终得到人源抗VEGFR-2/As2O3-PEG-PLA纳米粒。对其粒径分布、Zata电位、载药量和包封率进行测定,通过透射电镜(TEM)观察其表观形态,同时考察其体外释药和稳定性。选择24只肝癌裸鼠,随机分为VEGFR-2/As2O3-PEG-PLA组及As2O3-PEG-PLA组,通过尾静脉注射纳米粒,高效液相色谱法测定As2O3在两组裸鼠体内的分布;免疫组化及蛋白质印迹法(Western blot)检测血管内皮细胞生长因子(VEGF)表达量。结果 本实验制得的As2O3纳米制剂VEGFR-2/As2O3-PEG-PLA粒径为(141.9±13.2)nm,Zata电位为(10.2±1.1)mV;经TEM观察呈圆形或椭圆形颗,粒状、大小较一致,分散性较好;载药量为(5.51±1.83)%,包封率为(62.12±5.98)%。体外释放发现其具有缓释效果,半数释放时间t1/2分别为10 h;初步稳定性考察结果发现该制剂稳定性良好。与As2O3-PEG-PLA组比较,VEGFR-2/As2O3-PEG-PLA组中肿瘤、肝组织的As2O3浓度较高,心、血液、肾组织的As2O3浓度较低(P<0.05),且肿瘤组织中VEGFR-2阳性率及蛋白表达较低。结论 以PEG-PLA为载体材料制备得到As2O3纳米制剂,且偶联具有肝癌靶向作用的VEGFR-2,最终得到粒径分布均匀,包封率和载药量高,稳定性良好的纳米制剂,且初步证实在肝癌裸鼠体内具有良好的靶向作用。
砷剂;聚乙二醇类;聚乳酸;内皮细胞生长因子
三氧化二砷(As2O3)是中药砒霜的主要有效成分,长期以来被认为是一种致癌物。20世纪70年代,我国学者首先将其用于急性早幼粒性白血病的治疗,取得了显著临床疗效[1]。大量研究证实,As2O3能够抑制胃癌、肺癌、肠癌、胰腺癌、前列腺癌、卵巢癌多种实体瘤的生长,提示As2O3是一种广谱抗肿瘤药物,其抗肝癌作用更是受到人们的重视[2-4]。目前,国内外临床上应用As2O3治疗肿瘤的剂型主要是注射液,进入体内的As2O3由于血液循环的作用弥散至周围组织,给正常组织带来毒性和不良反应的同时降低了肿瘤部位的有效药物浓度。为了满足临床需要,需要将其制成高效低毒的纳米新剂型。
近年来,纳米技术越来越多地被应用于抗肿瘤药物的缓释治疗研究,取得了较好的效果[5]。纳米粒状态的肿瘤药物体内释放机制为缓慢释放,因此药物峰谷浓度波动减小,药物作用时间延长。近年来肝癌治疗的新方向为抗血管生成治疗,灵感来源于肝癌的富血管特性,肿瘤血管的生长有益于其生长。其中,血管内皮细胞生长因子(VEGF)是肝癌血管生成中最重要的因子之一,其通过与其受体(VEGFR)结合后自身磷酸化后激活细胞内信号传导通路实现其生物学效应[6-7],因此VEGFR-2可作为肝癌免疫靶向治疗及抗血管生成治疗的双重靶点。本文采用聚乙醇化聚乳酸(PEG-PLA)为载体材料,同时偶联具有肝靶向作用的VEGFR-2,制备As2O3纳米粒,并对其质量进行了控制,以期提高As2O3的疗效。
1 材料与方法
1.1 主要仪器与试剂 VCX800型超声波细胞粉碎机(SONICS公司),Allegra X-15R低温高速离心机(Beckman公司),Tec-10透射电子显微镜(Philips公司),Mastersizer 3000(Malvern公司),CO2培养箱(REVCO公司),As2O3(Sigma公司)。本实验室自制VEGFR-2-scFv(单链可变区片断);PEG-PLA(上海宝生),兔抗VEGFR-2多克隆抗体(美国Abcam公司),BCA试剂盒、兔抗GAPPDH单克隆抗体(碧云天生物技术有限公司)。人肝癌Bel 7402细胞株由南昌大学第二附属医院提供。
1.2 方法
1.2.1 制备As2O3-PEG-PLA纳米粒 W/O/W型超声乳化法制备As2O3-PEG-PLA纳米粒。(1)制备W/O初乳液:超声条件下将适量As2O3溶液加入到5 mL PEG-PLA二氯甲烷溶液中,后将少量Tween 80与Span 80混合乳化剂(5∶1)加入所得混合溶液中,超声(100 W,5 min)下使之均一稳定,获得W/O初乳液。(2)As2O3-PEG-PLA纳米粒制备:所得初乳液在超声条件(100 W,10 min)下滴加到50 mL O-羧甲基壳聚糖(O-CMC)水溶液中,获得W/O/W复乳液。所得复乳液室温下电磁搅拌(300 r/min)4 h以上,使有机溶剂完全挥发。此时所得混悬液以2 000 r/min离心5 min,弃去上清液保留沉淀物,用蒸馏水离心洗涤沉淀3次,除去未包埋药物,冷冻干燥所得沉淀,即As2O3-PEG-PLA纳米粒。
1.2.2 人源抗VEGFR-2/As2O3-PEG-PLA隐形纳米粒的制备 取As2O3隐形纳米粒与抗VEGFR-2单链抗体(质量比为3∶1),将二者溶于SBF溶液(pH=7.4),电磁搅拌下加入碳二亚胺(与单抗质量比为2∶1)溶液,4 ℃下搅拌2 h后离心分离,所得内容物经超声分散后采用去离子水洗涤3遍,经冷冻干燥所得粉状固体即As2O3-PEG-PLA纳米粒与抗VEGFR-2单链抗体的偶联物(抗VEGFR-2/As2O3-PEG-PLA隐形纳米粒)。抗VEGFR-2/As2O3-PEG-PLA隐形纳米粒纯化过程采用Sephadex G-200层析柱进行。
1.2.3 粒径分布及Zata电位 取VEGFR-2/As2O3-PEG-PLA粉末适量,加水稀释,用激光粒度仪测定纳米粒的平均粒径及分布,同时用Zata电位测定仪测定其Zata电位。
1.2.4 透射电镜(TEM)形态表征 用TEM观察载药纳米粒的结构。试样制作:把冷冻干燥后VEGFR-2/As2O3-PEG-PLA隐形纳米粉末加入到烧杯中,加入去离子水超声,然后将液体样品滴到已载膜的铜网上。晾干后于TEM下观察纳米粒子的大小和形貌。
1.2.5 载药量(DL)和包封率(ER)测定 砷含量测定采用氢化物原子荧光法。VEGFR-2/As2O3-PEG-PLA隐形纳米粉末微波消解后,酸性条件下加入硫脲-抗坏血酸和硼氢化钾,还原砷为AsH3[7]。二氯甲烷中溶于一定量的VEGFR-2/As2O3-PEG-PLA隐形纳米粒,后加入5 mL蒸馏水,充分混悬后静置1 h。混合2次分离收集的水相溶液,2 000 r/min离心5 min,取上清液测As2O3浓度。根据测试结果计算出纳米粒中的As2O3水平按公式:DL=Ws/Wp×100% 和 ER=Ws/Wt×100%计算。Ws为纳米粒中所含As2O3质量,Wp为所测纳米微粒质量,Wt为制备相应量纳米微粒所需As2O3质量。标准工作曲线:砷标准储备液,精密称取一定量的As2O3标准品,于容量瓶中,用适量氢氧化钾溶液溶解,用稀硫酸溶液调节pH至微酸性,最后用水定容。使用时,用水稀释成系列砷标准工作液,加入硫脲-抗坏血酸混合液和盐酸,用水定容至刻度并摇匀。放置10 min进样,绘制标准曲线。
1.2.6 体外释放 用动态透析法进行释药试验,用原子荧光分光光度法测量释药量。精密称取适量VEGFR-2/As2O3-PEG-PLA纳米粒装入透析袋内,加入一定体积的PBS(0.1 mol/L,pH 7.4)形成混悬液,扎紧后置于确定体积的PBS(0.1 mol/L,pH 7.4),置于(37.0±1.0)℃,80 r/min恒速搅拌,于设定的时间点取样,同时补加同体积的PBS(0.1 mol/L,pH 7.4)。测定不同时间点所取样品中As2O3浓度,计算得出累积释药百分数,并作出释放曲线图。
1.2.7 初步稳定性试验 VEGFR-2/As2O3-PEG-PLA胶体溶液不稳定,放置过程中粒子容易聚集,且包载的As2O3也可能从纳米粒中泄漏。选取低温4 ℃和室温25 ℃的条件下放置的VEGFR-2/As2O3-PEG-PLA胶体溶液,分别于1、2、3 d取样,计算载药量和渗漏率(LR)。LR=(W定期-W初始)/W总×100%。W定期为定期(不同时间点)测得游离药物量,W初始为试验初始游离药物量,W总为药物总量。
1.2.8 肝癌裸鼠模型的建立[8]人肝癌Bel 7402细胞株培养于含20%小牛血清的RPMI 1640培养基中,于37 ℃、5% CO2培养箱中培养,取处于对数生长期的细胞用于模型的建立。细胞密度为1×107/mL,于无菌操作台中将0.1 mL细胞悬液注射于4~6周龄的三级BALB/c雄性裸鼠右侧肩胛部,饲养2周,肝癌裸鼠模型即可建立成功。
1.2.9 肝癌裸鼠模型分组及处理[8]荷人肝癌裸鼠模型24只分成2组,每组12只,分别经尾静脉注射抗As2O3-PEG-PLA纳米粒、VEGFR-2/As2O3-PEG-PLA纳米粒。其中每组各6只给药后0.5 h处死,取血液、心、肝、肾、肿瘤等组织,用于As2O3浓度的测定。另外每组各6只给药后,在第21天处死,取肿瘤组织,免疫组化测定VEGF的表达。
1.2.10 高效液相色谱法(HPLC)检测As2O3在两组肝癌裸鼠组织中的分布实验 给药0.5 h后,裸鼠股静脉取2 mL血,分离获得血浆;处死裸鼠,取肿瘤、心、肝、肾等组织各2.0 g,研磨成匀浆;标本加内标液20 μL,后加甲醛∶氯仿(4∶1)混合液5 mL,进行HPLC分析,通过已测定的标准曲线进行计算获得As2O3浓度。色谱条件为流动相为甲醇-磷酸二氢铵-冰乙酸(70.0∶30.0∶0.5),流速1.0 mL/min[9]。
1.2.11 免疫组化检测VEGFR-2在肿瘤组织中的表达 取肿瘤组织,PBS冲洗干净后在10%甲醛溶液中过夜固定,石蜡包埋,切片,用免疫组化SP法检测VEGF的表达。操作过程:对切片加抗原修复液进行修复,室温冷却30 min后PBS冲洗2次,室温孵育10 min后滴加1%浓度的一抗,4 ℃孵育、PBS冲洗2次,每次5 min;滴加二抗,37 ℃孵育30 min后PBS冲洗2次,每次5 min,DAB显色后,流水冲洗,并经过复染,脱水,透明,最后树胶封片,于镜下观察。阴性对照选择PBS溶液。
1.2.12 蛋白质印迹法(Western blot)检测VEGFR-2在肿瘤组织中的表达 取肝组织,按比例加入RIPA(10 μg/mL)裂解液和蛋白酶抑制剂,超声破碎制成组织匀浆,将破碎后的组织匀浆放置于冰中30 min,使组织彻底裂解,每隔10 min置于涡旋仪中震荡30 s,40 min后,4 ℃ 10 000 r/min离心10 min,小心吸取上清,即可获得总蛋白。采用BCA试剂盒检测蛋白浓度。煮沸变性10 min,蛋白样品放置于-20 ℃冰箱中待测。各取20 μL蛋白样品上样,跑12% SDS凝胶电泳,后湿法转膜。含5%脱脂奶粉室温封闭1 h,一抗溶液孵育,4 ℃过夜;二抗溶液中室温孵育1~2 h。在凝胶成像系统中曝光。
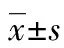
2 结 果
2.1 粒径分布及Zata电位VEGFR-2/As2O3-PEG-PLA平均粒径为(141.9±13.2)nm,呈正态分布,见图1。Zata电位为(10.2±1.1)mV。
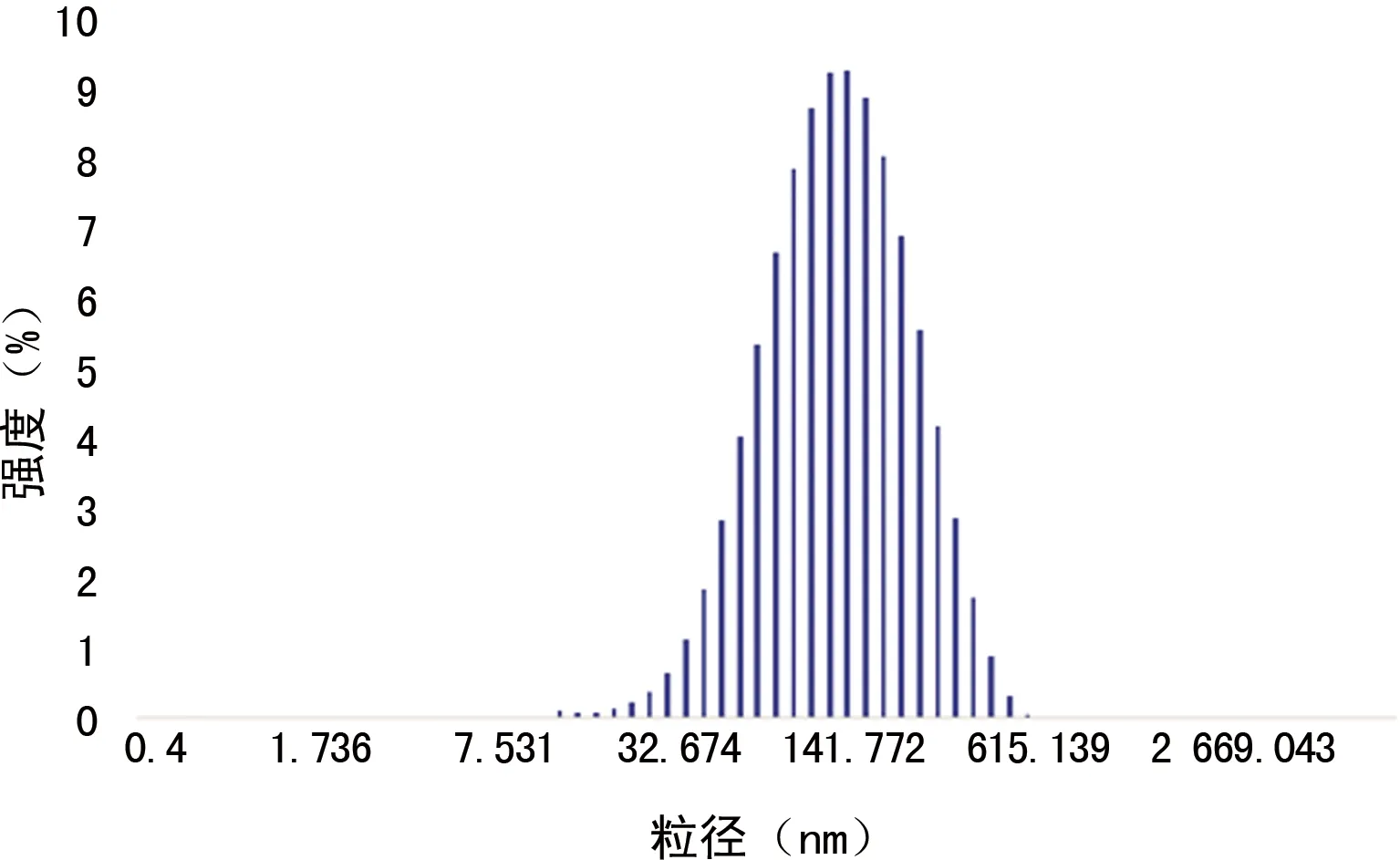
图1 VEGFR-2/As2O3-PEG-PLA平均粒径分布图
2.2TEM观察 本实验制备的VEGFR-2/As2O3-PEG-PLA纳米粒TEM下为圆形或椭圆形颗,大小均一,分散性好。见图2。

图2 VEGFR-2/As2O3-PEG-PLA纳米粒TEM图
2.3DL和ER测定 以荧光强度F为纵坐标,药物浓度C为横坐标建立标准曲线,得标准曲线方程F=100.76C+8.477 6(R2=0.999 7)。经计算,VEGFR-2/As2O3-PEG-PLA纳米粒的DL为(5.51±1.83)%,ER为(62.12±5.98)%。见图3。
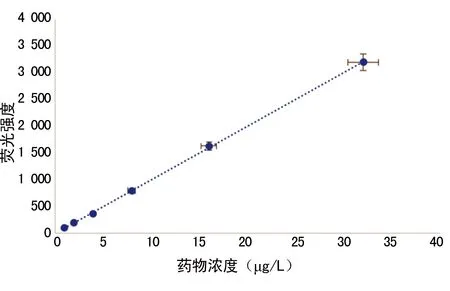
图3 As2O3标准工作曲线
2.4 体外释放试验VEGFR-2/As2O3-PEG-PLA纳米粒中As2O3释放缓慢,而游离As2O3在8h内已完全释放。As2O3和VEGFR-2/As2O3-PEG-PLA纳米粒的药物半数释放时间t1/2分别为120min和10h。见图4。
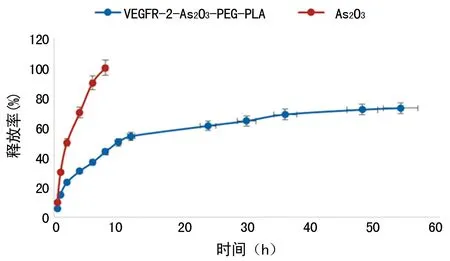
图4 VEGFR-2/As2O3-PEG-PLA纳米粒和As2O3体外释放曲线图
2.5 稳定性试验 观察3d内低温和室温纳米粒胶体溶液的外观形态未发生改变,无沉淀可见。随着时间推移,低温和室温条件下,VEGFR-2/As2O3-PEG-PLA纳米粒DL均呈降低趋势,LR不断上升,且室温条件下LR显著高于低温条件下。见表1。

表1 VEGFR-2/As2O3-PEG-PLA纳米粒DL和LR变化(%)
*:P<0.05,与低温条件下LR相比。
2.6As2O3在两组裸鼠体内的分布VEGFR-2/As2O3-PEG-PLA组肝癌裸鼠肿瘤、肝组织中的As2O3的浓度显著高于As2O3-PEG-PLA组,差异有统计学意义(P<0.05);VEGFR-2/As2O3-PEG-PLA组肝癌裸鼠血液、心、肾中的As2O3浓度显著低于As2O3-PEG-PLA组,差异有统计学意义(P<0.05)。见表2。
2.7VEGFR-2在肿瘤组织中的表达VEGFR-2在VEGFR-2/As2O3-PEG-PLA组中的阳性表达及蛋白表达显著低于As2O3-PEG-PLA组(P<0.05)。见图5。

表2 As2O3在两组裸鼠体内的分布
*:P<0.05,与As2O3-PEG-PLA组比较。

A:VEGFR-2/As2O3-PEG-PLA组;B:As2O3-PEG-PLA组。
图5VEGFG-2在肿瘤组织中的表达
3 讨 论
原发性肝癌是世界上最常见的恶性肿瘤之一,因其具有侵袭性强、生长速度快、治疗后易复发、易导致肝功能衰竭等特点,预后很差,其病死率在全球居第三位[10]。我国是肝癌的高发地区之一,每年有10多万人死于肝癌,占全球肝癌死亡人数的50%以上,在我国恶性肿瘤中居第二位。我国应用砷作为抗肿瘤药物历史悠久,上世纪末As2O3注射液正式通过临床审批,现被临床广泛应用且效果显著。As2O3抗肝癌作用从体内、外实验到临床应用晚期肝癌治疗的试验均取得令人鼓舞的效果,从而奠定了As2O3肝癌治疗的基础。目前应用临床上的As2O3注射液,给药后血药浓度升高快,生物利用度低,毒副反应多,严重者造成肾功能损害,患者生活质量显著降低,因此迫切需要一种不良反应少、毒副作用低的新型As2O3用于临床肝癌治疗。
纳米技术进行纳米载药可增强靶向性,降低毒副反应,从而显著提高药物疗效。本实验使用的主要辅料为PEG-PLA类高分子材料进行As2O3纳米制剂的制备,它具有良好的生物相容性,在药物递送方面具有独特的优势。有文献称PEG-PLA作为药物载体可承载一些水溶性差,半衰期短,毒副作用大的药物,具有有效提高药物的生物利用度,减少药物对全身毒副作用的优点[11]。本实验制得的As2O3纳米制剂VEGFR-2/As2O3-PEG-PLA粒径为(141.9±13.2)nm,呈正态分布,Zata电位为(10.2±1.1)mV,经TEM观察呈圆形或椭圆形颗,粒状、大小较一致,分散性较好,表明该剂型杀伤肿瘤细胞的重要途径之一是通过透过有缺陷的肿瘤毛细血管壁使抗肿瘤药物高浓度的积聚在肿瘤部位实现的。结果发现VEGFR-2/As2O3-PEG-PLA纳米粒的DL为(5.51±1.83)%,ER为(62.12±5.98)%。张乐等[12]以乳酸羟基乙酸共聚物为载体制备得到As2O3纳米粒,平均粒径为 178.2nm,ER为53.19%,DL为0.64%,低于本实验结果。药物体外释放结果发现,VEGFR-2/As2O3-PEG-PLA纳米粒体外具有缓释效果,药物半数释放时间明显延长,提示As2O3-PEG-PLA纳米粒可延长对肿瘤的作用时间,同时As2O3-PEG-PLA可以显著提高肿瘤细胞内As2O3浓度而降低正常组织中药物作用浓度,因此说As2O3-PEG-PLA纳米粒改变As2O3水溶性的同时改善其药代动力学。初步稳定性研究表明,As2O3-PEG-PLA纳米粒在低温4 ℃条件下,3d内LR小于10%,表明其具有可靠地稳定性。
VEGFR-2受体主要分布于肿瘤血管内皮表面及肿瘤细胞表面,介导VEGF在肿瘤新生血管的形成,对肿瘤血管的生成至关重要[13-14]。研究表明,VEGFR-2在肝癌组织中的阳性表达率高达60%~70%,而正常组织中VEGFR-2呈阴性或仅为低度表达[15-16]。本研究中,由于增加了实验室自制的具有肝靶向作用的靶头VEGFR-2,并把有靶头和没有靶头的纳米粒通过尾静脉注射到肝癌裸鼠,通过检测发现VEGFR-2/As2O3-PEG-PLA组中肿瘤、肝组织中的As2O3浓度高于As2O3-PEG-PLA组,血液、心、肾组织中的As2O3浓度低于As2O3-PEG-PLA组,充分说明制作的VEGFR-2/As2O3-PEG-PLA靶向作用显著。VEGFR-2/As2O3-PEG-PLA组肿瘤组织中VEGF的阳性表达低于As2O3-PEG-PLA组,说明自制的靶头VEGFR-2,可能具有显著的抗血管作用,从而可能达到肝癌细胞毒性治疗与抗血管生成治疗相结合的双重效果。
综上所述,本文以PEG-PLA为载体材料制备得到As2O3纳米制剂,且偶联具有肝靶向作用的VEGFR-2,最终得到粒径分布均匀,DL和ER高,稳定性良好的纳米制剂,且初步证实在肝癌裸鼠体内具有良好的靶向作用,并可能同时起到抗血管生成作用,为其肝癌机制研究和治疗提供了理论基础。
[1]CaiYX,MengFY,SunQX,etal.Invitroeffectofbortezomibaloneorincombinationwithharringtonineorarsenictrioxideonproliferationandapoptosisofmultidrugresistantleukemiacells[J].ZhonghuaXueYeXueZaZhi,2008,29(11):737-740.
[2]ChiuHW,TsengYC,HsuYH,etal.ArsenictrioxideinducesprogrammedcelldeaththroughstimulationofERstressandinhibitionoftheubiquitin-proteasomesysteminhumansarcomacells[J].CancerLett,2015,356(2PtB):762-772.
[3]UdensiUK,TackettAJ,ByrumS,etal.Proteomics-basedidentificationofdifferentiallyabundantproteinsfromhumankeratinocytesexposedtoarsenictrioxide[J].JProteomicsBioinform,2014,7(7):166-178.
[4]WangGZ,ZhangW,FangZT,etal.Arsenictrioxide:markedsuppressionoftumormetastasispotential by inhibiting the transcription factor Twist in vivo and in vitro [J].J Cancer Res Clin Oncol,2014,140(7):1125-1136.
[5]Debotton N,Parnes M,Kadouche J,et al.Overcoming the formulation obstacles towards targeted chemotherapy:in vitro and in vivo evaluation of cytotoxic drug loaded immunonanoparticles [J].J Control Release,2008,127(3):219-230.
[6]Inoue K,Torimura T,Nakamura T,et al.Vandetanib,an inhibitor of VEGF receptor-2 and EGF receptor,suppresses tumor development and improves prognosis of liver cancer in mice [J].Clin Cancer Res,2012,18(14):3924-3933.
[7]Jayasinghe C,Simiantonaki N,Habedank S,et al.The relevance of cell type-and tumor zone-specific VEGFR-2 activation in locally advanced colon cancer [J].J Exp Clin Cancer Res,2015,34(1):42.
[8]殷香保,邬林泉,黄跃英,等.三氧化二砷聚乙二醇-聚乳酸偶联人源抗血管内皮细胞生长因子受体2隐形纳米粒的抗肝癌机制探讨[J].中国全科医学,2015,18(23):2805-2809.
[9]殷香保,邬林泉,黄长文,等.阿霉素纳米-VEGFR2单抗交联物的抗肝癌作用[J].广东医学,2014,35(19):2972-2975.
[10]Wang YX,De Baere T,Idee JM,et al.Transcatheter embolization therapy in liver cancer:an update of clinical evidences [J].Chin J Cancer Res,2015,27(2):96-121.
[11]赵刚,苏庆,李静,等.聚乙二醇-聚乳酸嵌段共聚物及其微粒给药系统的研究进展[J].中国新药杂志,2011,20(1):36-40.
[12]张乐,周世文.三氧化二砷PLGA纳米粒的制备及工艺优化[J].第三军医大学学报,2006,28(11):1249-1251.
[13]Moyle CW,Cerezo AB,Winterbone MS,et al.Potent inhibition of VEGFR-2 activation by tight binding of green tea epigallocatechin gallate and apple procyanidins to VEGF:relevance to angiogenesis[J].Mol Nutr Food Res,2015,59(3):401-412.
[14]Iacovelli R,Sternberg CN,Porta C,et al.Inhibition of the VEGF/VEGFR pathway improves survival in advanced kidney cancer:a systematic review and meta-analysis [J].Curr Drug Targets,2015,16(2):164-170.
[15]戴丽娟,鄢成伟,李淑珍,等.抗VEGFR2/抗CD3双特异单链抗体的表达及初步活性检测[J].细胞与分子免疫学杂志,2011,27(8):883-886.
[16]马满玲,郭美华,杨丽杰,等.三氧化二砷新剂型的研究进展[J].中国药学杂志,2011,46(7):489-492.
Preparation and quality control of human anti-VEGFR-2/As2O3-PEG-PLA nanoparticle*
ZhongZhiwei,WangDong,YinXiangbao△,WuLinquan,HuangChangwen,HuangMingwen,ZhouFan
(DepartmentofHepatobiliarySurgery,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
Objective To explore the preparation and quality control of As2O3nanoparticle.Methods PEG-PLA was used as the vector material to prepare As2O3nanoparticle with ultrasonic emulsification method,and the VEGFR-2 was coupled to obtain VEGFR-2/As2O3-PEG-PLA nanoparticle.The particle size distribution,Zata potential,loading efficiency(LE),encapsulation efficiency(EE),drug release in vitro and stability was determined,and morphological characteristics was observed by transmission electron microscope(TEM).Tweety-four hepatocellular carcinoma nude mices were randomly divided into VEGFR-2/As2O3-PEG-PLA nanoparticles group and As2O3-PEG-PLA nanoparticles group,by tail vein injection of nanoparticles.High performance liquid chromatography was used to determine content of As2O3.After 21 d,six nude mices in each group were killed,and the immunohistochemistry and western blot method was used to detect the expression of VEGFR-2.Results The particle size of VEGFR-2/As2O3-PEG-PLA was determined to be (141.9±13.2)nm,Zata potential was (10.2±1.1)mV.It was found to spherical or oval shape,with uniform size and dispersibility under TEM.LE and EE was (5.51±1.83)% and (62.12±5.98)%,respectively.Drug release in vitro showed that VEGFR-2/As2O3-PEG-PLA exhibited controlled release effect,with half of the release time as 10 h.Besides,VEGFR-2/As2O3-PEG-PLA showed a good stability in 3 days.Compared with As2O3-PEG-PLA nanoparticles group,the concentration of As2O3in tumor and liver tissue was high,the concentration of As2O3in blood,heart,kidney tissue was low,the expression of VEGFR-2 in tumor tissue was low in VEGFR-2/As2O3-PEG-PLA nanoparticles group(P<0.05).Conclusion The prepared As2O3nanoparticle using PEG-PLA as vector and VEGFR-2 as target showed uniform size,high EE and LE,good stability.And it preliminarily proved that VEGFR-2 could be targeted in nude mice.
arsenicals;polyethylene glycols;polylactide;endothelial growth factors
� 著·
10.3969/j.issn.1671-8348.2016.36.001
国家自然科学基金资助项目(81060187);江西省自然科学基金资助项目(2008GQY0050);江西省教育厅科技技术研究项目(GJJ11309)。 作者简介:钟志惟(1994-),硕士,主要从事抗肝癌药物纳米的制备及其应用研究。△
钟志惟,王 栋,殷香保△,邬林泉,黄长文,黄明文,周 凡
(南昌大学第二附属医院肝胆外科,南昌 330006)
R256.4
A
1671-8348(2016)36-5041-04
2016-07-09
2016-09-20)

