葛根素对肾缺血再灌注大鼠肾脏组织的保护作用及其机制研究
朱敏杰,郝海英,陈洁,赵京梅,郝晓娟
(邯郸市中心医院,a.肾内二科,b.肾呼吸内科,河北 邯郸 056001)
◇药学研究◇
葛根素对肾缺血再灌注大鼠肾脏组织的保护作用及其机制研究
朱敏杰a,郝海英a,陈洁a,赵京梅b,郝晓娟a
(邯郸市中心医院,a.肾内二科,b.肾呼吸内科,河北 邯郸 056001)
目的 研究葛根素对肾缺血再灌注大鼠肾脏组织的保护作用及其机制。方法 将120只实验用大鼠随机数字表法分为6组:假手术组,模型组,葛根素高剂量(100 mg·kg-1)、中剂量(50 mg·kg-1)、低剂量(25 mg·kg-1)治疗组,银杏叶提取物(100 mg·kg-1)治疗组;采用夹闭双侧肾蒂血管45 min后松夹恢复血流灌注的方法建立肾缺血再灌注大鼠模型;再灌注后立即腹腔注射给药,每天1次,疗程2周。称量各组大鼠体质量、肾脏重量并计算肾脏指数,测定24 h尿量和24 h尿蛋白量(UPro),测定血清中血尿素氮(BUN)、肌酐(SCr)、尿酸(UA)含量,通过苏木精-尹红(HE)染色观察肾脏组织形态结构改变;末端标记法(TUNEL)观察肾小球细胞凋亡状况,并计算凋亡指数(AI);测定肾脏组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量,通过ELISA法测定血清中白介素-1(IL-1)和肿瘤坏死因子-α(TNF-α)含量水平。结果 较模型组,葛根素高、中剂量组大鼠肾脏重量减轻且肾脏指数降低,24 h尿量和UPro均减少,血清中BUN、SCr、UA含量降低,上述均差异有统计学意义(P<0.05,P<0.01);葛根素治疗组大鼠肾脏组织病变和肾小球细胞凋亡状况呈不同程度改善,以葛根素高剂量组效果最为显著,并且葛根素高、中剂量组大鼠肾小球细胞凋亡指数较模型组降低(P<0.05,P<0.01);葛根素高、中剂量组肾脏组织中SOD、CAT活性升高且MDA含量降低,血清中IL-1和TNF-α含量降低,且高剂量组GSH-Px活性升高,上述均差异有统计学意义(P<0.05,P<0.01)。结论 葛根素对肾缺血再灌注大鼠肾脏组织具有保护作用;其机制可能与葛根素能够有效改善抗氧化酶活性、降低氧化应激损伤、抑制炎性反应有关。
葛根素;肾脏;缺血再灌注;保护;机制
肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)是临床上开展肾脏手术以及失血、休克时常发生的肾组织损伤现象,其发病机制尚未完全明确。近年来病理生理学研究发现随着肾脏血流恢复供应,氧大量涌入而导致氧自由基的大量生成与过剩,诱发肾脏组织氧化应激损伤以及继发的细胞凋亡是造成RIRI的重要因素[1-2]。黄仁发等[3]研究均发现,炎性反应在RIRI的发生发展进程中也发挥着重要作用。葛根素(puerarin)是我国传统中药葛根的主要有效成分,现代药学研究发现,葛根素属于异黄酮类化合物,具有抗氧化、抗炎、调脂、抗凋亡等多种生物学活性[4-7]。银杏叶提取物具有活血、化淤、通络的功效,广泛应用于脑部及周围血流循环障碍[8],并且银杏叶提取物能够改善抗氧化酶活性、降低氧化应激损伤、抑制肾小球细胞凋亡而对RIRI起到确切的保护作用[9]。本研究采用夹闭双侧肾蒂血管45 min后松夹恢复血流再灌注的方法建立的肾缺血再灌注大鼠模型,并以银杏叶提取物为阳性对照,研究葛根素对肾缺血再灌注大鼠肾脏组织的保护作用并探讨其作用机制。
1 材料
1.1 药物与试剂 葛根素注射液(江西银涛药业有限公司,规格:2 mL:100 mg,批号 20140518);金纳多注射液(德国威玛舒培大药厂,每支5 mL,含有银杏提取物17.5 mg,批号1514904);血尿素氮(BUN)、肌酐(SCr)、尿酸(UA)、24 h尿蛋白量(UPro)试剂盒购自深圳迈瑞生物医疗电子股份有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所;白介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)酶联免疫(ELISA)试剂盒,TUNEL染色试剂盒购自北京博奥森公司;乌拉坦购自北京化学试剂公司。
1.2 实验动物 实验用SD大鼠(清洁级,雄性,7周龄,体质量180~220 g),购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003,动物批号:20140912。
1.3 主要仪器 UV759紫外-可见分光光度计(上海圣科仪器设备有限公司);BS-200型生化分析仪(深圳迈瑞生物医疗电子股份有限公司);iMark型酶标仪(美国 Bio-Rad公司)。
2 方法
2.1 动物分组与模型的制备 将120只实验用SD大鼠采用随机数字表法随机分为6组:假手术组,模型组,葛根素高剂量(100 mg·kg-1)、中剂量(50 mg·kg-1)、低剂量(25 mg·kg-1)治疗组,银杏叶提取物(100 mg·kg-1)治疗组,各20只;除假手术组外,其余各组大鼠均参照Chatterjee等[10]报道的方法制备肾缺血再灌注大鼠模型:实施麻醉后于脊柱双侧行肾区切口、暴露双侧肾脏,剥离双侧肾蒂血管并用无创动脉夹夹闭45 min后松夹恢复血流灌注,逐层缝合;假手术组大鼠行手术通路但不夹闭肾蒂血管。通过HE染色观察组织病理切片发现,假手术组大鼠肾脏组织结构完整、肾小管结构完整;而模型组大鼠肾脏组织呈现肾小管结构破坏、肾小管上皮细胞变性坏死、管腔内可见脱落的细胞和管型尿,间质区可见淋巴细胞浸润等明显的病理性形态学变化,结果见图1,说明造模成功。各治疗组分别于再灌注后立即通过腹腔注射给药,假手术组和模型组均同步给予等体积生理盐水,每天1次,疗程2周。
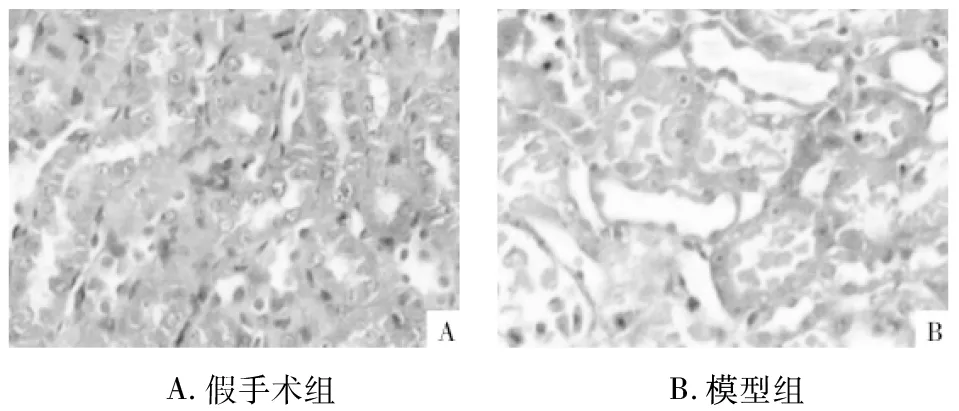
图1 大鼠肾脏组织形态学变化(HE×400)
2.2 体质量、肾脏质量的称量及肾脏指数的计算 治疗完成后称量各组大鼠体质量;麻醉后取肾脏组织并称量左侧肾质量,然后计算肾脏指数:
肾脏指数(mg·g-1)=左侧肾脏质量(mg)/体质量(g)
2.3 24 h尿量及UPro的测定 治疗完成后,插导尿管并测量各组大鼠24 h尿量,并按照试剂盒操作方法步骤分析测定各组大鼠UPro水平。
2.4 血清中BUN、SCr、UA含量的测定 治疗完成后经腹主动脉取血,离心(2 000 r·min-1,5 min)后取血清,按照各测定试剂盒操作方法进行处理后,通过全自动生化分析仪测定各组大鼠血清中BUN、SCr、UA含量。
2.5 肾脏组织形态结果改变的观察 取“2.2”步骤称量后的左侧肾脏组织,置于4%的多聚甲醛溶液中进行固定,经石蜡包埋、切片(厚度为5 μm)和展片处理后,行常规HE染色和复染,通过光学显微镜观察肾脏组织形态结构变化。
2.6 肾小球细胞凋亡状况的观察及凋亡指数(Apoptosis Index,AI)的计算 取“2.5”所制备的石蜡组织切片经脱蜡水化处理后,按照TUNEL染色试剂盒操作方法步骤依次进行处理,然后通过光学显微镜观察各组大鼠肾小球细胞凋亡状况。AI的计算:每只大鼠取5张切片,每张切片随机选取6个视野,计数每个视野中细胞总数以及阳性细胞数(细胞核黄染),取平均值,然后计算AI:
AI(%)=(凋亡细胞数/总细胞数)×100%
2.7 肾脏组织中SOD、GSH-Px、CAT活性和MDA含量的测定 取右侧肾脏组织,剪碎、加入适量冷裂解液后研磨匀浆,离心(3 000 r·min-1,10 min)后取上清液,然后按照试剂盒操作方法步骤,采用比色法、通过紫外-可见分光度计测定各组大鼠肾脏组织中SOD、GSH-Px、CAT活性和MDA含量。
2.8 血清中IL-1和TNF-α含量的测定 取“2.4”所制备的血清,按照ELISA试剂盒操作方法步骤进行处理,最后通过酶标仪测定各组大鼠血清中IL-1和TNF-α含量。
3 结果
3.1 葛根素对肾缺血再灌注大鼠肾脏质量及肾脏指数的影响 结果如表1所示,与假手术组比较,模型组大鼠肾脏质量和肾脏指数均升高(P<0.01);经葛根素高、中剂量治疗2周后,肾缺血再灌注损伤大鼠肾脏质量减轻且肾脏指数降低(P<0.05,P<0.01)。
3.2 葛根素对肾缺血再灌注大鼠24 h尿量和UPro的影响 结果如表2所示,与假手术组比较,模型组大鼠24 h尿量和UPro均升高(P<0.01);经葛根素高、中剂量治疗2周后,肾缺血再灌注损伤大鼠24 h尿量和UPro均降低(P<0.05,P<0.01)。
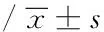
表1 葛根素对肾缺血再灌注大鼠肾脏质量及肾脏指数的影响
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
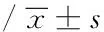
表2 葛根素对肾缺血再灌注大鼠24 h尿量和UPro的影响
注:与假手术组比较,aP<0.01;与模型组比较:bP<0.05,cP<0.01。
3.3 葛根素对肾缺血再灌注大鼠血清中BUN、SCr、UA含量的影响 结果如表3所示,与假手术组比较,模型组大鼠血清中BUN、SCr、UA含量升高(P<0.01);经葛根素高、中剂量治疗2周后,肾缺血再灌注损伤大鼠血清中BUN、SCr、UA含量降低(P<0.05,P<0.01)。
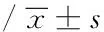
表3 葛根素对肾缺血再灌注大鼠血清中BUN、SCr、UA含量的影响
注:与假手术组比较,aP<0.01;与模型组比较:bP<0.05,cP<0.01。
3.4 葛根素对肾缺血再灌注大鼠肾小球细胞凋亡的影响 结果如图2所示,假手术组大鼠肾脏组织仅存在极少量的凋亡细胞;而模型组大鼠肾小球细胞凋亡数量增多,经葛根素治疗2周后,肾缺血再灌注损伤大鼠肾小球细胞凋亡数量减少,以葛根素高剂量组效果最为显著;计算AI结果如表4所示:与假手术组比较,模型组大鼠细胞AI升高(P<0.01),经葛根素高、中剂量治疗2周后,肾缺血再灌注损伤大鼠细胞AI降低(P<0.05,P<0.01)。
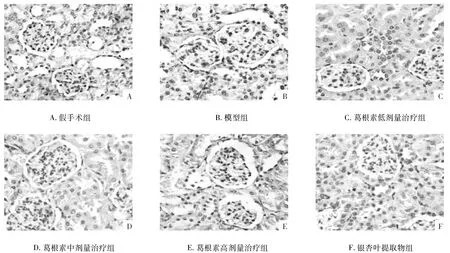
图2 葛根素对肾缺血再灌注大鼠肾小球细胞凋亡的影响(HE×400)
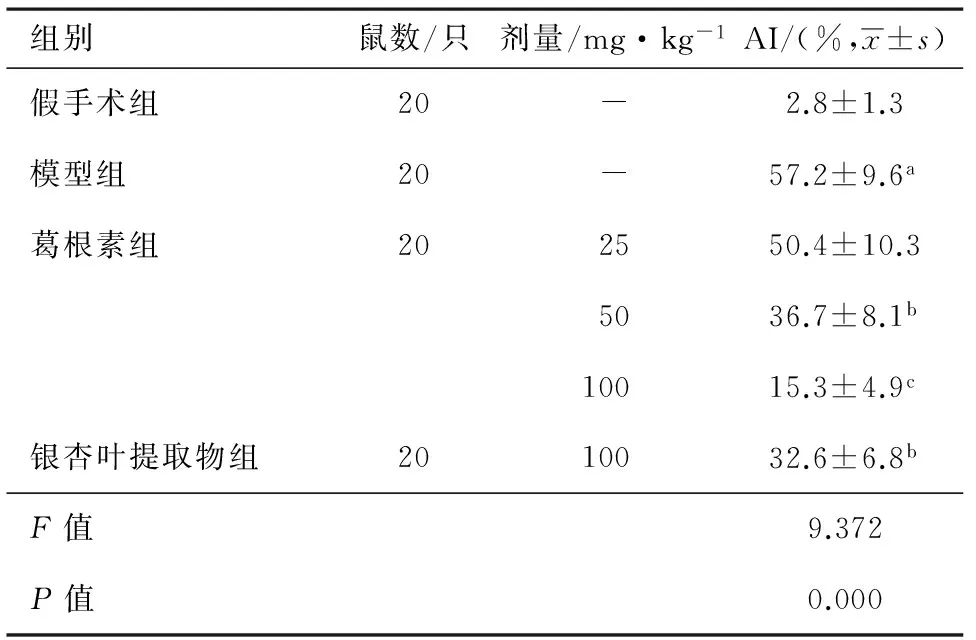
表4 葛根素对肾缺血再灌注大鼠肾小球细胞AI的影响
注:与假手术组比较:aP<0.01;与模型组比较:bP<0.05,cP<0.01。
3.5 葛根素对肾缺血再灌注大鼠肾脏组织中SOD、GSH-Px、CAT活性和MDA含量的影响 结果如表5所示,与假手术组比较,模型组大鼠肾脏组织中SOD、GSH-Px、CAT活性低且MDA含量升高(P<0.01);经葛根素高、中剂量治疗2周后,肾脏缺血再灌注损伤大鼠肾脏组织中SOD、CAT活性升高且MDA含量降低(P<0.05,P<0.01),高剂量治疗组GSH-Px活性显著升高(P<0.05)。
3.6 葛根素对肾缺血再灌注大鼠血清中IL-1和TNF-α含量的影响 结果如表6所示,与假手术组比较,模型组大鼠血清中IL-1和TNF-α含量均升高(P<0.01);经葛根素高、中剂量治疗2周后,肾脏缺血再灌注大鼠血清中IL-1和TNF-α含量降低(P<0.05,P<0.01)。
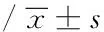
表5 葛根素对肾缺血再灌注大鼠肾脏组织中SOD、GSH-Px、CAT活性和MDA含量的影响
注:与假手术组比较:aP<0.01;与模型组比较:bP<0.05,cP<0.01。
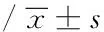
表6 葛根素对肾缺血再灌注大鼠血清中IL-1和TNF-α含量的影响
注:与假手术组比较,aP<0.01;与模型组比较:bP<0.05,cP<0.01。
4 讨论
肾脏组织血流量非常丰富,对缺血再灌注损伤非常敏感,常见于肾脏手术、严重出血、休克等之后。RIRI是导致肾功能衰竭的危险因素之一,其死亡率高达50%以上[11]。目前对RIRI的发病机制尚未明确,有研究发现氧化应激、炎性反应以及继发的细胞凋亡在其发生发展过程中发挥着非常重要的作用。游离并夹闭双侧肾蒂血管45 min后松夹恢复血流灌注是制备RIRI大鼠模型的常用方法[10],该方法制备的模型大鼠呈现肾脏组织氧化应激损伤、炎性反应、细胞凋亡以及肾小管率过滤升高且重吸收率降低所致尿量、24 h UPro、BUN、SCr、UA增多等病理性改变。
体内活性氧自由基(ROS)过剩是导致机体氧化应激损伤的病理基础,正常生理状态下,ROS的生成与清除处于动态平衡,其中抗氧化酶(SOD、GSH-Px、CAT)对ROS的清除发挥着重要的催化作用[12-14];当ROS生成增多或抗氧化酶活性降低时,将导致体内ROS的过剩而攻击细胞膜而造成脏器的脂质过氧化损伤,因此脂质过氧化终产物MDA的含量也能够间接反映氧化应激损伤程度。炎症因子IL-1和TNF-α在RIRI的发生和发展过程发挥重要的介导作用[15],IL-1能够引发中性粒细胞向肾组织浸润,从而加剧肾组织损伤;TNF-α不但具有直接细胞毒作用,而且还能够促进IL-1等细胞因子的产生,从而加剧炎性细胞的浸润和聚集。
细胞凋亡是一种程序性死亡,该过程中存在着非常复杂的调控机制,其中Bcl-2基因家族和Caspase蛋白家族在细胞凋亡过程中起着非常重要的调控作用[16]。细胞凋亡具有多种诱发因素,包括氧化应激损伤,而NF-κB蛋白则被称为连接氧化应激和细胞凋亡的“桥梁”;常态下,NF-κB以无活性形式存在于胞质中,而当受到外界因素刺激时NF-κB将进入胞核并调控靶基因的转录与表达。
本研究通过夹闭双侧肾蒂血管45 min后松夹恢复血流灌注的方法建立肾缺血再灌注大鼠模型,通过HE染色观察病理切片、TUNEL染色观察细胞凋亡、检测炎症细胞因子以及尿量、UPro、BUN、SCr、UA指标发现其病理性改变与Chatterjee等[10]的研究结果基本一致。本实验研究发现,经过葛根素治疗能够有效降低RIRI大鼠肾脏指数,减少尿量和尿蛋白量,降低BUN、SCr、UA含量,改善肾功能、降低肾小管率过滤、提高肾小管重吸收率,改善肾脏组织病变、抑制肾小球细胞凋亡;进一步研究发现,葛根素治疗能够有效改善RIRI大鼠肾脏组织抗氧化酶(SOD、GSH-Px、CAT)活性、降低MDA含量、降低炎症细胞因子(IL-1、TNF-α)水平;提示葛根素对肾缺血再灌注大鼠肾脏组织具有保护作用,其机制可能与葛根素能够改善肾小球滤过率和肾小管重吸收率、降低尿量,抑制氧化应激损伤、抑制细胞凋亡和炎性反应有关。
[1] 刘小勇,陈胜龙.丹参酮ⅡA 联合参麦注射液对肾缺血-再灌注大鼠氧化应激及肾功能的影响[J].实用医院临床杂志,2014,11(4):62-64.
[2] 许瑞瑞,宋年华,徐岩,等.肾缺血再灌注损伤对细胞凋亡的影响[J].青岛大学医学院学报,2015,51(1):29-34.
[3] 黄仁发,赖虹伊,梁群卿,等.Notch2/Hes-1信号通路活化参与调控肾缺血-再灌注诱导炎症因子的表达研究[J].中国现代医学杂志,2015,25(17):5-11.
[4] 刘娇梅.葛根素对妊娠期糖尿病大鼠氧化应激损伤保护作用的研究[J].中药药理与临床,2015,31(5):54-57.
[5] 王会敏,田炜,喇孝瑾,等.葛根素、齐墩果酸及其配伍对T2DM大鼠氧化应激和炎性反应的影响[J].中国实验方剂学杂志,2013,19(15):174-177.
[6] 程远渡,易有金,易传祝,等.植物甾醇酯和葛根素联合使用对高脂血症小鼠降血脂作用研究[J].中国油脂,2015,40(4):64-68.
[7] 张玲,庞莉,高俊虹,等.葛根素对糖尿病大鼠心肌细胞凋亡及相关蛋白表达的影响[J].中国中医基础医学杂志,2011,17(3):323-325.
[8] 沈秀珍,王凌,方毅华.银杏总黄酮通过调节自噬减轻大鼠心肌缺血再灌注损伤的研究[J].安徽医药,2016,20(6):1065-1067.
[9] 姚丹丹,唐高兴.银杏叶提取物对肾缺血再灌注损伤的保护作用[J].实用医学杂志,2008,24(9):1495-1496.
[10] Chatterjee PK,Brown PJ,Cuzzocrea S,et al.Calpain inhibitor1 reduces renal ischemia/ reperfusion injury in the rat[J].Kidney International,2001,59(6):2073-2083.
[11] 于金宝,王兵,崔尧丽,等.z-VAD-FMK对大鼠肾缺血再灌注损伤的保护作用[J].天津医科大学学报,2014,20(2):89-92.
[12] Wided K,Hassiba R,Mesbah L.Polyphenolic fraction of Algerian propolis reverses doxorubicin induced oxidative stress in liver cells and mitochondria[J].Pak J Pharm Sci,2014,27(6):1891-1897.
[13] Syed SN,Rizvi W,Kumar AA,et al.In vitro antioxidant and in vivo hepatoprotective activity of leave extract of Raphanus sativus in rats using CCL4 model[J].Afr J Tradit Complement Altern Med,2014,11(3):102-106.
[14] Cheng L,Jin Z,Zhao R,et al.Resveratrol attenuates inflammation and oxidative stress induced by myocardial ischemia-reperfusion injury:role of Nrf2/ARE pathway[J].Int J Clin Exp Med,2015,8(7):10420-10428.
[15] 郭爱民,曹建民,周海涛.红景天对大鼠运动性肾缺血再灌注血清和肾组织中 IL-1β、TNF-α、IL-6 和 IL-18 水平的影响[J].沈阳体育学院学报,2013,32(5):74-78.
[16] 袁芳.山楂叶总黄酮对心肌缺血再灌注损伤大鼠心肌细胞凋亡及bcl-2、Bax、caspase-3蛋白表达的影响[J].辽宁中医药大学学报,2016,18(7):57-60.
Protection and mechanism of puerarin on the kidneys in ischemic-reperfusion rats
ZHU Minjie,HAO Haiying,CHEN Jie,et al
(SecondDepartmentofNephrology,HandanCentralHospital,Handan,Hebei056001,China)
Objective To investigate the protection and mechanism of puerarin on the kidneys in ischemic-reperfusion rats.Methods One hundred and twenty experimental rats were randomized into six groups:sham operation group,renal ischemic-reperfusion model control group,puerarin 25,50,100 mg·kg-1treatment groups and ginkgo biloba extract(EGb)100 mg·kg-1treatment group.The model rats were made by gripping bilateral renal pedicle vascular for 45min,then the drugs were given immediately after reperfusion,once a day for 2 weeks.Two weeks later,the body mass and renal weight were determined and the renal index(RI)was calculated;the urine volume and the UPro were determined;the content of BUN,SCr,UA in serum were determined;the histopathological changes of renal tissue were observed by HE staining;the apoptosis of renal cells was observed by TUNEL staining,and the apoptosis index(AI)was calculated;the activities of SOD,GSH-Px and CAT and the content of MDA in renal tissue were determined;the contents of IL-1 and TNF-α in serum were determined by ELISA.Results Compared with renal ischemic-reperfusion model control group,the renal weight and RI in puerarin(50,100 mg·kg-1)treatment groups were significantly decreased(P<0.05,P<0.01);the urine volume and the UPro in puerarin(50,100 mg·kg-1)treatment groups were significantly decreased(P<0.05,P<0.01),and the content of BUN,SCr,UA in serum were significantly decreased(P<0.05,P<0.01).The histopathological changes and the apoptosis of the renal tissue in puerarin treatment groups were significantly improved,especially in the puerarin 100 mg·kg-1treatment group,and theAIof puerarin(50,100 mg·kg-1)treatment groups were significantly decreased(P<0.05,P<0.01).The activities of SOD,CAT in renal tissue of puerarin(50,100 mg·kg-1)treatment groups were significantly increased and the contents of MDA were significantly decreased(P<0.05,P<0.01),the contents of IL-1 and TNF-α in serum were significantly decreased(P<0.05,P<0.01),and the activity of GSH-Px of puerarin 100 mg·kg-1treatment group was significantly increased(P<0.05,P<0.01).Conclusions Puerarin had protective effects on kidneys in ischemic-reperfusion rats,which was perhaps related to its effects on improving the activity of antioxidant enzymes,reducing oxidative stress injury and inhibiting inflammatory response.
Puerarin;Kidneys;Ischemic-reperfusion;Protection;Mechanism
10.3969/j.issn.1009-6469.2016.11.006
2016-04-23,
2016-08-07)

