美藤果油和磷虾油合剂对小鼠免疫功能的影响
□ 于学芹 山东大学公共卫生学院、山东医药技师学院中药系 马 晓 刘厚福 赵 丽 山东大学公共卫生学院李文广 云南省现代农林投资有限公司 赵长峰 山东大学公共卫生学院
美藤果油和磷虾油合剂对小鼠免疫功能的影响
□ 于学芹 山东大学公共卫生学院、山东医药技师学院中药系 马 晓 刘厚福 赵 丽 山东大学公共卫生学院李文广 云南省现代农林投资有限公司 赵长峰 山东大学公共卫生学院
探讨美藤果油和磷虾油合剂对小鼠免疫功能的影响,经口给予小鼠不同剂量的美藤果油和磷虾油合剂30 d,检测其体重增长、脾脏和胸腺体重比值以及各项免疫功能指标。结果表明,各组间小鼠体重增长差异无显著性(P>0.05),小鼠脾脏体重比值和胸腺体重比值差异亦无显著性(P>0.05),小鼠细胞免疫功能、体液免疫功能、NK细胞活性测定结果均为阳性,小鼠单核-巨噬细胞吞噬功能测定结果为阴性。美藤果油和磷虾油合剂具有增强小鼠免疫功能的作用。
美藤果油;磷虾油;合剂;免疫功能;小鼠
美藤果(Plukenetia volubilis Linneo)又名南美油藤、星油藤、印加果等,是大戟科的一种木质藤木植物,原生长在南美洲。2008年底我国引进种源,2009年在云南省试验种植,现种植面积已达3 333余hm2。美藤果油来源于南美油藤种籽,富含不饱和脂肪酸,约占脂肪总含量的93%,其中必需脂肪酸亚油酸和α-亚麻酸分别占37%、47%,有调节血脂、预防心血管疾病、抗氧化等作用[1-2]。此外,美藤果油还含有生育酚、甾醇、多酚等活性物质。2013年1月,我国国家卫生和计划生育委员会将其列为新资源食品[3]。
磷虾属于无脊椎动物,是磷虾科动物的通称。南极磷虾蕴藏量丰富,是地球上数量最大的单种生物资源之一。磷虾油是从磷虾中提取的,含有磷脂、ω-3脂肪酸、虾青素等多种生物活性成分,具有抑制肝脂肪化、降血脂、降血糖、预防心血管疾病等功能[4-7]。此外,磷虾油含有大量的ω-3长链多不饱和脂肪酸,其中二十碳五烯酸和二十二碳六烯酸可能与免疫功能有关[8]。由于美藤果油和磷虾油原料丰富,营养价值高,近年来关于其活性研究较多,但对其免疫作用研究较少,更未见对两者混合物进行研究的报道。本实验主要研究美藤果油和磷虾油合剂能否增强小鼠的免疫功能。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用健康SPF昆明种小鼠,体重18~22 g,由山东大学动物实验中心提供。急性毒性实验小鼠20只,雌雄各半。免疫功能检测实验雌性小鼠200只,分为4个免疫大组,每免疫大组又分为水对照组、溶剂对照组、低、中、高剂量组,各10只。免疫1组用于迟发型变态反应(DTH)实验、血清溶血素测定、抗体生成细胞数测定;免疫2组用于小鼠碳廓清实验;免疫3组用于小鼠腹腔巨噬细胞吞噬鸡红细胞实验;免疫4组用于小鼠淋巴细胞转化实验和小鼠NK细胞活性测定。实验环境温度(22±2)℃,相对湿度(50±10)%。
1.1.2 受试物及剂量选择
美藤果油和磷虾油合剂(67%美藤果油,33%磷虾油)为红色油状液体,由云南省现代农林投资有限公司提供。人体推荐量为每人每日3.0 g/60 kg.bw,按相当于其5、10、30倍确定小鼠的低、中、高剂量,即各组小鼠每日剂量分别为0.25 g/kg.bw、0.50 g/ kg.bw、1.50g/kg.bw,经口每日一次灌胃,灌胃体积按10 mL/kg.bw。灌胃前用玉米油配制受试物,低、中、高剂量组受试物的浓度分别为25 g/L、50 g/L和150 g/L,水对照组以等体积的蒸馏水代替受试物,溶剂对照组连续给予等体积的玉米油,30 d后测各项免疫指标。小鼠以远交系小鼠专用饲料喂饲。
1.1.3 主要仪器设备
紫外分光光度计、酶联免疫检测仪、光学显微镜、血细胞计数器、24孔和96孔平底细胞培养板、96孔U型底细胞培养板。
1.2 方法
1.2.1 急性毒性试验
采用最大耐受量(MTD)试验。小鼠空腹16 h后,将合剂原液灌胃1次,容量为0.22 mL/10g.bw,即剂量为20.46 g/kg.bw,连续观察14 d,记录中毒表现及死亡情况。
1.2.2 脏器体重比值测定
小鼠称重后颈椎脱臼处死,取其胸腺、脾脏,去尽筋膜,用滤纸吸干脏器表面血污并称重,计算胸腺体重比值与脾脏体重比值。
1.2.3 免疫功能检测
细胞免疫功能检测采用迟发型变态反应(足跖增厚法,DTH)和ConA诱导的脾淋巴细胞转化实验(MTT法);体液免疫功能检测采用抗体生成细胞测定(Jerne改良玻片法)和血清溶血素的测定;单核-巨噬细胞功能检测采用小鼠碳廓清实验和小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法);NK细胞活性测定采用乳酸脱氢酶LDH测定法。
1.2.4 结果判定依据
根据原卫生部颁发的《保健食品检验与评价技术规范(2003年版)》中关于急性毒性分级标准和增强免疫力功能判定标准。
1.2.5 统计学处理
2 结果
2.1 急性毒性试验结果
两种性别的小鼠均未见明显的中毒症状,也无死亡。将受试小鼠处死后进行解剖检查,肝脏、脾脏、肾脏、心脏、肺、胃和肠等主要器官,均未见明显异常改变。受试样品对两种性别小鼠的MTD均大于20.46 g/kg.bw,判定合剂属无毒级。
2.2 不同组间小鼠体重、脏器体重比值比较
小鼠初始体重均数在各组间差异无统计学意义(F=0.211,P=0.931),说明体重分布较为均衡。灌胃30 d后,体重增长值均数在各组间差异均无统计学意义(F=0.362,P=0.834)。小鼠脾脏体重比值均数(F=0.204,P=0.935)和胸腺体重比值均数(F=0.598,P=0.666)在各组间比较,差异亦无统计学意义,见表1。
2.3 各剂量组小鼠细胞免疫功能指标比较
小鼠迟发型变态反应结果显示,小鼠足跖肿胀度均数在各组间比较差异有统计学意义(F=4.343,P=0.005),见表2。LSD两两比较法结果显示,足跖肿胀度均数在低剂量组与水对照组(P=0.747)、低剂量组与溶剂对照组(P=0.916)间比较,差异无统计学意义;在中剂量组与水对照组(P=0.009)、高剂量组与水对照组(P=0.003)、中剂量组与溶剂对照组(P=0.026)、高剂量组与溶剂对照组间(P=0.011)比较,差异均有统计学意义,即中、高剂量组迟发型变态反应能力均高于对照组。
ConA诱导的小鼠脾淋巴细胞转化实验结果显示,各组间的淋巴细胞增殖能力均数差异无统计学意义(F=0.464,P=0.762),见表2。
2.4 各剂量组小鼠体液免疫功能指标比较
小鼠抗体生成细胞数测定表明各组间抗体生成细胞数均数差异无统计学意义(F=0.205,P=0.934),见表2。
小鼠血清溶血素实验中,各组间抗体积数均数在各组间差异有统计学意义(F=4.790,P=0.003)。LSD两两比较法结果显示,低剂量组与水对照组、低剂量组与溶剂对照组间比较,差异无统计学意义;中剂量组与水对照组、高剂量组与水对照组、中剂量组与溶剂对照组、高剂量组与溶剂对照组间比较,差异均有统计学意义,即中、高剂量组小鼠抗体产生的量高于对照组,见表2。
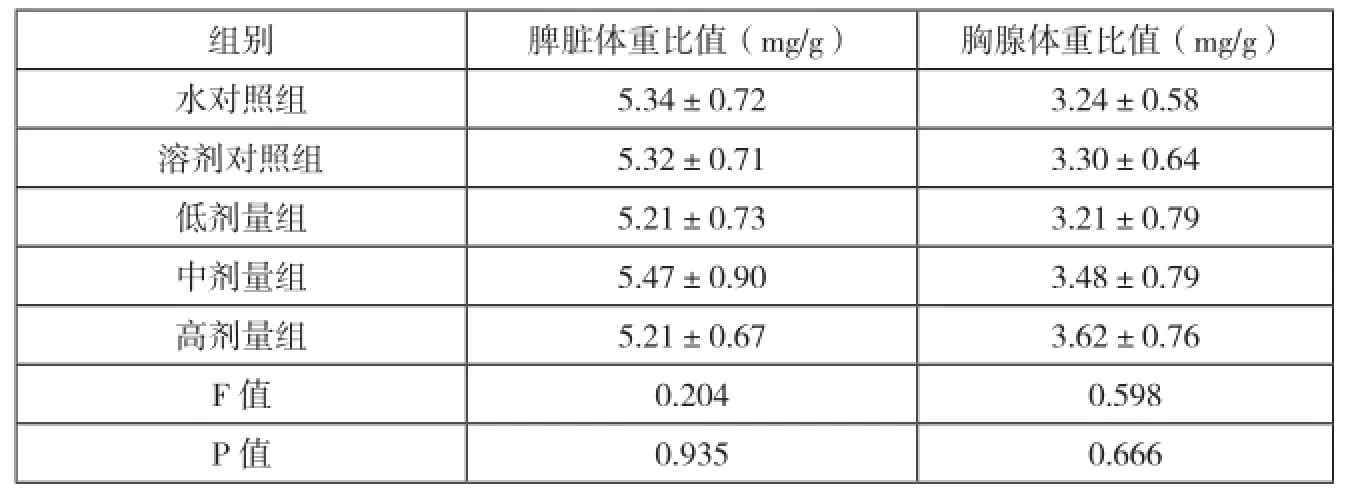
表1 不同组间小鼠脏器体重比值比较(n=10)
2.5 不同剂量组小鼠非特异性免疫功能指标比较
2.5.1 小鼠单核巨噬细胞吞噬功能影响
采用小鼠单核-巨噬细胞碳廓清能力测定实验和小鼠腹腔巨噬细胞吞噬鸡红细胞能力测定实验。前者吞噬指数1均数在各组间差异无统计学意义(F=0.371,P=0.828)。后者吞噬率不符合方差分析条件,进行平方根反正弦转换后进行方差分析;结果显示吞噬率平方根反正弦转换值(F=0.486,P=0.746)和吞噬指数2(F=0.070,P=0.991)在各组间差异无统计学意义,见表3。
2.5.2 小鼠NK细胞活性改变
小鼠NK细胞活性百分率不符合方差分析条件,将百分率进行平方根反正弦转换后进行方差分析。灌胃合剂后,小鼠NK细胞活性率平方根反正弦转换值均数在各组间差异有统计学意义(F=5.380,P=0.001)。LSD两两比较法结果显示,低剂量组与水对照组、中剂量组与水对照组、低剂量组与溶剂对照组、中剂量组与溶剂对照组间比较,差异有统计学意义,即低、中剂量组小鼠NK细胞活性高于对照组;高剂量组与水对照组(P=0.087)、高剂量组与溶剂对照组(P=0.061)间比较,差异无统计学意义,见表3。
3 讨论
T细胞、B细胞介导的细胞免疫和体液免疫是反映机体免疫调节平衡状态的重要参数,单核巨噬细胞的吞噬功能、NK细胞活性可衡量机体非特异性免疫功能。美藤果油和磷虾油合剂可增加小鼠的迟发型变态反应能力和小鼠血清溶血素水平(两者均有两个剂量为阳性),即增强小鼠的细胞和体液免疫功能,同时还能增加小鼠NK细胞活性,因此,可认为美藤果油和磷虾油合剂可增强小鼠的免疫功能。此结果可能与n-3多不饱和脂肪酸有关[8-9],还可能与虾青素提高免疫力作用有关[10]。
DTH是由T淋巴细胞介导的超敏反应,它无需抗体或补体参加,在变应原的作用下形成致敏淋巴细胞,当再次接触相同变应原时,可表现出一种迟缓(至少约12 h后才出现反应,24~72 h达高峰)以细胞变性坏死为特征的局部变态反应性炎症,具体到本研究采用的是足趾增厚法,以攻击前后足趾厚度之差值(足趾肿胀度)表示DTH的程度,反映细胞免疫功能。DTH实验和血清溶血素实验,两者均是中剂量组和高剂量组与对照组差异有显著性意义,可能由于美藤果油和磷虾油合剂剂量和小鼠免疫功能之间存在剂量反应关系,需要达到一定的量才能发挥出作用。NK细胞是一类非特异性免疫细胞,它无需提前接触抗原即可杀伤靶细胞,且其杀伤效应无主要组织相容性复合体限制性,不依赖抗体;它是机体抗肿瘤、抗感染的重要免疫因素,也参与第Ⅱ型超敏反应,还能分泌多种细胞因子,发挥调节免疫、造血和直接杀伤靶细胞的作用。NK细胞活性增强说明非特异性免疫功能有一定改善。美藤果油和磷虾油合剂低剂量组、中剂量组活性明显高于对照组,而高剂量与对照组差异无显著性,原因可能是磷虾油蛋白肽中的重金属元素(如氟、铜)对小鼠的毒性作用[5],可进一步研究磷虾油蛋白脱脂肽的毒性和食用安全性。
美藤果油和磷虾油合剂对小鼠的脾脏体重比值和胸腺体重比值无影响,与徐恺[5],周大勇[11]等研究结果不一致,可能因为本研究的是美藤果油和磷虾油合剂,而后者则只研究磷虾油,也有可能跟剂量有关。美藤果油和磷虾油合剂对小鼠单核-巨噬细胞吞噬功能亦无影响,与周大勇[11]等研究结果不一致,可能由剂量不同所致。
综上所述,美藤果油和磷虾油合剂对小鼠免疫功能具有增强作用。食用油在人们日常生活中不可或缺,近年来我国食用植物油供需形势严峻,自给率只有40%左右,约60%食用植物油依赖进口[12-13]。美藤果种植周期短,美藤果油和磷虾油资源丰富,作为新资源食品,两者的共同特点是富含蛋白质和不饱和脂肪酸,不仅营养价值高,且具有多种生物活性。本研究发现两者混合使用可增强小鼠免疫功能,因此,预测美藤果油和磷虾油合剂将来会有较好的食用价值和市场前景。

表2 各剂量组小鼠细胞和体液免疫功能指标比较(n=10)

表3 不同剂量组小鼠非特异性免疫功能指标比较(n=10)
[1]杨小敏,张亚飞,胡鹏.美藤果油的研究开发进展[J].粮食与食品工业,2015,22(3):37-41.
[2]Fanali C, Dugo L, Cacciola F, et al. Chemical characterization of Sacha Inchi (Plukenetia volubilis L.) oil[J]. Journal of Agricultural and Food Chemist ry,2011,59(24):13043-13049.
[3]中华人民共和国国家卫生和计划生育委员会.关于批准茶树花等7种新资源食品的公告(卫生部公告2013年第1号)[EB/OL].(2013-01-15) [2016-08-25].http://www.moh.gov.cn/ zhuzhan/gonggao/201304/1b2f699e767e4 1248900fc3999f63bda.shtml.
[4]刘勤,刘志东,陆亚男,等.南极磷虾产品研究及发展趋势[J].渔业信息与战略,2014,29(2):115-121.
[5]徐恺.南极磷虾肽抗疲劳、耐缺氧以及抗衰老、提高免疫力实验研究[D].青岛:中国海洋大学,2012.
[6] Kwantes JM, Grundmann O. A brief review of krill oil history, research, and the commercial market[J]. Journal of Dietary Supplement, 2015,12(1):23-35.
[7]Ulven SM, Holven KB. Comparison of bioavailability of krill oil versus fish oil and health effect[J].Vasc Health and Risk Management,2015(11):511-524.
[8]Da B M, Mastalurova I, Brazaite G, et al. The Effect of Krill Oil Supplementation on Exercise Performance and Markers of Immune Function[J]. Plos One, 2015, 10(9):14.
[9]贺敏,胡世伟,吴胜强,等.高含量EPA/DHA甘油三酯型鱼油对小鼠的免疫调节作用[J].中国海洋药物, 2013(4):43-48.
[10]高辉,许先进.虾青素的生物学功能及其药理作用[J].海南医学,2014(14):2111-2114.
[11]周大勇,王君妍,刘潇阳,等.南极磷虾油对小鼠免疫功能的调节作用[J].大连工业大学学报,2015(2):97-100.
[12]王瑞元.国内外食用油市场的现状与发展趋势[J].中国油脂,2011,36(6):1-6.
[13]王性炎,王姝清.新资源食品——元宝枫籽油[J].中国油脂, 2011, 36(9):56-59.

