制取小麦旗叶粗酶液的最佳缓冲体系研究
高 玲
(青岛农业大学生命科学学院,山东青岛 266109)
制取小麦旗叶粗酶液的最佳缓冲体系研究
高 玲
(青岛农业大学生命科学学院,山东青岛 266109)
[目的]探讨制取小麦旗叶粗酶液的最佳缓冲体系。[方法]采用不同的缓冲体系制备小麦旗叶粗酶液,测定小麦旗叶中过氧化物酶(POD)、淀粉酶、苯丙氨酸解氨酶(PAL)、脂氧合酶(LOX)的活力。 [结果] 当pH为6.2时,POD活力最高;当pH为5.8时,淀粉酶活力最高;当pH为7.0时,PAL和LOX活力最高。选用磷酸氢二钠-磷酸二氢钠缓冲液为提取缓冲液时,PAL和LOX活力最高。当此缓冲液浓度为0.15 mol/L时,POD活力最高;当此缓冲液浓度为0.10 mol/L时,淀粉酶和LOX活力最高;当此缓冲液浓度为0.05 mol/L时,PAL活力最高。 [结论]制取粗酶液的最佳缓冲体系是pH 7.0、0.10 mol/L的磷酸氢二钠-磷酸二氢钠缓冲液。
小麦;旗叶;粗酶液;缓冲体系
小麦籽粒产量主要依赖于小麦开花后光合物质的积累[1-2],而旗叶是小麦生育后期重要的光合器官,其功能期的长短与小麦的单穗重和千粒重的关系极为密切。目前,国内外对籽粒干物质积累的作用已有大量报道。大量研究表明,小麦旗叶中保护酶含量的高低能在一定程度上反映叶片的衰老进程[3-4],因此研究不同条件对旗叶中保护酶活性的影响可为生产中如何延长旗叶功能期,进而增加小麦产量提供理论依据[5-7]。但是,不同种酶采用提取液的类型、浓度、pH等存在差异[8-15]。笔者以小麦旗叶为试验材料,探讨制取小麦旗叶粗酶液的最佳缓冲体系。
1 材料与方法
1.1 试验材料 选用5月初大田种植的LN-3小麦旗叶为试验材料。
1.2 试验方法 先将采集的小麦旗叶叶片洗净擦干,称取0.2 g,加入适量缓冲液及少量石英砂,研磨成匀浆,转入离心管,10 000 r/min转速下离心10 min。记录上清液体积,放入冰浴中备用。过氧化物酶(POD)活力的测定参照王学奎[16]的方法;淀粉酶(Amylase)活力的测定采用DNS法[17];脂氧合酶(LOX)活力的测定参照钟芳等[18]的方法;苯丙氨酸解氨酶(PAL)活力的测定参照邵伏文等[19]的方法。
2 结果与分析
2.1 不同pH对小麦旗叶中酶活力的影响 用不同pH的缓冲液提取小麦旗叶中的混合酶,然后进行相应酶活力的测定。从图1、2可以看出,POD和淀粉酶活力在pH 6.0时最高,PAL和LOX活力在pH 7.0时最高。当pH为7.0时,POD和淀粉酶活力分别为pH 6.0时酶活的92%和80%,因此在后续试验中选取pH 7.0的缓冲液。

图1 不同pH对小麦旗叶中POD和淀粉酶活力的影响Fig.1 The effects of different pH on the activities of POD and amylase in flag leaves of wheat

图2 不同pH对小麦旗叶中PAL和LOX活力的影响Fig.2 The effects of different pH on the activities of PAL and LOX in flag leaves of wheat
2.2 不同缓冲液类型对小麦旗叶中酶活力的影响 在确定不同酶活力最高的pH大致范围后,为分析不同缓冲液类型对小麦旗叶中酶活力的影响,试验选用3种pH相同但组分不同的常用缓冲体系对酶活力进行测定。从图3、4可以看出,磷酸氢二钠-磷酸二氢钠缓冲液最适合这4种酶,此条件下PAL和LOX活力最高,POD活力达到最高活力的74.5%,淀粉酶活力达到最高活力的78.0%。

图3 不同缓冲液类型对小麦旗叶中POD和淀粉酶活力的影响Fig.3 The effects of different types of buffer on the activities of POD and amylase in flag leaves of wheat

图4 不同缓冲液类型对小麦旗叶中PAL和LOX活力的影响Fig.4 The effects of different types of buffer on the activities of PAL and LOX in flag leaves of wheat
2.3 不同浓度的缓冲液对小麦旗叶中酶活力的影响 为了探讨缓冲液的浓度变化对酶活力的影响,试验选用对4种酶均适合的磷酸氢二钠-磷酸二氢钠缓冲液进行。从图5、6可以看出,当缓冲液浓度为0.15 mol/L时,POD活力最高;当缓冲液浓度为0.10 mol/L时,淀粉酶和LOX活力最高;当缓冲液浓度为0.05 mol/L时,PAL活力最高。

图5 不同缓冲液浓度对小麦旗叶中POD和淀粉酶活力的影响Fig.5 The effects of buffer concentration on the activities of POD and amylase in flag leaves of wheat
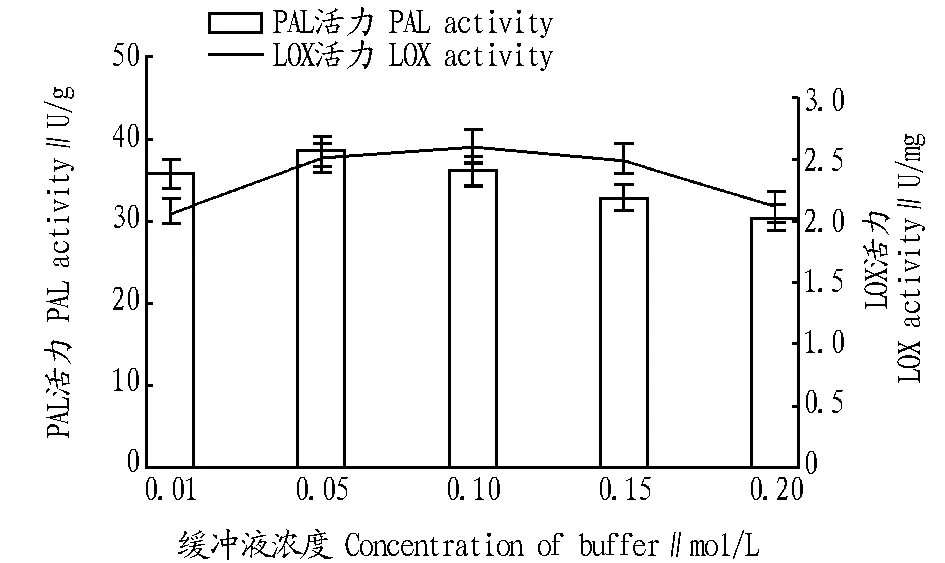
图6 不同缓冲液浓度对小麦旗叶中PAL和LOX活力的影响Fig.6 The effects of buffer concentration on the activities of PAL and LOX in flag leaves of wheat
2.4 pH的微调对小麦旗叶中酶活力的影响 为了探讨缓冲液pH的细微变化对酶活力的影响,选择对4种酶均适合的磷酸氢二钠-磷酸二氢钠缓冲液进行试验。从图7、8可以看出,当pH为5.8时,小麦旗叶中淀粉酶活力最高;当pH为6.2时,POD活力最高;当pH为7.0时,PAL和LOX活力最高。

图7 pH的微调对小麦旗叶中POD和淀粉酶活力的影响Fig.7 The effects of fine adjustment of pH on the activities of POD and amylase in flag leaves of wheat

图8 pH的微调对小麦旗叶中PAL和LOX活力的影响Fig.8 The effects of fine adjustment of pH on the activities of PAL and LOX in flag leaves of wheat
3 讨论与结论
酶的结构特点及催化特性决定了不同的酶在活力最高时所需的条件不同,因此提取酶所用的缓冲体系的类型、pH、溶液离子浓度的高低等是必须考虑的因素。小麦籽粒产量的高低与旗叶的功能期长短直接相关,因此旗叶中各种酶的活力成为检测旗叶功能的重要指标。在测定各种酶活力时应根据不同的酶选择不同的缓冲体系进行提取与测定,增加了工作量和难度。笔者采用不同的缓冲体系对小麦旗叶中POD、淀粉酶、PAL、LOX这4种酶活力进行了测定。结果表明,当pH为6.2时,POD活力最高;当pH为5.8时,淀粉酶活力最高;当pH为7.0时,PAL和LOX活力最高。磷酸氢二钠-磷酸二氢钠缓冲液最适合这4种酶,此条件下PAL和LOX活力最高,POD活力达到最高活力的74.5%,淀粉酶活力达到最高活力的78.0%。
当缓冲液浓度为0.15 mol/L时,POD活力最高;当缓冲液浓度为0.10 mol/L时,淀粉酶与LOX活力最高;当缓冲液浓度为0.05 mol/L时,PAL活力最高。 综上所述,提取小麦旗叶中混合酶的粗酶液的最佳缓冲体系为pH 7.0、0.10 mol/L 磷酸氢二钠-磷酸二氢钠缓冲液。参考文献
[1] 王月福,于振文,李尚霞,等.氮素营养水平对小麦开花后碳素同化、运转和产量的影响[J].麦类作物学报,2002,22(2):55-59.
[2] 单保山,常文锁.小麦旗叶对产量性状及籽粒蛋白含量作用的研究[J].河北农业大学学报,1991,14(2):5-9.
[3] 高阳,黄玲,李新强,等.开花后水分胁迫对冬小麦旗叶光合作用和保护酶活性的影响[J].水土保持学报,2013,27(4):201-206.
[4] 周萍,庄丽,徐红军,等.水肥运筹对滴灌春小麦保护酶活性及产量的影响[J].麦类作物学报,2013,33(3):561-565.
[5] 曲超,刘俊梅,胡昌录,等.氮肥施用对旱地秸秆覆盖冬小麦旗叶生理特性的影响[J].麦类作物学报,2015,35(2):207-214.
[6] 张晶,张姣爱,党建友,等.重金属Cu、Zn污染对小麦旗叶生理及产量的影响[J].中国农学通报,2015,31(11):229-233.
[7] 王月福,于振文,李尚霞,等.小麦籽粒灌浆过程中有关淀粉合成酶的活性及其效应[J].作物学报,2013,29(1):75-81.
[8] 庞学群,段学武,张昭其,等.荔枝果皮过氧化物酶的纯化及部分酶学性质研究[J].热带亚热带植物学报,2004,12(5):449-454.
[9] 宋金耀,孟庆祥,刘永军.苹果叶片过氧化物酶理化性质分析[J].华北农学报,1997,12(1):81-85.
[10] 宋晓轩,朱荷琴,邢金松.棉花叶片过氧化物同工酶等电聚焦电泳分析[J].植物生理学通讯,1995,31(1):45-48.
[11] 马向东,马立新,薛征峰,等.一种鉴定α-淀粉酶活性及其产生菌的新方法[J].华中农业大学学报,2002,19(5):456-460.
[12] 欧阳光察,应初衍,沃绍根,等.植物苯丙氨酸解氨酶的研究:VI.水稻、小麦PAL 的纯化及基本特性[J].植物生理学报,1985,11(2):204-214.
[13] 程水源,陈昆松,刘卫红,等.植物苯丙氨酸解氨酶基因的表达调控与研究展望[J].果树学报,2003,20(5):351-357.
[14] GÖKMEN V,BAHÇECI S,ACAR J.Characterization of crude lipoxygenase extract from green pea using a modified spectrophotometric method[J].Eur Food Res Technol,2002,215(1):42-45.
[15] 刁丰秋,章文华,刘友良.盐胁迫对大麦叶片类囊体膜组成和功能的影响[J].植物生理学报,1997,23(2):105-110.
[16] 王学奎.植物生理生化实验原理和技术[M].2版.北京:高等教育出版社,2006:167-173.
[17] 高玲,刘卫群.生物化学实验教程[M].北京:高等教育出版社,2010:64-66.
[18] 钟芳,王璋,许时婴.3种脂肪氧合酶酶活测定方法[J].无锡轻工大学学报,2001(1):77-80.
[19] 邵伏文,薛宝燕,郭家明,等.烟草苯丙氨酸解氨酶活力与多酚含量的关系研究[J].安徽农业科学,2012,40(12):7009-7011.
Study on the Optimum Buffering System for Preparing Crude Enzymes in Flag Leaves of Wheat
GAO Ling
(College of Life Sciences, Qingdao Agricultural University, Qingdao, Shandong 266109)
[Objective] To study the optimum buffering system for preparing crude enzymes in flag leaves of wheat. [Method] Taking flag leaves of wheat as test materials, different buffering systems were used to prepare crude enzymes in flag leaves of wheat. And the activities of POD, amylase, PAL, LOX in flag leaves of wheat were determined. [Result] When pH was 6.2, POD activity was the highest; When pH was 5.8, amylase activity was the highest; When pH was 7.0, both PAL activity and LOX activity reached the maximum values. When Na2HPO4-NaH2PO4buffer was used as the extracting buffer in the test, PAL and LOX activities both reached the maximum values. When the concentration of Na2HPO4-NaH2PO4buffer was 0.15 mol/L, POD activity was the highest; When the concentration of Na2HPO4-NaH2PO4buffer was 0.10 mol/L, amylase activity and LOX activity reached the maximum values; When the concentration of Na2HPO4-NaH2PO4buffer was 0.05 mol/L, PAL activity was the highest. [Conclusion] The optimum buffering system for preparing crude enzymes in flag leaves of wheat was Na2HPO4-NaH2PO4buffer(pH 7.0, 0.10 mol/L).
Wheat; Flag leaves; Crude enzymes; Buffering system
青岛市民生科技计划项目(14-2-3-43-nsh)。
高玲(1967- ),女,山东潍坊人,副教授,博士,硕士生导师,从事酶学和蛋白质研究。
2016-11-11
S 512.1;Q 55
A
0517-6611(2016)35-0017-03

