环境压力对铝氧反应点火过程影响的计算分析
田入园,张领科
(南京理工大学 能源与动力工程学院,南京 210094)
【化学工程与材料科学】
环境压力对铝氧反应点火过程影响的计算分析
田入园,张领科
(南京理工大学 能源与动力工程学院,南京 210094)
为了研究环境的压力对铝氧反应点火过程的影响,运用零维均质点火模型,利用CHEMKIN-PRO闭式均相反应器进行求解计算;分析了点火过程中主要基元反应对点火过程的影响,计算了参与点火过程的主要物质摩尔分数随时间的变化规律;重点计算了在2 300 K初始温度不同环境压力下(1~9 atm)的点火延迟时间,点火延迟时间与环境压力的拟合关系式为t=3.36×10-7p0-0.99;获得了不同环境压力时组分O2、Al(l)、Al2O、Al2O2、AlO、Al2O3、O、AlO2、Al、Al2O(l)在点火过程中的摩尔分数变化规律。
含能材料;铝氧反应;点火过程;环境压力;数值分析
铝作为金属添加剂被广泛地运用于各种烟火、炸药以及推进剂中,它不仅可以抑制推进剂的不稳定燃烧,也能同氧化剂燃烧反应放热提高推进剂的爆热与比冲,其氧化产物Al2O3的气化热较高,冷凝时的放热将进一步增加推进剂能量[1]。Alavi等[2]和Puri等[3]运用分子动力学分别研究了粒径在1.0~3.4 nm以及2~9 nm铝颗粒的熔点,结果表明,粒径在1 nm的铝颗粒的熔点为400 K,明显低于大颗粒铝的熔点(933 K)。Bazyn等[4]研究了初始温度为2 640 K,环境压力为3~30 atm粒径为10 μm的铝颗粒的燃烧过程,发现该粒径铝颗粒的燃烧时间受环境压力影响非常显著。Park等[5]和Trunov等[6]通过对铝颗粒的点火燃烧实验研究,发现大颗粒铝粒子在高压下的燃烧主要受扩散控制,小颗粒铝粒子在低压环境下主要受机理控制影响(即小颗粒燃烧时,颗粒表面反应速率比氧化剂扩散速率快得多)。Washburn等[7]提出纳米铝颗粒在点火过程中快速气化后同氧化剂反应,主要受反应机理控制。Lynch等[8]通过纳米铝颗粒的燃烧实验证明了其反应主要在气相中进行。
本文通过建立铝氧零维均质气相点火模型,忽略颗粒尺寸大小,基于铝与氧的反应机理,主要研究铝点火过程中参与反应的物质组分变化、2 300 K的初始环境温度下不同环境压力对反应进程的影响以及点火延迟时间与环境压力的关系。
1 计算模型
为了简化计算,提出如下基本假设:铝颗粒与空气均匀混合在恒压p0密闭环境中,在点火持续期内试验环境为绝热;为了排除输运(对流与扩散)等因素的影响,在任意时刻该反应环境温度以及物质组分的分布是均匀的;假设空气中O2与N2的体积比VO2∶VN2=1∶3.76,忽略空气中N2与其他气体对反应的影响,铝与氧气的总包反应可以描述为2Al+1.5O2→Al2O3;只考虑气相动力学反应,忽略表面动力学反应。
对于该均质系统,各组分质量分数Yk(k=1,2,…,n′,n′为组分的数量)和温度T的控制方程[9]:
(1)
(2)
式(1)中:ωk为k中组分的净生成率;Wk为第k种组分的分子质量;t为时间(s);ρ为密度(kg/m3);cp为定压比热容(J/(kg·K));hk为k组分的焓值(J/kg)。
铝点火反应机理中动力学数据由式(3)与式(4)确定,热力学数据由式(5)确定:
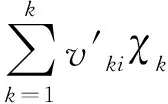
(3)
kfi=AiTniexp(-Ei/RT)
(4)
(5)
其中i为化学反应式的数量;k为组分的数量;vk为第k种组分的扩散速度;上标“ ′ ”为正方向的化学计量系数,上标“ ″ ”为反方向的化学计量系数;χk为第k种组分的摩尔分数;kfi为反应速率;Ai为指前因子;ni为温度系数;Ei为活化能;R为普适气体常数。
本文采用Catoire等[10-11]提出的Al-O气相反应动力学机理模拟分析纳米铝颗粒在空气中点火燃烧的化学反应过程,该机理由8种组分10个反应式(R1~R10)组成,如表1所示。根据Starik等[12]的研究,在机理中添加了O2分解反应R11。假设初始状态下的纳米铝颗粒为液态,在反应过程中需要考虑铝的相变,所以在研究中加入了一个具有较高速率常数的局部平衡相变反应过程式R12。由于Al2O3会迅速分解成低能氧化物和O等物质,因此加入反应式R13[13]。
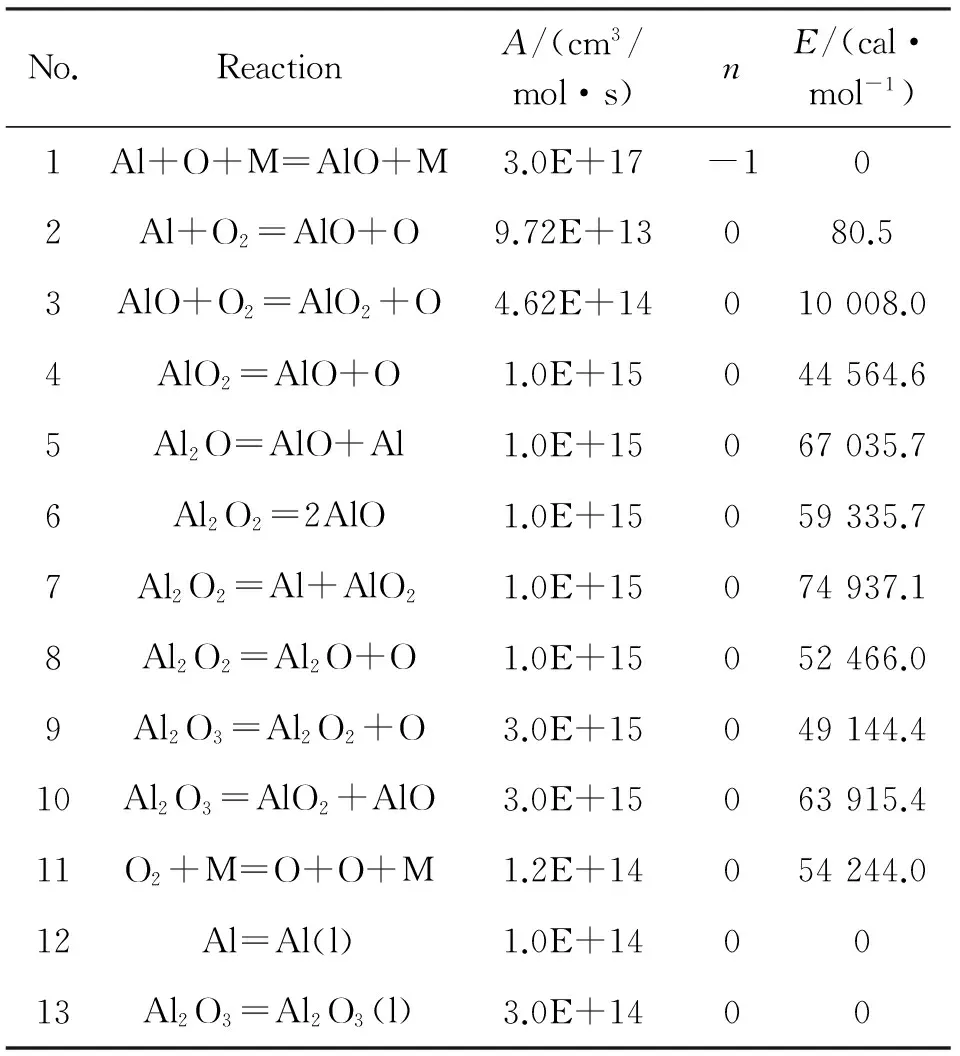
表1 铝与氧的反应机理
2 点火模拟结果与分析
针对表1铝与氧的反应机理,采用CHEMKIN-PRO软件包中封闭0维反应器(闭式均相反应器)进行求解计算,反应所涉及物质的热力学系数均通过JANNAF热力学数据表[14]和Burcat热力学数据库[15]获取。计算得到了环境压力为1 atm,温度为2 300 K时参与反应的主要物质摩尔分数与环境温度T随时间变化曲线,如图1(a)所示。
由图1(a)可以看出,在相同工况下与文献[13]所计算出的结果图1(b)吻合较好;当时间到达1×10-7s时各物质摩尔分数与温度基本达到稳定,此时认为完成点火过程,温度约为3 819 K,该条件下的点火反应过程主要集中在1.0×10-8~1.0×10-7s时间。
分别计算了初始温度为2 300 K,环境压力p0分别为1 atm、3 atm、5 atm、7 atm和9 atm的铝氧反应点火过程,不同环境压力下点火过程温度变化曲线如图2所示;环境压力与点火延迟时间的关系如图3所示;得到了点火过程中反应物、中间产物和生成物摩尔分数随时间变化曲线,分别如图4~图6所示。
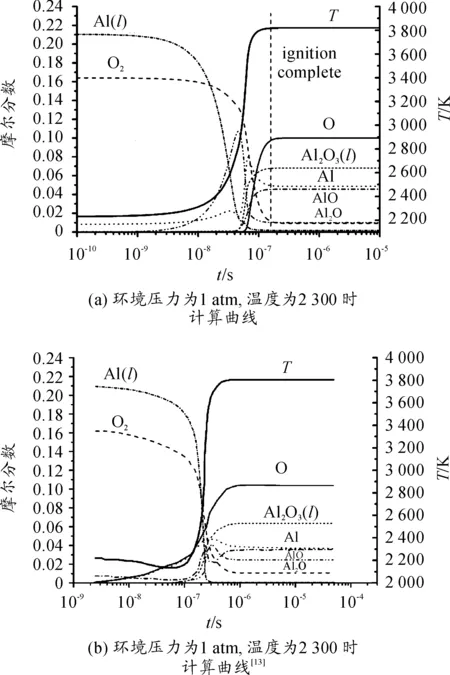
图1 点火过程主要物质摩尔分数与温度随时间变化曲线
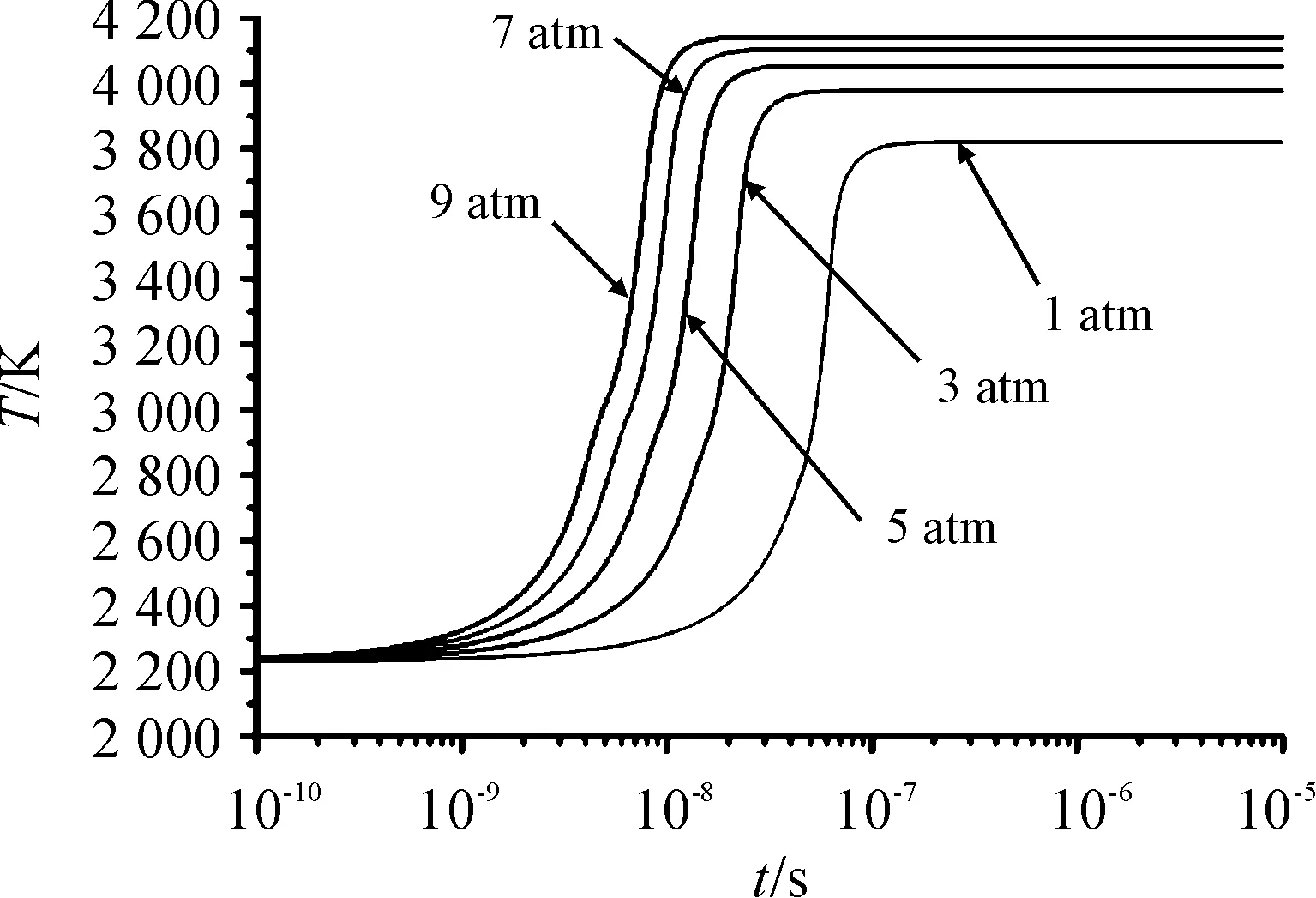
图2 不同环境压力下点火过程温度变化曲线
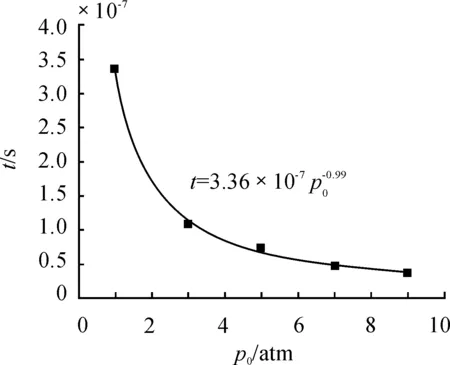
图3 环境压力与点火延迟时间曲线
由图2中可以看出:环境压力越高,铝点火延迟时间越短。这是因为压力升高加快了铝与氧气的氧化反应进程;环境压力p0的不同对点火完成时的温度影响比较大,如当环境压力为1 atm时,点火温度约为3 819 K,环境压力为9 atm时,点火温度约为4 141 K。由图3可以看出点火延迟时间随环境压力的增加而减小,其变化趋势与文献[16]的实验结果吻合。通过拟合点火延迟时间与环境压力的关系可得两者关系近似成反比关系,拟合曲线关系式为t=3.36×10-7p0-0.99。
由图4中可以看出O2和Al(l)变化趋势基本相同,Al(l)的摩尔分数首先减少。这是因为反应是在气相中进行,Al(l)首先需要通过假定的反应式R12蒸发成Al,随后进行反应R2使得Al(l)和O2的摩尔分数下降趋势相同;不同的环境压力改变了O2与Al(l)摩尔分数达到平衡的时间,也改变了O2达到平衡时的摩尔分数;环境压力越大达到平衡时的O2摩尔分数就越大。
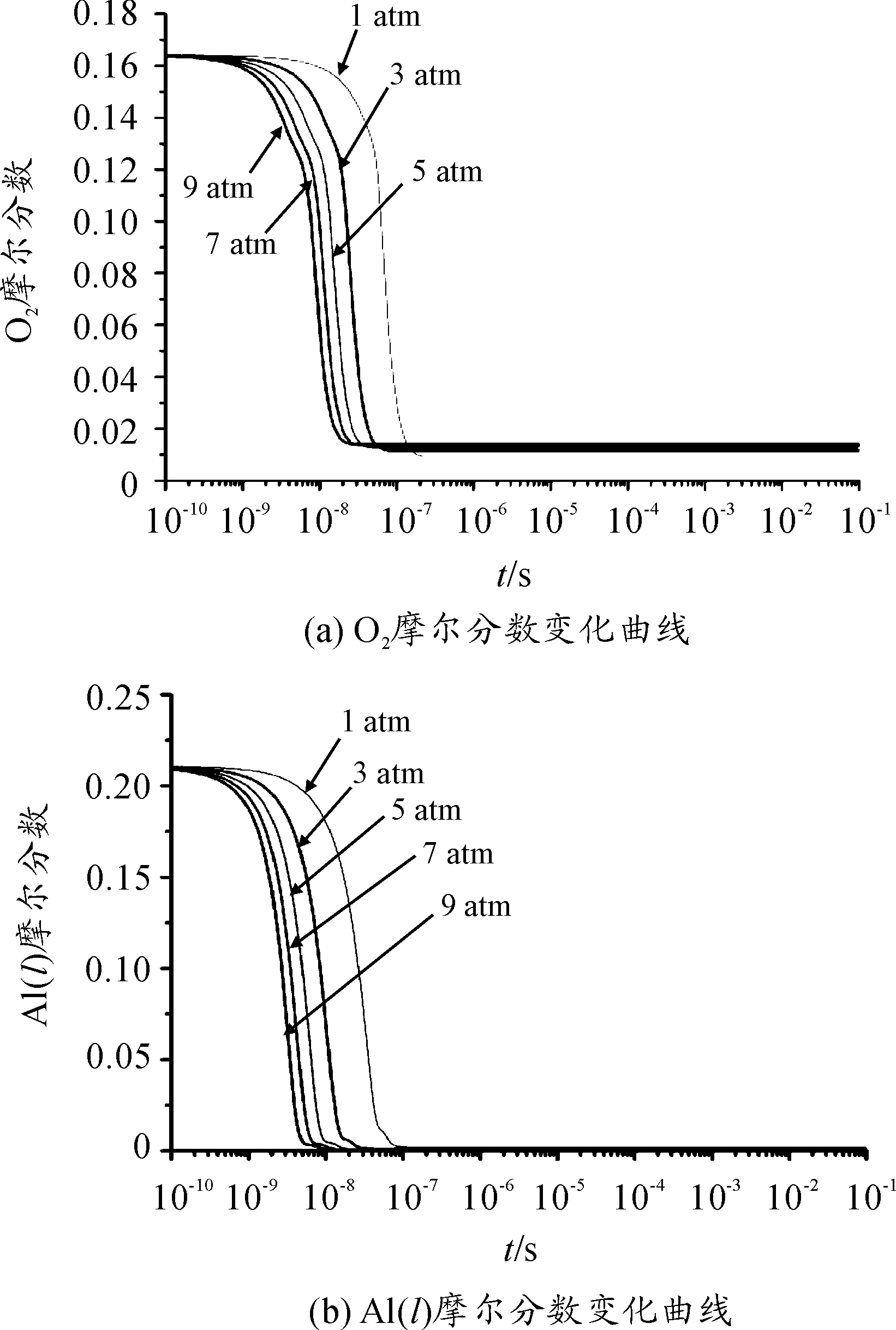
图4 不同环境压力下反应物摩尔分数变化曲线
由图5(a)可以看出在Al2O的摩尔分数首先迅速增至峰值,随后又快速下降达到平衡位置。这是因为随着R2反应的进行环境中不断生成AlO,AlO与Al结合通过反应R5生成Al2O,随后Al2O的摩尔分数下降的原因是因为Al2O与O结合生成Al2O2(反应式R8),从而使Al2O2的摩尔分数增加(图5(b)),生成的Al2O2紧接着又和O结合生成Al2O3(反应式R9),所以Al2O2的摩尔分数又下降,最终达到稳定值;从图5可以看出环境压力的不同并没有改变反应中间产物的摩尔分数变化趋势,但改变了中间产物到达平衡时的摩尔分数,改变了反应历程的时间;环境压力越高反应中间产物Al2O、Al2O2、AlO、Al2O3、AlO2达到平衡时的摩尔分数也越大,中间产物O的摩尔分数降低,使得燃烧更充分,点火完成时的温度越高(图2)。

图5 不同环境压力下中间产物摩尔分数随时间变化曲线

图6 不同环境压力下生成物摩尔分数变化曲线
由图6中可以看出:Al的摩尔分数先增加再减少,这是因为点火初期Al(l)蒸发成Al,使Al的摩尔分数上升至最大,随后Al与O2和AlO反应(反应式R2和R5)消耗Al,使得Al的摩尔分数下降,当Al(l)的蒸发量与Al的消耗量达到平衡时,此时Al的摩尔分数不变,点火完成;图6(a)显示反应环境压力越高,点火过程中Al的摩尔分数上升过程中所到达的峰值越小,反应平衡时Al的摩尔分数也小,说明环境压力高不利于铝的蒸发,但有利于铝蒸气的消耗;图6(b)显示环境压力的变化并不影响Al2O3(l)平衡时的摩尔分数,说明环境压力的变化并不会改变反应平衡时Al2O3(l)的摩尔分数。
3 结论
通过对铝与氧气反应的机理研究,认为铝在点火过程中所经历的主要反应过程为R2、R5、R8和R9;计算结果表明:在初始温度为2 300 K,环境压力为1 atm时的点火过程中,主要物质摩尔分数随时间与温度变化特征与文献[13]吻合较好。通过环境压力的变化对点火延迟时间的计算分析,发现点火环境压力的升高明显缩短了点火延迟时间,且点火延迟时间与环境压力近似成反比关系,拟合曲线关系式为t=3.36×10-7p0-0.99。环境压力越高,参与反应的中间产物Al2O、Al2O2、AlO、Al2O3、AlO2达到平衡时的摩尔分数也就越大,而中间产物O的摩尔分数越低;Al的次级氧化物的摩尔分数增加有利于点火过程,点火完成时的温度越高。
[1] 李颖,宋武林,谢长生,等.纳米铝粉在固体推进剂中的应用进展[J].兵工学报,2005,26(1):121-125.
[2] ALAVI S,THOMPSON D L.Molecular Dynamics Simulations of The Melting of Aluminum Nanoparticles[J]. The Journal of Physical Chemistry A,2006,110(4):1518-1523.
[3] PURI P,YANG V.Effect of Particle Size on Melting of Aluminum at Nano Scales [J].The Journal of Physical Chemistry C,2007,111(32):11776-11783.
[4] BAZYN T,KRIER H,GLUMAC N.Oxidizer And Pressure Effects on The Combustion of 10-Micron Aluminum Particles [J].Journal of Propulsion and Power,2005,21(4):577-582.
[5] PARK K,LEE D,RAI A,et al.Size-Resolved Kinetic Measurements of Aluminum Nanoparticle Oxidation With Single Particle Mass Spectrometry [J].The Journal of Physical Chemistry B,2005,109(15):7290-7299.
[6] TRUNOV M A,SCHOENITZ M,DREIZIN E L.Effect of Polymorphic Phase Transformations in Alumina Layer on Ignition of Aluminium Particles [J].Combustion Theory and Modelling,2006,10(4):603-623.
[7] WASHBURN E B,TRIVEDI J N,CATOIRE L,et al.The Simulation of The Combustion of Micrometer-Sized Aluminum Particles With Steam [J]. Combustion Science And Technology,2008,180(8):1502-1517.
[8] LYNCH P,FIORE G,KRIER H,et al.Gas-phase Reaction in Nanoaluminum Combustion[J].Combustion Science and Technology,2010,182(7):842-857.
[9] KEE R J,RUPLEY F M,MEEKS E,et al.CHEMKIN-III:A FORTRAN Chemical Kinetics Package for The Analysis of Gas-Phase Chemical And Plasma Kinetics [R].Sandia National Laboratories Report.1996,SAND96-8216.
[10]CATOIRE L,JEAN-FRAN-ATILDE,LEGENDRE O,et al.Kinetic Model For Aluminum-sensitized Ram Accelerator Combustion [J].Journal Of Propulsion And Power,2003,19(2):196-202.
[11]SWIHART M T,CATOIRE L,LEGRAND B,et al.Rate Constants For The Homogeneous Gas-Phase Al/HCl Combustion Chemistry[J].Combustion And Flame,2003,132(1):91-101.
[12]STARIK A M,KULESHOV P S,SHARIPOV A S,et al.Numerical Analysis of Nanoaluminum Combustion in Steam[J]. Combustion And Flame,2014,161(6):1659-1667.
[13]HUANG Y,RISHA G A,YANG V,et al.Effect of Particle Size on Combustion of Aluminum Particle Dust in Air [J]. Combustion And Flame,2009,156(1):5-13.
[14]CHASE M W.JANAF Thermochemical Tables [J].JANAF Thermochemical Tables,By Chase,MW Washington,DC:American Chemical Society; New York:American Institute of Physics for The National Bureau of Standards,C1986.United States.National Bureau of Standards.1986.
[15]BURCAT A,RUSCIC B.Third Millenium Ideal Gas And Condensed Phase Thermochemical Database For Combustion With Updates From Active Thermochemical Tables[M].Argonne National Laboratory Argonne,IL,2005.
[16]彭晶,肖进.压力对纳米铝粉燃烧性能的影响[J].化学推进剂与高分子材料,2015,13(3):53-58.
(责任编辑杨继森)
Numerical Analysis of Aluminum/Oxygen Ignition Under Different Environmental Pressure
TIAN Ru-yuan, ZHANG Ling-ke
(School of Energy and Power Engineering, Nanjing University of Science and Technology, Nanjing 210094, China)
In order to study the influence of the environmental pressure to aluminum ignition in gas phase, the zero-dimensional model of homogeneous ignition was established with Al-O2reaction mechanism and calculated by using the CHEMKIN-PRO software package. The influences of main elementary reactions of the ignition process were illustrated. The mole fraction of main substances involved in the ignition process versus time was obtained and analyzed. The ignition delay time on different environmental pressure(1~9 atm)were analyzed, and their relationship is thatt=3.36×10-7p0-0.99. And the change rule of mole fraction influence of the environmental pressure to O2, Al(l), Al2O, Al2O2, AlO, Al2O3, O, AlO2, Al, Al2O(l) were obtained in the ignition process respectively.
energetic materials; Al/O reaction; ignition process; environmental pressure; numerical analysis
2016-07-22;
国家自然科学基金资助(51106075)
田入园(1992—),男,硕士研究生,主要从事金属添加剂燃烧特性研究。
10.11809/scbgxb2016.12.034
田入园,张领科.环境压力对铝氧反应点火过程影响的计算分析[J].兵器装备工程学报,2016(12):150-154.
format:TIAN Ru-yuan, ZHANG Ling-ke.Numerical Analysis of Aluminum/Oxygen Ignition Under Different Environmental Pressure[J].Journal of Ordnance Equipment Engineering,2016(12):150-154.
V311+.3
A
2096-2304(2016)12-0150-05
修回日期:2016-08-23

