瑞芬太尼诱发大鼠痛觉过敏的机制
付艾平,宋慧洁,刘敬臣,蓝雨雁
(广西医科大学第一附属医院,南宁530021)
瑞芬太尼诱发大鼠痛觉过敏的机制
付艾平,宋慧洁,刘敬臣,蓝雨雁
(广西医科大学第一附属医院,南宁530021)
目的 探讨瑞芬太尼诱发痛觉过敏的机制。方法 取24只SD大鼠,右颈静脉置入静脉留置针,随机分为三组,每组8只。对照组静脉泵注生理盐水1.0 μg/(kg·min),持续2 h;瑞芬太尼组静脉泵注瑞芬太尼1.0 μg/(kg·min),持续 2 h;A-803467组静脉注射A-803467 20 mg/kg,10 min后静脉泵注瑞芬太尼1.0 μg/(kg·min),持续 2 h。各组分别于颈静脉置管前(t0)、颈静脉置管完成时(t1),给药后0.5、1、2 h(t2、t3、t4)及停药后0.5 h(t5)检测热痛觉阈值。最后一次检测完热痛觉阈值后取大鼠背根神经,采用RT-PCR法检测Na1.8 mRNA表达,采用免疫组化法检测Nav1.8蛋白表达。结果 三组t0、t1时热痛觉阈值比较差异均无统计学意义(P均>0.05);瑞芬太尼组、A-803467组t2、t3、t4时热痛觉阈值均高于对照组(P均<0.05),t5时热痛觉阈值均低于对照组(P均<0.05);瑞芬太尼组t5时热痛觉阈值低于A-803467组(P<0.05)。瑞芬太尼组、A-803467组Nav1.8 mRNA及蛋白表达均高于对照组(P均<0.05),两组间比较差异均无统计学意义(P均>0.05)。结论 瑞芬太尼诱发痛觉过敏的机制可能为激活Nav1.8 通道,增加Nav1.8 通道蛋白表达。
痛觉过敏;瑞芬太尼;Nav1.8;背根神经节
瑞芬太尼广泛应用于临床麻醉和镇痛,但可诱发痛觉过敏[1],导致麻醉恢复期患者躁动及高应激反应,诱发心脑血管并发症。门控离子通道是可兴奋细胞产生动作电位的基础,Nav1.8是特异性高表达在背根神经节初级感觉小神经元中的一种电压门控钠离子通道,是其所在细胞产生动作电位去极化期钠离子电流的主要通道,与疼痛的产生关系密切。Nav1.8通道蛋白主要表达于小直径背根神经节的C纤维上[2],对正常疼痛和痛觉过敏的产生发挥重要作用[3]。2013年4~10月,我们观察了瑞芬太尼对大鼠热痛觉阈值及其背根神经节 Nav1.8通道蛋白表达的影响。现分析结果,探讨瑞芬太尼诱发痛觉过敏的机制。
1 材料与方法
1.1 材料 健康成年SD大鼠24只,雄性,体质量250~300 g,由广西医科大学动物科学实验中心提供,动物许可证号:SCXK(桂)2003-0005。瑞芬太尼(湖北宜昌人福药业有限责任公司),Nav1.8通道拮抗剂A-803467(上海西格玛奥德里齐贸易有限公司),兔抗鼠Nav1.8抗体(美国Abcam公司);XR-YLS-12A鼠尾光照测痛仪(上海欣软信息科技有限公司)。
1.2 动物分组及处理 取24只大鼠,腹腔注射5%水合氯醛(350 mg/kg)麻醉后固定于操作台,沿颈中线偏右侧纵行剪开皮肤,显露右颈静脉,置入静脉留置针,回抽有血后,接好充满肝素的接头和肝素帽,颈背部用7号线缝合固定,并用络合碘消毒;肝素盐水冲管(0.5 mL/d),同时肌注青霉素钠(10 U/d)。采用随机数字表法将置管后的大鼠分为对照组、瑞芬太尼组、A-803467组,每组8只。对照组静脉泵注生理盐水1.0 μg/(kg·min),持续2 h;瑞芬太尼组静脉泵注瑞芬太尼1.0 μg/(kg·min),持续 2 h;A-803467组静脉注射A-803467 20 mg/kg,10 min后静脉泵注瑞芬太尼1.0 μg/(kg·min),持续2 h。
1.3 相关指标观察
1.3.1 热痛阈值 三组分别于颈静脉置管前(t0)、颈静脉置管完成时(t1),给药后0.5、1、2 h(t2、t3、t4)及停药后0.5 h(t5)检测热痛觉阈值。具体方法:将大鼠装入固定器内适应5 min,使其鼠尾固定不动,条形光束照射鼠尾中外1/3交界处,采用XR-YLS-12A鼠尾光照测痛仪记录从照射开始到甩尾的时间,即热痛觉阈值。重复测定3次,每次间隔1 min,取平均值。
1.3.2 背根神经节Nav1.8 mRNA表达 最后一次检测完热痛觉阈值后,各组随机取4只,腹腔注射10%水合氯醛300 mg/kg,麻醉后固定于冰上,心脏插管;采用生理盐水灌注直至流出液澄清。迅速摘取大鼠背根神经节,采用RT-PCR法检测Na1.8 mRNA表达。采用TRIzol法提取总RNA,检测总RNA浓度和纯度。使用TIANScript cDNA第1链合成试剂盒按说明书操作提取总RNA后逆转录合成cDNA,采用20 μL体系进行PCR扩增。Nav.18的PCR反应条件:94 ℃预变性5 min、94 ℃变性30 s、58 ℃退火30 s、72℃延伸1 min,40个循环;72 ℃再延伸10 min。β-actin的PCR反应条件:94 ℃预变性5 min、94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸1 min,40个循环;72 ℃再延伸10 min。取PCR产物进行凝胶电泳,成像分析系统扫描获取的电泳图像,应用AlphaView SA系统进行分析,以Nav1.8条带灰度值与内参条带灰度值的比值作为Nav1.8 mRNA的表达水平。
1.3.3 背根神经节Nav1.8蛋白表达 取三组剩余大鼠(每组4只),参照1.3.2方法摘取背根神经节,常规石蜡包埋后切片,采用免疫组化法测定Nav1.8蛋白表达。在切片中加入兔抗大鼠Nav1.8多克隆抗体50 μL,4 ℃冰箱过夜;滴加生物素标记的二抗,37 ℃孵育15 min;中性树胶封片,用光学显微镜观察切片染色情况,在400倍镜下拍摄;采用Image-Pro Plus6.0软件计算阳性染色(细胞着黄色)区域的积分光密度值。
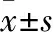
2 结果
2.1 三组热痛阈值比较 三组t0、t1时热痛阈值比较差异无统计学意义(P均>0.05);瑞芬太尼组、A-803467组t2、t3、t4时热痛觉阈值均高于对照组(P均<0.05),t5时热痛觉阈值均低于对照组(P均<0.05);瑞芬太尼组t5时热痛觉阈值低于A-803467组( P<0.05)。见表1。
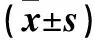
表1 三组各时间点热痛觉阈值比较
注:与对照组同时间点比较,*P<0.05; 与瑞芬太尼组同时间点比较,#P<0.05。
2.2 三组背根神经节Nav1.8 mRNA及其蛋白表达比较 瑞芬太尼组、A-803467组Nav1.8 mRNA及蛋白相对表达量均高于对照组(P均<0.05),两组间比较差异均无统计学意义(P均>0.05)。见表2。

表2 三组背根神经节Nav1.8 mRNA及其蛋白相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
术中使用阿片类药物尤其是大剂量使用是诱发术后痛觉过敏的重要原因[4]。瑞芬太尼是超短效阿片受体激动剂,具有镇痛起效迅速、作用时间短、不依赖肝肾代谢、 无蓄积作用等优点[5], 但其消除半衰期为3~10 min,停药后很快出现痛觉过敏,停药后30 min痛阈值降至最低;其诱发痛觉过敏作用较其他阿片类药物更为显著[6~8]。目前对中枢致敏的研究主要集中在脊髓,研究发现热痛刺激感受器在脊髓。本研究结果显示,三组t0、t1时点热痛觉阈值比较差异均无统计学意义,排除了颈静脉置管对热痛觉阈值的影响;瑞芬太尼组、A-803467组t2、t3、t4时点热痛觉阈值均高于对照组,提示瑞芬太尼具有镇痛作用。本研究t5时瑞芬太尼组热痛觉阈值低于对照组,表明持续泵入瑞芬太尼可诱发大鼠痛觉过敏;t5时瑞芬太尼组较A-803467组热痛阈值降低,说明阻滞Nav1.8通道后瑞芬太尼仍可诱发痛觉过敏,但作用明显减弱。
河豚毒素不敏感型电压门控钠通道亚型Nav1.8主要表达于背根神经节小直径C纤维神经元上,该通道的开放直接导致动作电位的产生[11,12],在感受伤害的背根神经节神经元动作电位的电位生成中占据主导地位[13],在伤害性感受器外周致敏过程中发挥重要作用。本研究结果显示,瑞芬太尼组、A-803467组背根神经节Nav1.8 mRNA及相对表达量均高于对照组,A-803467组与瑞芬太尼组比较差异均无统计学意义;提示瑞芬太尼诱发痛觉过敏与Nav1.8过表达有关。瑞芬太尼停药后可导致μ受体很快与抑制型G蛋白解偶联,使第二信使cAMP反射性升高,导致Nav1.8表达增多;另外,瑞芬太尼活化可以兴奋G蛋白,直接改变背根神经节离子通道的数量和状态,使Nav1.8蛋白表达增多[9]。瑞芬太尼诱发大鼠痛觉过敏时激活Nav1.8通道,引起背根神经节上电压门控Na离子的数量、种类、分布及电生理学活性发生改变,导致背根神经元兴奋性升高、放电频率增多或产生异位放电[3,14,15],这些变化可以进一步引起中枢神经系统的敏化,从而诱发痛觉过敏。
综上所述,瑞芬太尼诱发大鼠痛觉过敏的机制为激活其背根神经节上 Nav1.8 通道,使 Nav1.8 通道蛋白表达增加。
[1] Cabanero D, Celerier E, Garcia-Nogales P, et al. The pro-nociceptive effects of remifentanil or surgical injury in mice are associated with a decrease in delta-opioid receptor mRNA levels: prevention of the nociceptive response by on-site delivery of enkephalins[J]. Pain, 2009,141(1-2):88-96.
[2] Blair NT, Bean BP. Roles of tetrodotoxin (TTX)-sensitive Na+current, TTX-resistant Na+current, and Ca2+current in the action potentials of nociceptive sensory neurons[J]. Neuroscience, 2002,22(23):10277-10290.
[3] Lampert A, O′Reilly AO, Reeh P,et al. Sodium channelopathies and pain[J]. Physiology, 2010,460(2):249-263.
[4] Silverman SM. Opioid induced hyperalgesia: clinical implications for the pain practitioner[J]. Pain Physician, 2009,12(3):679-684.
[5] 周莹,李国利,滕金亮.N-甲基-D-天冬氨酸受体在瑞芬太尼诱发痛觉过敏中作用的研究进展[J].国际麻醉学与复苏杂志,2015,36(3):271-274.
[6] Wu CL, Raja SN. Treatment of acute postoperative pain[J]. Lancet (London, England), 2011,377(9784):2215-2225.
[7] Hood DD, Curry R, Eisenach JC. Intravenous remifentanil produces withdrawal hyperalgesia in volunteers with capsaicin-induced hyperalgesia[J]. Anesth Analg, 2003,97(3):810-815.
[8] Lee C, Song YK, Jeong HM,et al. The effects of magnesium sulfate infiltration on perioperative opioid consumption and opioid-induced hyperalgesia in patients undergoing robot-assisted laparoscopic prostatectomy with remifentanil-based anesthesia[J]. Korean J Anesthesiol, 2011,61(3):244-250.
[9] Zhao M, Joo DT. Enhancement of spinal N-methyl-D-aspartate receptor function by remifentanil action at delta-opioid receptors as a mechanism for acute opioid-induced hyperalgesia or tolerance[J]. Anesthesiology, 2008,109(2):308-317.
[10] 王春艳,李依泽,王海云,等.切口痛-瑞芬太尼痛觉过敏大鼠脊髓NMDA受体功能与δ阿片受体的关系[J].中华麻醉学杂志,2014,34(8):968-971.
[11] Fang X, Djouhri L, McMullan S, et al. Intense isolectin-B4 binding in rat dorsal root ganglion neurons distinguishes C-fiber nociceptors with broad action potentials and high Nav1.9 expression[J]. Neuroscience, 2006,26(27):7281-7292.
[12] Goldin AL. Resurgence of sodium channel research[J]. Annu Rev Physiol, 2001(63):871-894.
[13] Renganathan M, Cummins TR, Waxman SG. Contribution of Na(v)1.8 sodium channels to action potential electrogenesis in DRG neurons[J]. Neurophysiology, 2001,86(2):629-640.
[14] Dib-Hajj SD, Black JA, Waxman SG. Voltage-gated sodium channels: therapeutic targets for pain[J]. Pain Medicine, 2009,10(7):1260-1269.
[15] Raouf R, Quick K, Wood JN. Pain as a channelopathy[J]. J Clin Invest, 2010,120(11):3745-3752.
广西自然科学基金资助项目(2011GXNSFA018222);广西研究生教育创新计划资助项目(YCSZ2012039)。
蓝雨雁(E-mail: blueyuyan@163.com)
10.3969/j.issn.1002-266X.2016.44.013
R614.2
A
1002-266X(2016)44-0040-03
2015-12-31)

