乳腺癌组织CD10、MMP-3蛋白表达及其临床意义
于静,张晓莹,房爱菊,戴宗燕,石冉冉,程凤凤
(1齐鲁医学检验所,济南250031;2山东省交通医院)
乳腺癌组织CD10、MMP-3蛋白表达及其临床意义
于静1,张晓莹2,房爱菊2,戴宗燕1,石冉冉1,程凤凤2
(1齐鲁医学检验所,济南250031;2山东省交通医院)
目的 观察乳腺癌组织CD10、基质金属蛋白酶3(MMP-3)表达,探讨其临床意义。方法 采用免疫组化SP法检测乳腺癌组织(乳腺导管原位癌23例、微小浸润乳腺癌16例、乳腺浸润性导管癌81例)和对照组乳腺组织(健康人16例、乳腺良性疾病24例)CD10和MMP-3表达,分析乳腺癌组织CD10、MMP-3表达及二者共表达与患者临床病理参数的关系,以及二者的相关性。结果 导管原位癌、微小浸润乳腺癌、乳腺浸润性导管癌组织中CD10阳性表达率分别为39.1%、43.8%、92.6%,MMP-3阳性表达率分别为34.8%、37.5%、86.4%,均高于对照乳腺组织的12.5%、10.0%(P均<0.05);乳腺浸润性导管癌组织中二者阳性表达率均高于乳腺导管原位癌及微小浸润乳腺癌(P均<0.05 )。乳腺癌组织CD10、MMP-3表达和二者共表达均与患者年龄、淋巴结转移、组织学类型相关(P均<0.05)。乳腺癌组织中CD10和MMP-3表达呈正相关(r=0.436,P<0.05)。结论 乳腺癌组织CD10、MMP-3表达增加,二者的表达变化参与乳腺癌的浸润转移。
乳腺癌;CD10;基质金属蛋白酶3
乳腺癌是危害女性健康的常见恶性肿瘤之一,其浸润与转移是影响患者预后的主要原因。CD10是一种具有中性金属内肽酶活性的细胞表面酶,具有降解基底膜及基质的作用,表达于间质细胞时参与多种肿瘤细胞的侵袭转移。基质金属蛋白酶3(MMP-3)又称基质分解素1,是基质金属蛋白酶(MMPs)家族中功能最活跃的成员之一,不仅与肿瘤生长有关,还可破坏周围正常组织的基质结构而便于肿瘤细胞增殖,导致周围纤维结缔组织结构松弛而利于肿瘤细胞侵袭转移。本研究检测乳腺癌组织CD10、MMP-3表达,探讨其临床意义。
1 资料与方法
1.1 临床资料 选取2012年1月~2015年6月济南齐鲁医学检验所、山东省交通医院手术切除的女性乳腺癌组织标本120例(观察组),患者年龄28~88岁,中位年龄 52 岁;其中乳腺导管原位癌23例、微小浸润乳腺癌16例、乳腺浸润性导管癌81例,低中分化72例、高分化48例;雌激素受体(ER)阳性88例、阴性32例,孕激素受体(PR)阳性89例、阴性31例,原癌基因人类表皮生长因子受体2(Her-2)++/+++52例、-/+68例;入组前均未接受任何治疗,均无肿瘤家族史。另选对照乳腺组织40例(对照组),患者年龄27~88岁、中位年龄52岁,包括健康人16例、乳腺纤维腺瘤12例、乳腺增生症12例。两组年龄具有可比性。
1.2 乳腺组织CD10、MMP-3表达 乳腺组织均用10%中性甲醛固定,石蜡包埋,3 μm厚连续切片。采用免疫组化SP法检测CD10、MMP-3表达,抗原修复用pH 8.0的乙二胺四乙酸,均设立阳性对照及阴性对照,具体步骤参照试剂盒(福建迈新生物技术开发有限公司)说明书。阳性对照为良性乳腺组织内呈花环状连续环绕于小导管周围CD10阳性的肌上皮细胞,阴性对照为以PBS代替一抗。
CD10表达于癌周间质细胞的细胞质、细胞膜及基质,MMP-3表达于肿瘤细胞质;两者均以细胞质和(或)基质内出现清晰均匀的棕黄色或褐色颗粒同时背景无非特异性着色为阳性。免疫组化结果以染色强度评分与阳性细胞百分比评分之和综合判断[1]。染色强度:不显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比:无阳性细胞为0分,阳性细胞≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。两项得分相加:0分为阴性(-),1~2分为低表达(+),3~4分为中表达(++),5~6分为高表达(+++)。中、高表达判定为过度表达。CD10、MMP-3表达均为+~+++,判定为二者共同表达。
1.3 统计学方法 采用SPSS19.0统计软件。各组乳腺组织中CD10、MMP-3表达比较采用非参数秩和检验,其中两个独立样本比较应用Mann-Whitney检验,多个独立样本比较采用Kruskal-Wallis检验。乳腺癌组织CD10、MMP-3表达与患者临床病理参数的关系采用χ2检验。相关性分析采用Spearman相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 CD10、MMP-3表达 40例正常及良性乳腺组织中5例间质细胞及基质中CD10弱阳性表达,4例旺炽性增生的导管上皮细胞质中MMP-3弱阳性表达。120例乳腺癌组织中,91例间质细胞阳性表达CD10;84例肿瘤细胞表达MMP-3;76例二者共表达。观察组乳腺导管原位癌、微小浸润乳腺癌、乳腺浸润性导管癌组织及对照组CD10阳性表达率分别为39.1%、43.8%、92.6%、12.5%,过度表达率分别为13.0%、37.5%、67.9%、0;MMP-3阳性表达率分别为34.8%、37.5%、86.4%、10.0%,过度表达率分别为0、37.5%、69.1%、0;观察组各组织CD10、MMP-3阳性表达率及过度表达率均高于对照组(P均<0.05);浸润性导管癌组织中二者阳性表达率及过度表达率均高于乳腺导管原位癌和微小浸润乳腺癌组织(P均<0.05)。见表1。
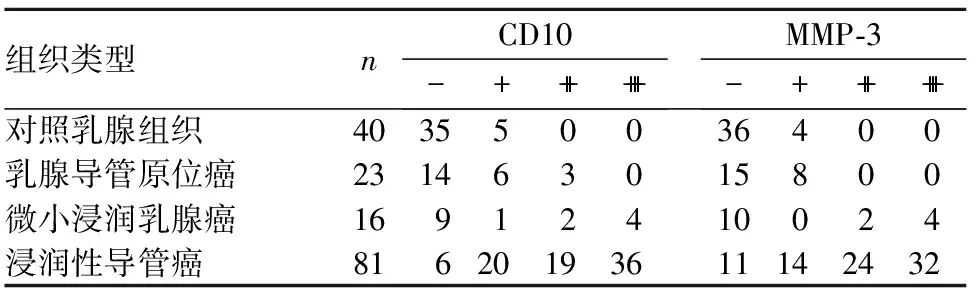
表1 各乳腺组织CD10、MMP-3表达(例)
2.2 乳腺癌组织CD10、MMP-3表达及二者共表达与患者临床病理参数的关系 乳腺癌组织CD10、MMP-3表达及二者共表达均与患者年龄、淋巴结转移、组织学类型有关(P均<0.05),与肿瘤直径、组织学分级、TNM分期、ER、PR、Her-2表达情况等均无关(P均>0.05)。见表2。
2.3 乳腺癌组织CD10和MMP-3表达的相关性 乳腺癌组织中CD10和MMP-3表达呈正相关(r=0.436,P<0.05)。见表3。
3 讨论
在乳腺癌发生、发展的过程中,肿瘤间质形成了有利于其生长的微环境。表达CD10的间质细胞属于肌纤维母细胞,是肿瘤间质的主要成分,其表达的CD10可通过降解基底膜及改变基质癌周环境进而促进肿瘤的转移扩散,同时在复发过程中发挥重要作用[2,3]。Gnemmi等[4]研究发现,CD10表达与肾透明细胞癌转移致胰腺癌相关;周春辉等[5]研究显示,CD10阳性表达在胰腺癌的发展、转移及预后中发挥重要作用;间质CD10表达亦与结肠癌、食管鳞状细胞癌发生有关[6,7];Iwaya等[8]观察到浸润性导管癌中间质细胞表达CD10,在导管原位癌中未见CD10表达;Makretsov等[9]研究发现,438例浸润性导管癌和15例导管原位癌患者中间质细胞均表达CD10;这些实验说明CD10参与了肿瘤的浸润转移,并与患者预后密切相关。
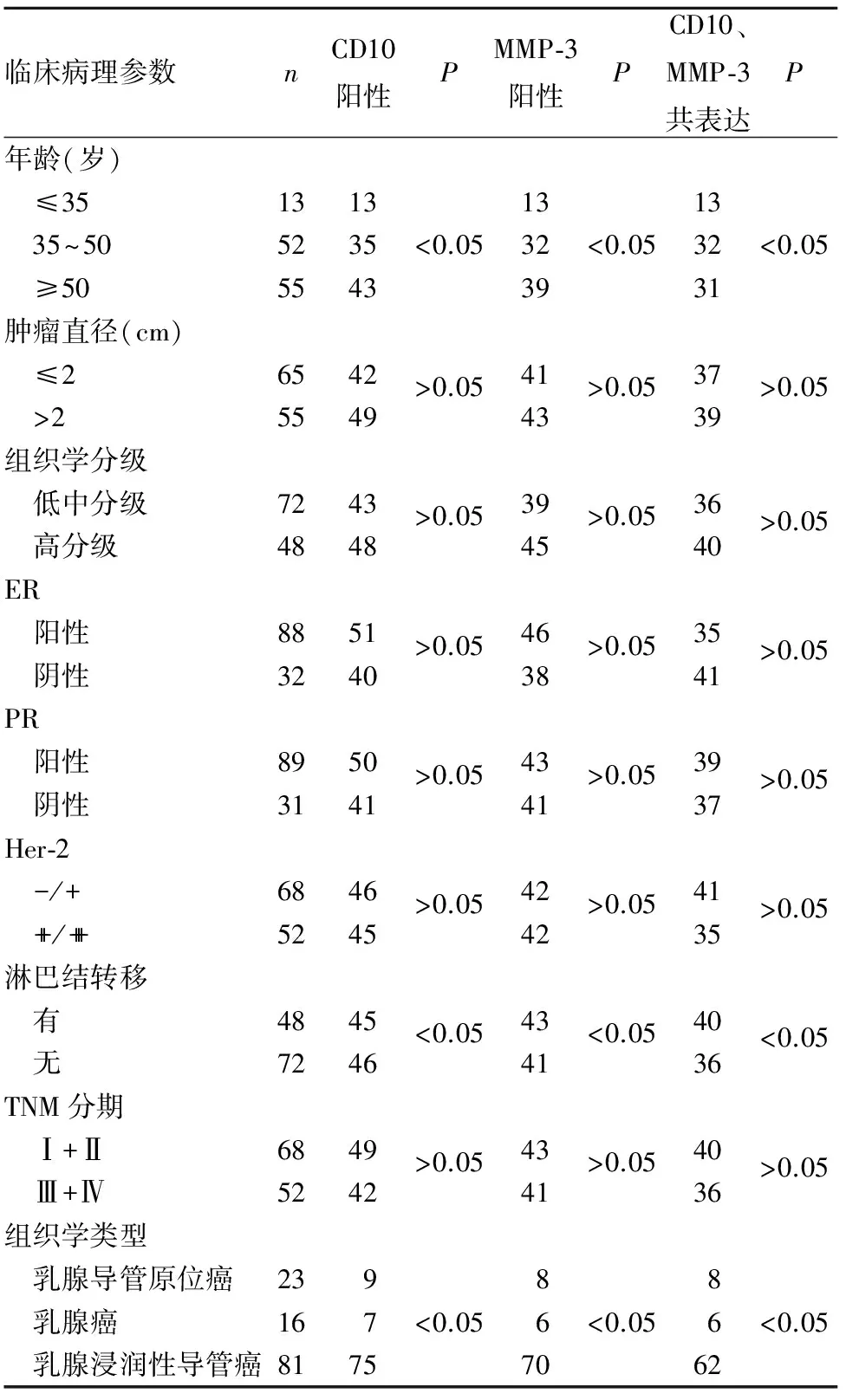
表2 乳腺癌组织CD10、MMP-3表达与患者临床病理参数的关系(例)

表3 乳腺癌组织CD10、MMP-3表达的相关性(例)
MMPs是参与修饰和降解细胞外基质的蛋白酶家族中的一类,是介导乳腺间充质转化的关键因素,能够通过促进上皮细胞与周围组织分离、调节细胞信号通路等途径提高乳腺癌侵袭转移能力。MMP-3是MMPs中功能最活跃的成员之一,可破坏内皮衍生的基底膜蛋白多糖,降解细胞外基质。MMP-3在胃肠道肿瘤、肝脏肿瘤等肿瘤细胞中均有表达[10,11]。Lochter等[12]研究发现,表达MMP-3的乳腺上皮细胞会发生细胞表型的改变,导致乳腺癌癌前病变及恶性肿瘤形成,且对细胞外基质的降解作用会促进癌细胞浸润转移。
肿瘤细胞的浸润是影响乳腺癌患者预后的主要原因之一[13],乳腺间质的侵犯可使其直接扩展。Lagios等[14]研究发现,21%的高级别乳腺导管内癌有隐性浸润灶,即使切片中未发现可疑浸润灶,乳腺导管内癌有微小浸润灶的可能性依然存在,这可能是某些未见浸润的乳腺导管内癌患者腋下出现淋巴结转移的原因。Rosen等[15]曾对18例肉眼可见的乳腺肿瘤范围以外的微小浸润进行观察,发现11%有乳腺浸润性癌存在,另有22%有乳腺原位癌存在。Page等[16]曾对25例乳腺导管原位癌患者随访3年以上,7例发展为同侧浸润性乳腺癌。超微结构观察也证实,当导管内癌尤其是高级别导管内癌本身体积达到一定程度时,基底膜出现缺损,周围间质细胞异染并伴明显纤维化[17,18]。上述研究结果提示,乳腺导管原位癌在发展为微小浸润、浸润性乳腺癌的过程中[19],间质细胞发挥了重要作用。
目前,国内关于间质CD10和MMP-3在乳腺癌组织中的表达及意义尚未见报道。本组实验结果显示,CD10和MMP-3在乳腺导管原位癌、微小浸润乳腺癌、乳腺浸润性导管癌中表达阳性率明显高于正常及良性乳腺组织,且二者共表达均与乳腺癌组织学类型密切相关,即随乳腺癌进展,CD10和MMP-3表达阳性率及过度表达率增高,此观点与国外文献报道[9]结果一致;另外,在乳腺癌组织中二者表达呈正相关,提示间质CD10和MMP-3可能共同参与了乳腺癌的发生、发展;二者共表达程度随乳腺癌组织学类型进展而升高,推测间质CD10和MMP-3共表达促进肿瘤细胞的浸润与转移,并在乳腺导管原位癌向乳腺浸润性导管癌的转化过程中可能起到关键作用。
本研究我们发现,乳腺癌组织中CD10和MMP-3表达与患者年龄密切相关,且不同年龄组间表达程度差异明显,<35岁的青年乳腺癌患者肿瘤间质细胞 CD10和MMP-3均呈中高表达,无低表达,表达阳性率均明显高于其他年龄组。既往多数文献报道,青年乳腺癌患者淋巴结转移率高,预后差[20~23]。本研究13例青年乳腺癌患者中8例出现淋巴结转移,提示过度表达的间质CD10和MMP-3可能与青年乳腺癌患者易发生淋巴结转移有关。但本研究此类病例数少,某些观点有待扩大样本后进一步研究证实。
综上所述,乳腺癌组织CD10、MMP-3表达增加,二者的表达变化参与乳腺癌的浸润转移。
[1] 许良中,杨文涛.免疫组织化学反应结果的判读标准[J].中国癌症杂志,1996,6(4):229-231.
[2] 王洁.乳腺纤维母细胞/肌纤维母细胞性肿瘤临床病理分析[J].临床与实验病理学杂志,2009,25(1):33-36.
[3] 张振涛,刘兆华,杜东梅.乳腺癌发生发展相关蛋白研究进展[J].山东医药,2015,55(33):101-102.
[4] Gnemmi V, Lerey X, Triboulet JP, et al. Pancreatic metastases of renal cell carcinoma:a clinical pathological study of 11 cases with special emphasis on the usefulness of PAX2 and mesothelin for the distinction from primary ductal adenocarcinoma of the pancreas[J]. Anal Quant Cytol Histol, 2013,35(3):57-62.
[5] 周春辉,黄世章.胰腺癌细胞中CD10mRNA的表达与肿瘤恶性程度及转移的关系[J].广东医学,2011,32(12):55-57.
[6] Fujita S, Yamamoto S, Akasu T, et al. Quantification of CD10 mRNA in colorectal cancer and relationship between mRNA expression and liver metastasis[J]. Anticancer Res, 2007,27(5A):7-11.
[7] Lee KW, Sung CO, Kim JH, et al. CD10 expression is enhanced by Twist1 and associated with poor prognosis in esophageal squamous cell carcinoma with facilitating tumorigenicity in vitro and invivo[J]. Int J Cancer, 2015,136(2):310-321.
[8] Iwaya K, Ogawa H, Izumi M, et al. Stromal expression of CD10 in invasive breast carcinoma: a new predictor of clinical outcome[J]. Virchows Arch, 2002,440(6):589-593.
[9] Makretsov NA, Hayes M, Carter BA, et al. Stromal CD10 expression in invasive breast carcinoma correlates with poor prognosis, estrogen receptor negativity, and high grade[J]. Mod Pathol, 2007,20(3):84-89.
[10] 周文鹏,樊青霞,范魁生,等.MMP-3在大肠癌中的表达及意义[J].中国实用医药,2008,3(27):26-27.
[11] 周文鹏,樊青霞,范魁生,等.胃癌患者血清MMP-3水平的临床研究[J].中国实用医药,2008,3(24):44-46.
[12] Lochter A, Galosy S, Muschler J, et al. Matrix metalloproteinasea stromelysin-1 triggers a casavde of molecular alterations that leads to epithelial-to-mesenchymal conversion and a premalignant phenotype in mammary epithelial cells[J]. Cell Biol, 1997,139(7):1861-1872.
[13] 邵志敏.沈镇宙.徐兵河.乳腺肿瘤学[M].上海:复旦大学出版社,2013:616-620.
[14] Lagios MD, Westdahl PR, Margolin FR, et al. Duct carcinoma in situ. Relationship of extent of noninvasive disease to the frequency of occult invasion, multicentricity, lymph node metastases, and short-term treatment failures[J]. Cancer, 1982,50(7):1309-1314.
[15] Rosen PP, Fracchia AA, Urban JA, et al. "Residual" mammary carcinoma following simulated partial mastectomy[J]. Cancer, 1975, 35(3):739-747.
[16] Page DL, Dopunt WD, Rogers LW, et al. Intraductal carcinoma of the breast. Follow-up after biopsy only[J]. Cancer, 1982,49(4):751-758.
[17] Betstill WL, Rosen PP, Robbins GF. Intraductal carcinoma. Long term followup after treatment by biopsy only[J]. JAMA, 1978,239(18):1863-1867.
[18] Ozzello I, Sanpitak P. Epithelial-stromal junction of intraductal carcinoma of the breast[J]. Cancer, 1970,26(6):1186-1198.
[19] 张荣菊,牛昀,高玉霞.乳腺导管原位癌浸润机制的研究进展[J].中华病理学杂志,2009,38(1)63-65.
[20] 陈建国,李伟文,朱丽,等.157例35岁以下女性乳腺癌的预后分析[J].肿瘤,2004,21(2):135-137.
[21] 李永春.青年女性乳腺癌患者临床病理学特征分析[J].中国社区医师,2015,31(6):104-105.
[22] 金琳芳,吴玉玉,冯静洁.青年乳腺癌的临床病理特点分析[J].实用癌症杂志,2012,27(5):510-511.
[23] 赵菲,姜军,范林军.等.青年女性乳腺癌35 例临床分析[J].第三军医大学学报,2003,25(23):2086-2089.
Expression and clinical significance of CD10 and MMP-3 in breast carcinoma tissues
YUJing1,ZHANGXiaoying,FANGAiju,DAIZongyan,SHIRanran,CHENGFengfeng
(1QiluClinicalLaboratory,Jinan250000,China)
Objective To detect the expression and clinical significance of CD10 and matrix metalloproteinase 3 (MMP-3) in breast cancer tissues. Methods The expression of CD10 and MMP-3 was detected in breast cancer tissues(23 cases of ductal carcinoma in situ, 16 cases of microinvasive breast carcinoma, 81 cases of invasive ductal carcinoma and), the control breast tissues (16 cases of normal tissues from healthy people and 24 cases of benign breast tissues) by immunohistochemistry. The correlations between CD10 and MMP-3 and between their co-expression and clinicopathological parameters were analyzed. Results The positive rates of CD10 expression in the ductal carcinoma in situ, microinvasive breast carcinoma and invasive ductal carcinoma were 39.1%, 43.8% and 92.6%, the positive rates of MMP-3 were 34.8%, 37.5%, and 86.4%, which were significantly higher than those of the control breast tissues (12.5% and 10.0%, allP<0.05). The positive rates of CD10 and MMP-3 expression in the invasive ductal carcinoma were higher than those of the ductal carcinoma in situ and microinvasive breast carcinoma (allP<0.05). The (both) positive rates of CD10 and MMP-3 expression were associated with age, histological type and lymph node involvement (allP<0.05). The expression of CD10 and MMP-3 was positively correlated with each other in the breast carcinoma tissues (r=0.436,P<0.05). Conclusion The CD10 and MMP-3 expression is increased in the breast cancer tissues, and the expression changes of CD10 and MMP-3 are involved in the development and metastasis of breast carcinoma.
breast carcinoma; CD10; matrix metalloproteinase 3
山东省交通运输厅科技计划项目(2013B24)。
于静(1985-),女,住院医师,研究方向为肿瘤病理。E-mail: yujing555666@126.com
简介:程凤凤(1978-),女,主治医师,研究方向为肿瘤病理。E-mail: 13210557720@126.com
10.3969/j.issn.1002-266X.2016.44.004
R737.9
B
1002-266X(2016)44-0012-04
2016-04-12)

