广东水禽源大肠埃希菌耐药性及氨基糖苷类耐药基因研究
张济培,韦庆兰,2,谭华龙,陈 冈,陈建红*
(1.佛山科学技术学院生命科学学院,广东佛山 528231;2.华南农业大学兽医学院,广东广州 510642)
广东水禽源大肠埃希菌耐药性及氨基糖苷类耐药基因研究
张济培1,韦庆兰1,2,谭华龙1,陈 冈1,陈建红1*
(1.佛山科学技术学院生命科学学院,广东佛山 528231;2.华南农业大学兽医学院,广东广州 510642)
为了调查广东地区水禽源大肠埃希菌对氨基糖苷类药物耐药现状和耐药基因的流行情况,探索大肠埃希菌的氨基糖苷类耐药基因型与耐药表型之间的关系,本研究采用琼脂梯度稀释法测定251株广东地区水禽源大肠埃希菌对氨基糖苷类药物的耐药性和采用PCR方法检测耐药基因。药敏试验结果显示,大肠埃希菌对链霉素耐药较严重,鸭源和鹅源的耐药率分别为81.58%和75.43%,对庆大霉素和卡那霉素较敏感,耐药率分别为25%和54.86%,对阿米卡星最为敏感,其中鸭源的菌株耐药率仅为1.32%。PCR方法检测显示,aadA1和aph(3′)-1检出率较高,为84.6%和91.9%,表明携带aadA1和aph(3′)-1耐药基因的水禽源大肠埃希菌在广东地区呈流行趋势。耐药基因型与耐药表型相关性分析结果显示,耐药基因rmtB的携带与4种药物(庆大霉素、阿米卡星、卡那霉素和壮观霉素)耐药株的产生具有显著相关性,表明耐药基因rmtB对大肠埃希菌耐药株的产生起重要的作用。本试验结果可为指导广东地区水禽大肠埃希菌病的临床用药提供理论基础和研究大肠埃希菌的耐药基因提供相关的数据。
水禽大肠埃希菌;氨基糖苷类药物;耐药基因型;耐药表型
自从1944年Waksman从链霉菌中发现链霉素以来,氨基糖苷类药物以及衍生物陆续被广泛应用于临床上,但耐药性已成为不可忽视的问题。大肠埃希菌对氨基糖苷类药物的耐药性以产生钝化酶为主。通过N-乙酰转移酶,O-核苷酸转移酶和O-磷酸转移酶等钝化酶(其基因包括aadA1和aph(3′)-1)对氨基糖苷类药物关键位点的化学修饰,阻断了药物与细菌16 S rRNA结合[1]。因为这些酶存在广泛的特异性底物,可以催化不只一个反应,所以此机制作用广泛且在临床上尤为重要[2]。近年来研究发现了一种新的耐药机制,通过16 S rRNA甲基化修饰靶位,而16 S rRNA 甲基化酶(其基因包括rmtB)在2003年首次被报道,该酶能够引起革兰阴性杆菌对氨基糖苷类药物的高水平耐药[3]。氨基糖苷类钝化酶和16S rRNA甲基化酶由质粒编码并与转座子相连,质粒交换和转座子传递加速了耐药基因在不同细菌间的传播,导致了严重复杂的耐药现象[4]。因此本文通过对广东地区水禽源大肠埃希菌的耐药性和耐药基因(rmtB、aadA1和aph(3′)-1)进行检测,以此为研究水禽源大肠埃希菌耐药情况和耐药表型的流行情况提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源 251株水禽源大肠埃希菌分离自广东省不同地区水禽养殖场,鹅源175株,鸭源76株,由佛山科学技术学院生命科学学院兽医学科中心实验室保存;大肠埃希菌ATCC25922质控菌购自中国药品生物制品检定所。
1.1.2 主要药品与试剂 庆大霉素、阿米卡星、卡那霉素、链霉素和壮观霉素为上海源叶生物科技有限公司产品;MH琼脂培养基和LB琼脂培养基为广东环凯生物技术有限公司产品;Premix rTaq、pMD18 T-Vector、Marker DL 2 000和感受态细胞为TaKaRa公司产品;SanPrep 柱式DNA胶回收试剂盒SanPrep 柱式DNA胶回收试剂盒为上海生工生物工程技术服务股份有限公司产品。
1.1.3 引物 使用Oligo7软件设计引物,并由英潍捷基生物有限公司合成,引物序列、片段长度和PCR退火温度见表1。
1.2 方法
1.2.1 药物敏感性试验 根据CLSI推荐的琼脂梯度稀释法进行药物敏感性试验,根据CLSI标准进行药物敏感性结果判定[5]。
1.2.2 耐药基因的PCR扩增及测序 以水煮法制备的大肠埃希菌总DNA为模版,扩增rmtB、aadA1和aph(3′)-1耐药基因,并用琼脂糖凝胶电泳检测扩增产物(退火温度见表1)。随机选取PCR扩增阳性产物,使用SanPrep 柱式DNA胶回收试剂盒回收产物,然后与pMD18 T-Vector 16 ℃连接过夜,再转化到感受态细胞中,最后做菌液PCR鉴定,将阳性重组菌送英潍捷基生物有限公司测序,并与GenBank上已注册的基因序列进行比对分析。
1.2.3 数据分析 采用SPSS 19.0软件对所得数据进行统计分析。分析水禽源大肠埃希菌耐药基因型与耐药表型的相关性时,采用Pearson卡方检验的独立性检验,P<0.01表示极显著相关,P<0.05表示显著相关,而P>0.05表示两者独立不相关。
表1 PCR引物序列
Table 1 Primer sequences of PCR

目的基因Targetgenes引物Primers引物序列(5'-3')Primersequences片段大小/bpFragmentsize退火温度/℃AnnealingtemperaturesrmtBrmtB-FrmtB-RAACCCCTTGGCGCTATACGAGCGTAGTTCGCCTCCATGCCTT31662aadA1aadA1-FaadA1-RACCTTTTGGAAACTTCGGCTTCTCGCCTTTCACGTAGTGGAC56356aph(3')-1aph(3')-1-Faph(3')-1-RAATTTATGCCTCTTCCGACCAACAACCTATTAATTTCCCCTCGT41356
2 结果
2.1 药物敏感性试验结果
在251株水禽源大肠埃希菌中,149株对氨基糖苷类药物表现耐药。水禽源大肠埃希菌对链霉素耐药较严重,鸭源和鹅源的耐药率分别为81.58%和75.43%,MIC50以及MIC90均高于256 μg/mL;对庆大霉素和卡那霉素较敏感,耐药率为25%~54.86%,MIC50为2 μg/mL~32 μg/mL;而鸭源的菌株对阿米卡星最为敏感,耐药率为1.32%,MIC50为2 μg/mL~32 μg/mL(表2)。
2.2 PCR扩增产物测序及序列分析结果
将测序结果与GenBank中已发表的rmtB、aadA1和aph(3′)-1耐药基因序列进行比对,结果分析表明rmtB、aadA1和aph(3′)-1耐药基因与GenBank中已发表的基因序列同源性均高于96.7%。
表2 水禽源大肠埃希菌对氨基糖苷类药物的敏感性
Table 2 The sensitivity of aminoglycosides antibiotics toE.coliisolates from waterfowl

抗菌药物Antibacterials鸭源菌株(76)StrainsofducksS/%I/%R/%鹅源菌株(175)StrainsofgeeseS/%I/%R/%MIC50/(μg·mL-1)MIC90/(μg·mL-1)庆大霉素Gentamicin71.053.9525.0059.431.7138.862>256阿米卡星Amikacin98.6801.3267.432.2930.282256卡那霉素Kanamycin60.531.3138.1642.282.8654.8632256链霉素Streptomycin18.42-81.5824.57-75.43256>256壮观霉素Spectinomycin69.749.2121.05205.7174.2932>256
注:“-”表示CLSI没有相应判断标准。“R”、“I”和“S”分别表示耐药率、中介率和敏感率。
Note:“-” means CLSI hasn′t corresponding criteria; “R” means resistance; “I” means intermediate; “S” means sensitive.
2.3 耐药基因PCR扩增结果
PCR检测结果表明,149株大肠埃希菌氨基糖苷类耐药株中,rmtB、aadA1和aph(3′)-1基因检出率分别为16.8%(25/149)、84.6%(126/149)和91.9%(137/149)。仅1.3%(2/149)的氨基糖苷类耐药株没有检测到rmtB、aadA1和aph(3′)-1耐药基因。统计分析显示,耐药基因rmtB的携带与4种药物(庆大霉素、阿米卡星、卡那霉素和壮观霉素)耐药株的产生极显著相关(P<0.01),而其他基因则表现与耐药株的产生独立不相关(P>0.05)(表3)。部分菌株rmtB、aadA1和aph(3′)-1基因电泳结果见图1~图3。
表3 氨基糖苷类药物耐药表型与基因型相关性分析
Table 3 Analysis of antibiotic resistance genes and phenotypes of antimicrobial resistance
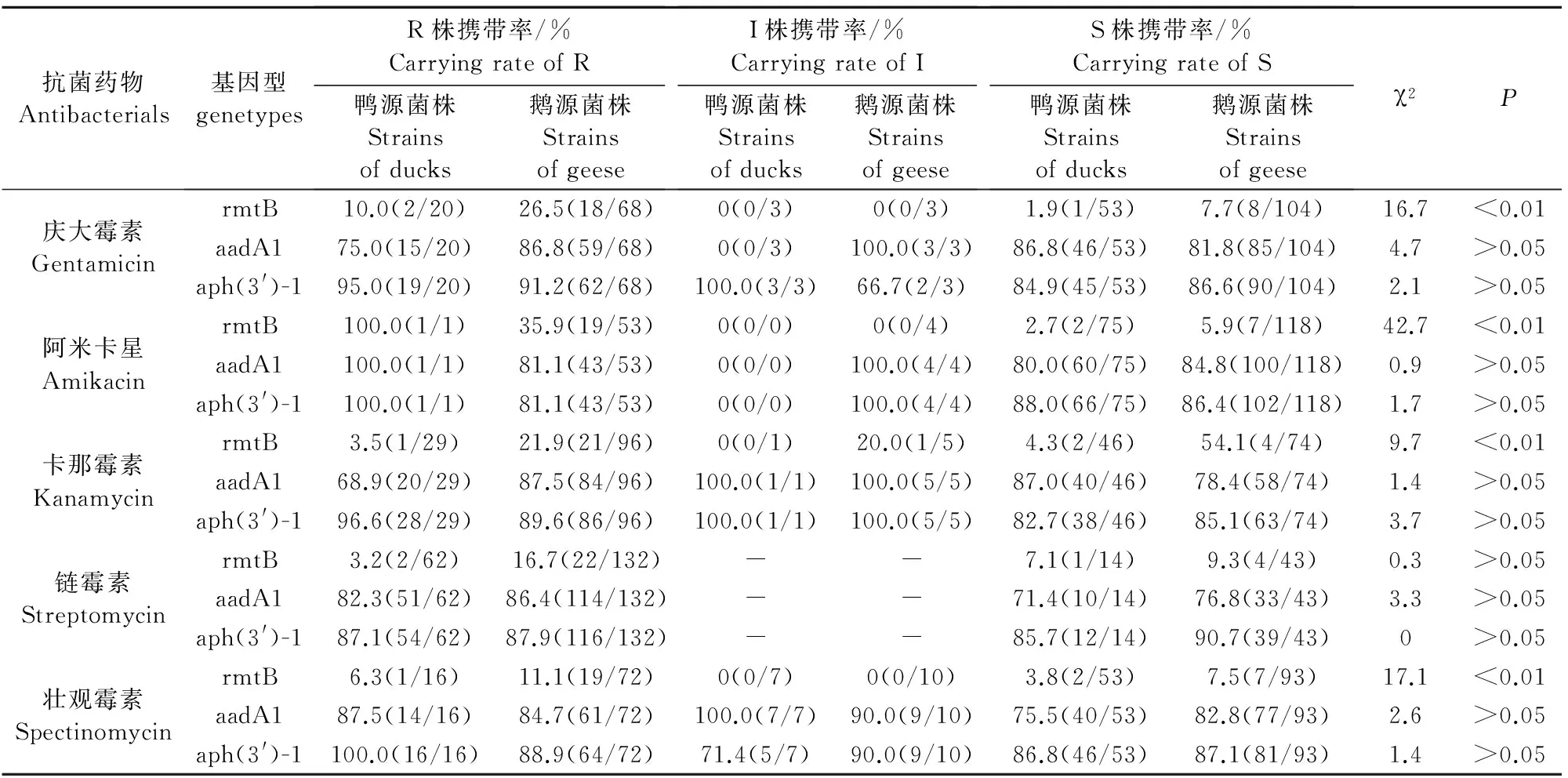
抗菌药物Antibacterials基因型genetypesR株携带率/%CarryingrateofR鸭源菌株Strainsofducks鹅源菌株StrainsofgeeseI株携带率/%CarryingrateofI鸭源菌株Strainsofducks鹅源菌株StrainsofgeeseS株携带率/%CarryingrateofS鸭源菌株Strainsofducks鹅源菌株Strainsofgeeseχ2P庆大霉素GentamicinrmtB10.0(2/20)26.5(18/68)0(0/3)0(0/3)1.9(1/53)7.7(8/104)16.7<0.01aadA175.0(15/20)86.8(59/68)0(0/3)100.0(3/3)86.8(46/53)81.8(85/104)4.7>0.05aph(3')-195.0(19/20)91.2(62/68)100.0(3/3)66.7(2/3)84.9(45/53)86.6(90/104)2.1>0.05阿米卡星AmikacinrmtB100.0(1/1)35.9(19/53)0(0/0)0(0/4)2.7(2/75)5.9(7/118)42.7<0.01aadA1100.0(1/1)81.1(43/53)0(0/0)100.0(4/4)80.0(60/75)84.8(100/118)0.9>0.05aph(3')-1100.0(1/1)81.1(43/53)0(0/0)100.0(4/4)88.0(66/75)86.4(102/118)1.7>0.05卡那霉素KanamycinrmtB3.5(1/29)21.9(21/96)0(0/1)20.0(1/5)4.3(2/46)54.1(4/74)9.7<0.01aadA168.9(20/29)87.5(84/96)100.0(1/1)100.0(5/5)87.0(40/46)78.4(58/74)1.4>0.05aph(3')-196.6(28/29)89.6(86/96)100.0(1/1)100.0(5/5)82.7(38/46)85.1(63/74)3.7>0.05链霉素StreptomycinrmtB3.2(2/62)16.7(22/132)--7.1(1/14)9.3(4/43)0.3>0.05aadA182.3(51/62)86.4(114/132)--71.4(10/14)76.8(33/43)3.3>0.05aph(3')-187.1(54/62)87.9(116/132)--85.7(12/14)90.7(39/43)0>0.05壮观霉素SpectinomycinrmtB6.3(1/16)11.1(19/72)0(0/7)0(0/10)3.8(2/53)7.5(7/93)17.1<0.01aadA187.5(14/16)84.7(61/72)100.0(7/7)90.0(9/10)75.5(40/53)82.8(77/93)2.6>0.05aph(3')-1100.0(16/16)88.9(64/72)71.4(5/7)90.0(9/10)86.8(46/53)87.1(81/93)1.4>0.05
注:“-”表示CLSI没有相应判断标准;“R”、“I”和“S”分别表示耐药、中介和敏感。
Note:“-” means CLSI hasn′t corresponding criteria; “R” means resistance; “I” means intermediate; “S” means sensitive.

M.DNA 标准DL2 000;1~7.待检菌株;8.阳性对照;9.阴性对照
M.DNA Marker DL2 000; 1-7.E.colifrom waterfowl to be detected; 8.Positive control; 9.Negative control
图1 rmtB基因PCR扩增结果
Fig.1 PCR amplification results of rmtB genes

M.DNA标准DL 2 000;1~13.待检菌株;14.阳性对照;15.阴性对照
M.DNA Marker DL2 000; 1-13.E.colifrom waterfowl to be detected; 14.Positive control; 15.Negative control
图2 aadA1基因PCR扩增结果
Fig.2 PCR amplification results of aadA1 genes

M.DNA标准DL 2 000;1~15.待检菌株;16.阳性对照;17.阴性对照M.DNA Marker DL 2 000; 1-15.E.coli from waterfowl to be detected; 16.Positive control; 17.Negative control
3 讨论
氨基糖苷类药物是一组种类繁多,而且在临床应用上使用较多的抗菌化合物,对由革兰阴性菌和阳性菌以及原生动物引起的传染病都起到较好的作用,然而细菌对氨基糖苷类药物的耐药性问题引人担忧。本研究对251株水禽源大肠埃希菌耐药性做了调查,结果显示,分离株对链霉素耐药最为严重,鸭源和鹅源的耐药率分别为81.58%和75.43%,MIC50以及MIC90均高于256 μg/mL,对阿米卡星最为敏感,其中鸭源的耐药率仅为1.32%,MIC50为2 μg/mL~32 μg/mL。与陈志华[6]、宦海霞[7]和于学辉[8-9]对水禽源大肠埃希菌耐药性的研究结果(庆大霉素耐药率为12.08%~28%、阿米卡星耐药率为0~3.1%、卡那霉素耐药率为16.91%~37%、链霉素耐药率为15.45%~72%和壮观霉素耐药率为5%~12.77%)相比,5种氨基糖苷类药物的耐药率都有所升高,其中对阿米卡星和壮观霉素耐药率增长最快。水禽源大肠埃希菌对敏感度较高的抗菌药物正在逐渐产生耐药性,引起这一现象的可能与抗生素耐药性的生物适应性代价有关。抗生素耐药性的生物适应性代价是影响耐药菌株的出现和传播的重要因素,由于耐药适应性代价,在抗生素选择性压力小时,耐药菌增长速率低于敏感株。然而在长期的抗生素压力下,耐药菌通过获得额外的补偿性适应突变而改善耐药代价,耐药菌增长速率因此高于敏感株,耐药菌得到大量繁殖成为优势菌,从而细菌对抗菌药物的耐药率升高[10-12]。
统计分析本研究中水禽源大肠埃希菌耐药基因型与耐药表型相关性,结果表明,耐药基因rmtB的携带与4种药物(庆大霉素、阿米卡星、卡那霉素和壮观霉素)耐药株的产生具有显著相关性(P<0.01)。虽然耐药基因aadA1和aph(3′)-1在统计
学上表现与耐药菌株的产生独立不相关,但是它们在耐药菌株中的检出率较高,为84.6%~91.9%,表明aadA1和aph(3′)-1是广东地区流行的基因型。本研究中耐药基因aadA1和aph(3′)-1的携带率如此高,但生物统计学上却没有显示其与耐药表型相关,即大肠埃希菌敏感株和耐药株耐药基因携带率都较高,两者之间差异不显著,这可能与敏感株中耐药基因的沉默有关。在细菌中,完整的耐药基因表达系统可以关闭,即耐药基因沉默。Enne V I等[13-14]研究显示,在大肠埃希菌敏感株中检测到的耐药基因blaOXA-2、aadA1、sulI和tetA及其启动子大多数是完好无损的,但是它们不表达,从而无法表现耐药表型。然而,这个过程是可逆的,将其他质粒以正常的频率通过接合进入携带耐药基因的菌株中,耐药基因则可以在新的质粒上表达。研究证明[15-17],耐药基因沉默是特定的出现于宿主最初携带的质粒上,如果耐药基因及其启动子完整,则其他质粒从携带耐药基因的菌株通过接合转移到另一个菌株中时,耐药基因的表达可以恢复。耐药基因沉默不是由于基因或启动子的突变,也不是由于质粒整合到染色体上,可能由于大肠埃希菌的一个染色体改变,使启动子活性被抑制。耐药基因沉默现象提示我们,在抗生素过度压力下,质粒更加频繁的转移,从可能导致沉默耐药基因恢复表达,从而引起更严重的细菌耐药性。
本试验通过检测广东地区水禽源大肠埃希菌对氨基糖苷类药物的耐药性和耐药基因,反映了该地区大肠埃希菌对氨基糖苷类药物耐药严重,充实了大肠埃希菌的耐药性研究数据库,可为该地区临床用药提供了科学的理论依据,为研究该地区的大肠埃希菌的耐药基因提供相关的数据。
[1] Shakil S,Khan R,Zarrilli R,et al.Aminoglycosides versus bacteria--a description of the action,resistance mechanism,and nosocomial battleground[J].J Biomed Sci,2008,15(1):5-14.
[2] Baggesen D L,Sandvang D,Aarestrup F M.Characterization ofSalmonellaentericaserovartyphimuriumDT104 isolated from Denmark and comparison with isolates from Europe and the United States[J].J Clin Microbiol,2000,38(4):1581-1586.
[3] Galimand M,Courvalin P,Lambert T.Plasmid-mediated high-level resistance to aminoglycosides in Enterobacteriaceae due to 16S rRNA methylation[J].Antimicrob Agent Chemother,2003,47(8):2565-2571.
[4] Wright G D.Aminoglycoside modifying enzymes [J].Curr Opin Microbiol,1999,2 (5):499.
[5] CLSI.Performance standards for antimicrobial susceptibility testing; nineteenth informational supplement.CLSI document M100-S19[S].Wayne,PA:Clinical and Laboratory Standards Institute,2009,29(3):1-135.
[6] 陈志华,刘富来,缪小群,等.鸭大肠杆菌的药物敏感性试验[J].中国兽药杂志,2004,38(12):23-25.
[7] 宦海霞,苗晓青,周 琼,等.江苏省部分地区鹅源致病性大肠杆菌的分离、鉴定和耐药性分析[J].饲料工业,2007,28(15):62-64.
[8] 于学辉,张焕容,汤 承,等.我国西南地区鸭病原性大肠杆菌耐药性检测[J].养禽与禽病防治,2008(4):4-8.
[9] 于学辉,黄 兰,杨晓农,等.98株鸭源致病性大肠杆菌氨基糖苷类耐药基因型与耐药表型的比较[J].畜牧兽医学报,2010,41(12):1568-1575.
[10] Andersson D I,Hughes D.Antibiotic resistance and its cost:Is it possible to reverse resistance[J].Nat Rev Microbiol,2010,8(4):260-271. doi: 10.1038/nrmicro2319.
[11] Bjorkman J,Nagaev I,Berg O G,et al. Effects of environment on compensatory mutations to ameliorate costs of antibiotic resistance[J]. Science,2000,287(5457):1479-1482.
[12] Dahlberg C,Chao L.Amelioration of the cost of conjugative plasmid carriage inEscherichiacoliK12[J].Genetics,2003,165(4):1641-1649.
[13] Enne V I,Delsol A A,Roe J M,et al.Evidence of antibiotic resistance gene silencing inEscherichiacoli[J].Antimicrob Agent Chemother,2006,50(9):3003-3010.
[14] Enne V I,Cassar C,Sprigings K,et al. A high prevalence of antimicrobial resistantEscherichiacoliisolated from pigs and a low prevalence of antimicrobial resistantE.colifrom cattle and sheep in Great Britain at slaughter[J]. FEMS Microbiol Lett,2008,278(2):193-199.
[15] 李鲁明,袁晓燕,王明义,等.整合子-基因盒系统与细菌耐药机制的研究进展[J].中国微生态学杂志,2014,26(2):246-248.
[16] 张宏梅,石 磊,李 琳,等.细菌耐药基因盒的捕获和表达机理的研究进展[J].中国抗生素杂志,2003,11(28):703-706.
[17] 谭文彬.细菌耐药的基因机理研究进展[J].中国病原生物学杂志,2009,4(7):543-544,555.
Investigation on Aminoglycosides Antibiotics Resistance and Resistance Genes ofEscherichiacoliIsolated from Waterfowl in Guangdong Province
ZHANG Ji-pei1,WEI Qing-lan1,2,TAN Hua-long1,CHEN Gang1,CHEN Jian-hong1
(1.CollegeofLifeSciences,FoshanUniversity,Foshan,Guangdong,528231,China; 2.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China)
In order to understand the resistance to aminoglycosides antibiotics and the prevalence of aminoglycosides resistance genes from waterfowl in Guangdong province,explore the relationship between antibiotic resistance genes and phenotypes of antimicrobial resistance,antimicrobial susceptibilities of total 251E.coliisolates to aminoglycosides antimicrobial agents were determined by agar dilution methods and the aminoglycosides resistance genes were detected by PCR.The results of drug sensitivity tests showed that the resistant incidence rates of ducks and geese were exhibited to streptomycin (81.58% and 75.43%),gentamicin (25% and 38.86%),spectinomycin (21.05% and 74.29%),kanamycin (38.16% and 54.86%) and amikacin (1.32% and 30.28%).The occurrences ofaadA1 andaph(3′)-1 genes were ranked the higher (84.6%-91.9%).It indicated that the antimicrobial resistance genetypes ofaadA1 andaph(3′)-1 were detected frequently among commensalE.colifrom waterfowl in Guangdong province.Analysis of resistance genetypes and drug resistance phenotype correlations showed thatrmtBgene had significant correlation on the resistance ofE.colito gentamicin,amikacin,kanamycin and spectinomycin,which indicatedrmtBgene played an important role in the resistant strains ofE.coli.This research played a significant role in prevention of colibacillosis, and provided relevant data for the resistance genes ofE.coli.
Escherichiacolifrom waterfowl; aminoglycoside antibiotics; resistance gene; resistance genetype
2015-09-20
张济培(1970-),男,广东陆河人,硕士,高级实验师,主要从事预防兽医学研究。*通讯作者
S852.61
A
1007-5038(2016)05-0042-05

