3个道地产区丹参混合提取物对大鼠脑缺血再灌注后神经细胞凋亡的影响※
李红刚 王红鸽 聂晓枫 孙 陈卫银
(陕西省渭南职业技术学院医学院临床教研室,陕西 渭南 714000)
实 验 研 究
3个道地产区丹参混合提取物对大鼠脑缺血再灌注后神经细胞凋亡的影响※
(陕西省渭南职业技术学院医学院临床教研室,陕西 渭南 714000)
目的 通过观察山东、河南、四川3个道地产区丹参混合提取物对大鼠局灶性脑缺血再灌注后脑组织B细胞淋巴瘤-2基因(Bc1-2)、肿瘤抑制基因p53的影响,探讨3个道地产区丹参对神经细胞凋亡的影响。方法 将60只SD大鼠随机分为正常组、假手术组、模型组、山东丹参组、河南丹参组、四川丹参组,每组10只。用线栓法阻断大脑中动脉,建立大鼠局灶性脑缺血再灌注损伤模型,用苏木精-伊红(HE)染色法观察缺血脑组织的病理学变化,采用免疫组化法检测再灌注24 h后各组Bc1-2和p53蛋白的表达。结果 正常组和假手术组细胞与间质之间界限清楚,细胞核完整,核仁清晰;模型组细胞与间质之间界限不清楚,大部分组织细胞坏死,多数细胞溶解呈空泡状,可见核固缩和核碎裂;3个道地产区丹参组脑组织细胞坏死程度均较模型组轻,可见少量细胞核固缩及溶解,部分胞质液化。正常组、假手术组Bcl-2的积分光密度值(IOD)较少,二者比较差异无统计学意义(P>0.05);模型组Bcl-2的IOD值较正常组、假手术组增加(P<0.05);与模型组比较,3个道地产区丹参组均能上调Bcl-2的IOD值(P<0.05);与河南、四川丹参组比较,山东丹参组上调Bcl-2的IOD值的幅度最大(P<0.05)。正常组、假手术组p53的IOD值较少,二者比较差异无统计学意义(P>0.05);模型组p53的IOD值较正常组、假手术组增加(P<0.05);与模型组比较,3个道地产区丹参组均能降低p53的IOD值(P<0.01);与河南丹参组比较,山东、四川丹参组降低p53的IOD值的幅度最大(P<0.05)。结论 3个道地产区丹参混合提取物均能通过上调Bcl-2表达、降低p53表达,从而抑制神经细胞凋亡,发挥脑保护作用。不同产区丹参混合提取物对各指标表达影响不同,其原因可能与不同产区丹参混合提取物所含活性成分的含量不同,作用靶点不一致有关。
疾病模型,动物;脑缺血;神经元,细胞学;细胞凋亡;再灌注损伤;丹参
丹参是常用活血化瘀药之一,其对大鼠局灶性脑缺血再灌注损伤模型的影响报道较多,其单体成分通过不同途径对脑缺血再灌注损伤起到保护作用,但未见不同产地丹参对大鼠局灶性脑缺血再灌注损伤模型影响的报道。本实验研究选取山东、河南、四川3个道地产区丹参混合提取物,旨在观察不同产区丹参对大鼠局灶性脑缺血再灌注后脑组织B细胞淋巴瘤-2基因(Bc1-2)、肿瘤抑制基因p53的影响,从而探讨其对神经细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 动物 健康Sprague-Dawley(SD)大鼠60只,购于四川大学实验动物中心,合格证号:scxk(川)-10-2006,雌雄各半,鼠龄7~8周,清洁级,体质量平均(275.35±24.28) g。在成都中医药大学时间生物学实验室(TCM-03-150)喂养。手术前后常规饲养,室温保持23~25 ℃,自由进水、进食。
1.1.2 药品与试剂 采取四川省德阳市中江县古店乡、山东省临沂市沂南县、河南省南阳市方城县栽培丹参根10 kg,样品采集后快速运回实验室,经常规加工处理后,干燥成药材,由成都中医药大学药学院提取制成0.4 g/mL生药的供试品溶液。兔抗大鼠Bcl-2单克隆抗体、兔抗大鼠p53单克隆抗体 (均购自北京博奥森生物技术有限公司);生物素化羊抗兔IgG抗体(购自北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 造模及分组 大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)造模方法采用在 Zea longa[1]基础上改良的造模方法颈内动脉线栓加环扎法。将60只SD大鼠随机分为正常组(n=10)、假手术组(n=10)、模型组(n=10)、四川丹参组(n=10)、山东丹参组(n=10)及河南丹参组(n=10)。
1.2.2 治疗方法 正常组:不予任何干预手段;假手术组:暴露右侧颈总动脉分叉,然后缝合皮肤,术前5 d予0.9%氯化钠注射液灌胃,每日1次,术后2 h予0.9%氯化钠注射液再灌胃1次;模型组:MCAO造模90 min后再灌注,造模前5 d予0.9%氯化钠注射液灌胃,每日1次,再灌注后2 h予0.9%氯化钠注射液再灌胃1次;四川丹参组、山东丹参组、河南丹参组:MCAO造模90 min后再灌注,造模前5 d分别予四川、山东、河南丹参混合提取物灌胃,每日1次,再灌注后2 h再灌胃1次。再灌注24 h后处死大鼠。根据人和动物用量体表面积换算法[2]计算,实验中丹参混合提取物的灌胃剂量为6.75 mL/kg。
1.2.3 大鼠死亡情况 正常组、假手术组无死亡,模型组死亡2只,四川丹参组死亡3只,山东丹参组和河南丹参组各死亡4只,故按照山东丹参组和河南丹参组大鼠存活数,在其他各组存活大鼠中每组随机选取6只进行统计分析。
1.2.4 苏木精-伊红(HE)染色法及免疫组化检测方法 病理组织切片标本收集及处理:①各组大鼠再灌注后24 h灌注取脑并固定,固定72 h后做成石蜡切片,每个标本各取1张用于HE染色。②应用链霉菌抗生物素蛋白-过氧化物酶连结法(SP)进行,一抗为兔抗大鼠Bcl-2、p53单克隆抗体,二抗为生物素化羊抗兔IgG抗体,封片后再采用光镜观察。③免疫组化染色结果拍照后进行半定量分析,并计算阳性细胞的积分光密度值(IOD)。
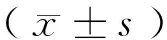
2 结 果
2.1 各组大鼠光镜下组织病理学改变 见图1。
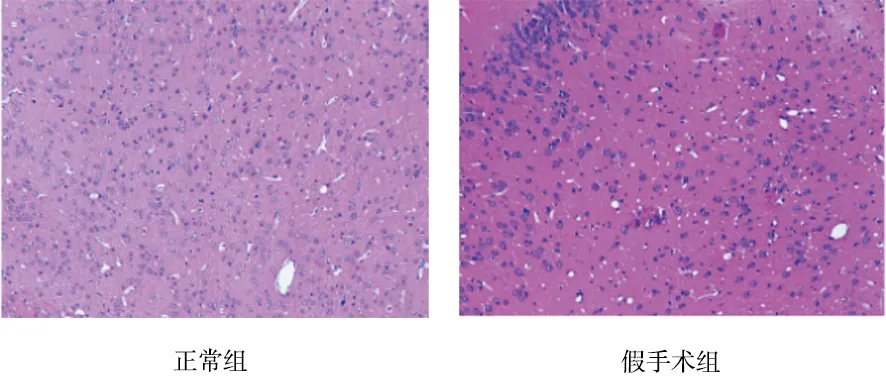


图1 各组大鼠光镜下组织病理学改变(HE,×100)
由图1可见,正常组和假手术组细胞与间质之间界限清楚,细胞核完整,核仁清晰;模型组细胞与间质之间界限不清楚,大部分组织细胞坏死,多数细胞溶解呈空泡状,可见核固缩和核碎裂;3个道地产区丹参组脑组织细胞坏死程度均较模型组轻,可见少量细胞核固缩及溶解,部分胞质液化。
2.2 各组大鼠Bcl-2的IOD值比较 见表1。
表1 各组大鼠Bcl-2的IOD值比较

组 别nBcl-2(×106)正常组60.49±0.11假手术组60.50±0.06模型组61.43±0.33*山东丹参组63.44±1.39△河南丹参组62.42±0.88△#四川丹参组62.36±0.90△#
与正常组、假手术组比较,*P<0.05;与模型组比较,△P<0.05;与山东丹参组比较,#P<0.05
由表1可见,正常组、假手术组Bcl-2 IOD值较少,二者比较差异无统计学意义(P>0.05);模型组Bcl-2的IOD值较正常组、假手术组增加(P<0.05);与模型组比较,3个道地产区丹参组均能上调Bcl-2的IOD值(P<0.05);与河南、四川丹参组比较,山东丹参组上调Bcl-2的IOD值的幅度最大(P<0.05);河南丹参组与四川丹参组比较差异无统计学意义(P>0.05)。各组对Bcl-2表达的影响见图2。
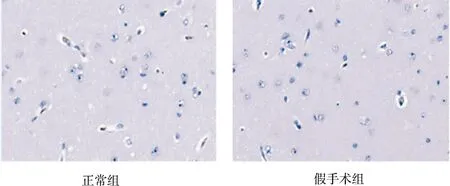
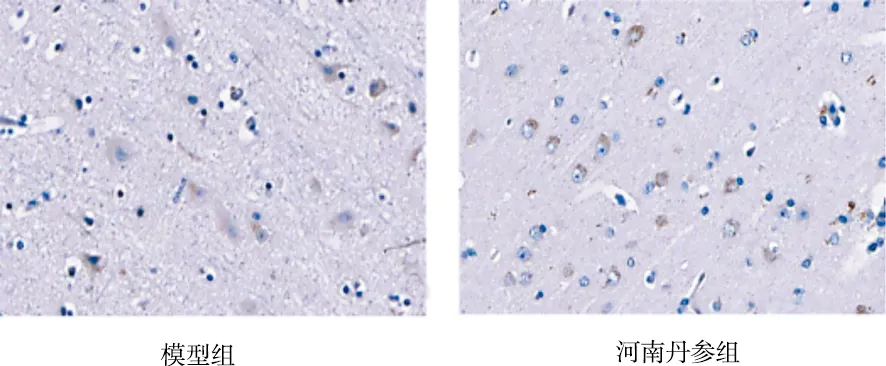
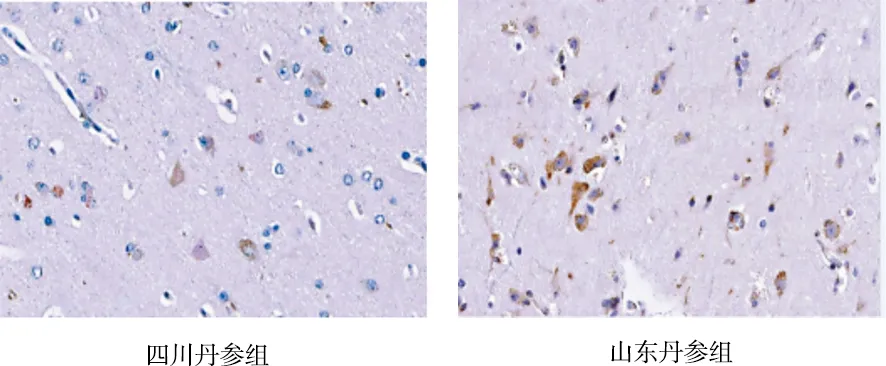
图2 各组对Bcl-2表达的影响(免疫组化染色,×400)
2.3 各组大鼠p53的IOD值比较 见表2。
由表2可见,正常组、假手术组p53的IOD值较少,二者比较差异无统计学意义(P>0.05);模型组p53的IOD值较正常组、假手术组增加(P<0.05);与模型组比较,3个道地产区丹参组均能降低p53的IOD值(P<0.01);与河南丹参组比较,山东、四川丹参组降低p53的IOD值的幅度最大(P<0.05);山东丹参组与四川丹参组比较差异无统计学意义(P>0.05)。各组对p53表达的影响见图3。
表2 各组大鼠p53的IOD值比较
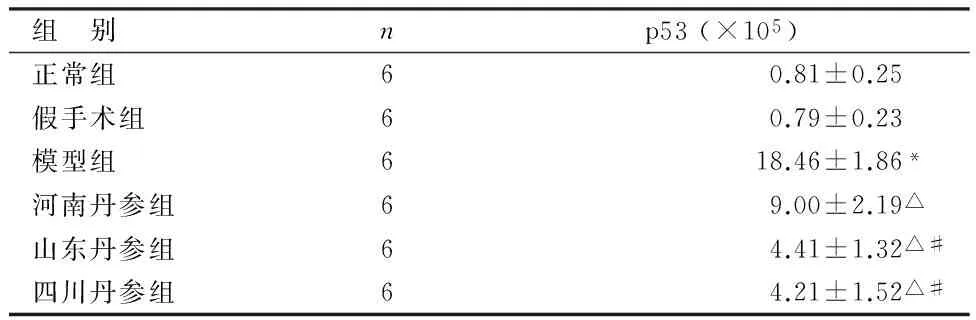
组 别np53(×105)正常组60.81±0.25假手术组60.79±0.23模型组618.46±1.86*河南丹参组69.00±2.19△山东丹参组64.41±1.32△#四川丹参组64.21±1.52△#
与正常组、假手术组比较,*P<0.05;与模型组比较,△P<0.01;与河南丹参组比较,#P<0.05
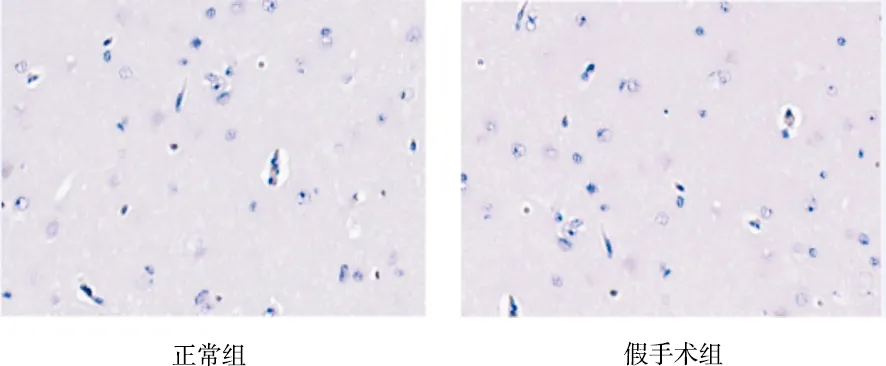
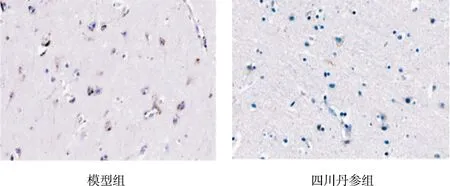
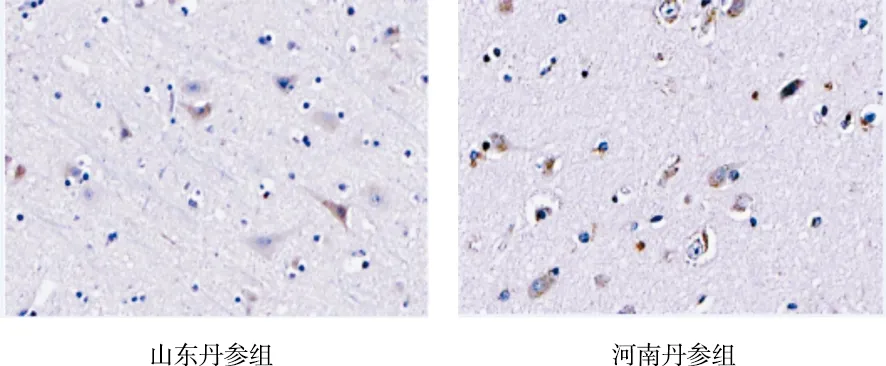
图3 各组对p53表达的影响(免疫组化染色,×400)
3 讨 论
脑缺血再灌注是指脑缺血一段时间后,再恢复其血液供应的过程。多数研究表明,脑缺血再灌注后脑缺血性的损伤反而会加重,其机制非常复杂,包括兴奋性氨基酸的神经毒性作用、白细胞渗透、血小板和补体激活、细胞内钙离子超载、炎性细胞因子损伤、过度灌注、凋亡调控基因的激活等因素[3]。脑缺血再灌注后细胞坏死和细胞凋亡并存,细胞坏死主要位于缺血中心区,是不可逆的;而细胞凋亡主要出现在缺血灶周围区即缺血半暗带,是可逆的。因此,脑缺血再灌注后神经细胞凋亡已成为研究热点。
现已知与神经细胞凋亡相关的基因可分为两大类[4]:一类是抑制凋亡的基因,如Bc1-2等;另一类是促进细胞凋亡的基因,如p53、bax等。本实验研究选取Bc1-2和p53作为观察指标,探讨3个道地产区丹参混合提取物对大鼠局灶性脑缺血再灌注后神经细胞凋亡的影响。
关于丹参药材的道地产区,郭宝林等[5]考证,《名医别录》述“生桐柏山谷及太山”(今河南和湖北交界及山东泰山一带),《图经本草》述“今陕西河东州郡及随州皆有之”(今山西、湖北,河东州郡应归为山西而非陕西),《本草品汇精要》述“道地随州”(今湖北随州),《药物出产辨》述“产四川龙安府为佳”(今四川平武),可见在历史上湖北、河南、山东、山西、四川等几个省都曾被视为丹参的道地产区。近代以来, 四川产丹参被视为佳品,《中国道地药材》[6]将丹参列为四川产道地药材。总结起来,文献记载的丹参道地产区主要有四川、河南、山东、山西及湖北5个产地。多数研究表明,不同产地丹参中丹参酮ⅡA、丹酚酸和丹参素等活性成分的含量差别较大。本实验研究所选用四川省德阳市中江县古店乡、山东省临沂市沂南县、河南省南阳市方城县3个道地产区丹参,经测定丹参酮ⅡA、丹酚酸和丹参素等活性成分的含量差别较大,与多数文献报道结果相似[7-8]。
Bcl-2、p53是目前研究较多的一对凋亡调控基因。Bcl-2基因首先在血液淋巴细胞中发现,近年来研究发现Bcl-2是细胞凋亡的重要抑制基因,它在脑缺血中表达并起重要作用[9]。p53是1979年Lane DP等[10]在DNA病毒SV40感染的哺乳动物细胞中发现的,因其相对分子质约53×103(53KD),故简称p53。Villunger A等[11]认为,p53是引起缺血再灌注后神经元凋亡的关键因素。总之,脑缺血再灌注后脑内p53表达明显增加,活性提高。可见,Bcl-2和p53基因对脑细胞凋亡起重要作用,二者表达水平的高低与凋亡的严重性直接相关,Bcl-2升高,抑制细胞凋亡;p53升高,促进细胞凋亡[12-13]。
观察结果表明,山东、河南、四川3个道地产区丹参混合提取物均能明显提高Bcl-2表达,降低p53表达,表明3个产区丹参混合提取物通过上调Bcl-2、下调p53表达而抑制神经细胞凋亡,从而改善缺血再灌注损伤而发挥脑保护作用。同时发现,3个道地产区丹参混合提取物对Bcl-2和p53表达的影响不同,对Bcl-2的表达,山东丹参组上调的幅度大于河南丹参组、四川丹参组(P<0.05);河南丹参组与四川丹参组比较差异无统计学意义(P>0.05)。对p53的表达,山东丹参组、四川丹参组降低p53的幅度大于河南丹参组(P<0.05);山东丹参组与四川丹参组比较差异无统计学意义(P>0.05)。综上,3个道地产区丹参混合提取物均能影响Bcl-2、p53表达,抑制神经细胞凋亡,从而发挥脑保护作用。不同产区丹参混合提取物对各指标表达影响不同,其原因可能与不同产区丹参混合提取物所含活性成分的含量不同,作用靶点不一致有关。
[1] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2] 苗明三.实验动物和动物实验技术[M].北京:中国中医药出版社,1997:143-144.
[3] Pan J,Konstas AA,Bateman B,et al.Reperfusion injury following cerebral ischemia: pathophysiology,MR imaging,and potential therapies[J].Neuroradiology,2007,49(2):93-102.
[4] Dragunow M,Preston K.The role of inducible transcription factors in apoptotic nerve cell death[J].Brain Res Brain Res Rev,1995,21(1):1-28.
[5] 郭宝林,林生,冯毓秀,等.丹参主要居群的遗传关系及药材道地性的初步研究[J].中草药,2002,33(12):1113-1116.
[6] 胡世林.中国道地药材[M].哈尔滨:黑龙江科学技术出版社,1989:120.
[7] 杨新杰,万德光,林贵兵,等.丹参脂溶性成分的地域分布特点分析[J].中草药,2010,41(5):809-812.
[8] 杨新杰,万德光,刘敏,等.丹参水溶性成分的地域分布特点分析[J].天然产物研究与开发,2011,23(4):684-688.
[9] 李裕茂.Bcl-2与脑缺血的研究进展[J].医学文选,2004,23(2):213-215.
[10] Lane DP,Crawford LV.T antigen is bound to a host protein in SV40-transformed cells[J].Nature,1979,278(5701):261-263.
[11] Villunger A,Michalak EM,Coultas L,et al.p53- and drug-induced apoptotic responses mediated by BH3-only proteins puma and noxa [J].Science,2003,302(5647):1036-1038.
[12] 陈乾,冯飞,陈文明,等.红花注射液对脑缺血再灌注损伤大鼠大脑皮质Bax及Bcl-XL/Bcl-2的影响[J].神经药理学报,2015,5(1):15-18.
[13] 郑春素,陈锦芳.辛开苦降法对脾胃湿热证大鼠胃黏膜上皮细胞p53、Bcl-2蛋白的影响[J].云南中医学院学报,2015,38(5):18-21.
(本文编辑:习 沙)
Effecs of Danshen mixed extract from 3 genuine producing areas on nerve cells apoptosis in cerebral ischemia and reperfusion rats
LIHonggang,WANGHongge,NIEXiaofeng,etal.
ClinicalTeachingandResearchSection,MedicalSchoolofWeinanVocationalTechnicalInstituteinShanxiProvince,Shanxi,Weinan714000
Objective To observe the effecs of Danshen mixed extract from 3 genuine producing areas (Shandong, Henan, Sichuan) on B-cell lymphoma-2 gene (Bcl-2) and tumor suppressor gene p53 in cerebral ischemia and reperfusion rats, to investigate the effects Danshen of three difference area on nerve cells apoptosis. Methods 60 SD rats were randomly divided into normal group, shame operation group, model group,Shandong Danshen group, Henan Danshen group and Sichuan danshen group, 10 rats in each group. The rats model of focal cerebral ischemia-reperfusion were established with the middle cerebral artery occlusion .The pathologic change of cerebral ischemia tissue was observed by HE staining. The expressions of Bc1-2 and p53 after 24 reperfusion were observed by mean of immunohistochemistry. Results Cells in normal and shame operation group had clear margin with mesenchyme, integral nucleus and clear nucleolus. Cells in model group had unclear margin with mesenchyme, many cytolysis showed vacuole-shape, and the karyopyknosis and nuclear fragmentation were observed. The necrotic degree of brain tissue cells in three genuine producing areas were lighter than model group, there were few karyopyknosis and karyolysis, partial plasmatosis. The integrated optical density (IOD) of Bcl-2 in normal and shame operation group was fewer, with no statistical difference between two groups (P>0.05). The IOD of Bcl-2 in model group was increased as compared with the normal and shame operation group (P<0.05). As compared with model group, the IOD of Bcl-2 in three genuine producing areas were up-regulation (P<0.05). As compared with Henan and Sichuan danshen group, the IOD of Bcl-2 in Shandong Danshen group had maximum enhanced amplitude (P<0.05). The IOD of p53 in normal and shame operation group was fewer, with no statistical difference between two groups (P>0.05). The IOD of p53 in model group was increased as compared with the normal and shame operation group (P<0.05). As compared with model group, the IOD of p53 in three genuine producing areas were down-regulation (P<0.01). As compared with Henan danshen group,the IOD of p53 in Shandong and Sichuan Danshen group had maximum reduction amplitude (P<0.05). Conclusion Danshen mixed extract from 3 genuine producing areas can up-regulate Bcl-2 and down-regulate the p53, thus inhibit the neuronal apoptosis, play a role in cerebral protection. Danshen from difference ares with difference effects on various indexes, which may be related with difference content of active ingredients and action targets inconformity.
Disease model; Animals; Cerebral ischemia; Nerve cell; Cytology; Apoptosis; Reperfusion injury; Danshen
10.3969/j.issn.1002-2619.2016.10.018
※ 项目来源:渭南职业技术学院院级科研项目(编号:WZYY201322)
李红刚(1979—),男,主治医师,讲师,硕士。从事内科学临床、教学及科研工作。
R-332;R322.8;R329.25;R341;R743.31
A
1002-2619(2016)10-1515-05
2016-07-28)
△ 通讯作者:成都中医药大学附属医院神经内科,四川 成都 610072

