复方斑蝥胶囊对中晚期结直肠癌患者转化生长因子-β1和肿瘤微血管密度影响的前瞻性临床研究
刘冰心 孙长岗 李有杰 唐世峰 王 璐 朱 帅
(山东中医药大学2010级本硕连读生,山东 济南 250355)
复方斑蝥胶囊对中晚期结直肠癌患者转化生长因子-β1和肿瘤微血管密度影响的前瞻性临床研究
刘冰心 孙长岗△李有杰1唐世峰1王 璐1朱 帅1
(山东中医药大学2010级本硕连读生,山东 济南 250355)
目的 观察复方斑蝥胶囊对中晚期结直肠癌患者转化生长因子-β1(TGF-β1)、肿瘤微管密度(MVD)的影响。方法 将46例中晚期结直肠癌患者随机分为2组,每组各23例。对照组采用FOLFOX4化疗方案治疗,治疗组在对照组治疗基础上联合复方斑蝥胶囊治疗,分别检测化疗前及化疗1、2、3个周期后2组患者血清TGF-β1水平及MVD变化,并对2组患者近期临床疗效进行评价。结果 2组化疗后第1、2、3周期,血清TGF-β1水平及MVD均较本组化疗前降低,且治疗组低于对照组,差异均有统计学意义(P<0.05);近期综合临床疗效统计显示,治疗组客观反应率(ORR)和疾病控制率(DCR)均高于对照组,但差异无统计学意义(P>0.05)。结论 复方斑蝥胶囊能下调结直肠癌组织中的TGF-β1的表达、降低肿瘤组织MVD,抑制肿瘤生长、浸润,其作用机制可能与肿瘤血管的抑制和癌细胞的死亡有关。
结直肠肿瘤;中药疗法;斑蝥
大肠癌是临床上常见的消化道恶性肿瘤之一,近年来其发病率呈逐年上升趋势。目前大肠癌的病因病机仍不甚明确,但肿瘤的形成依赖于肿瘤的血管生成,并且新生血管与肿瘤生长的速度密切相关[1]。血管生成的病理生理过程受诱导剂和抑制剂的调控,转化生长因子-β1(TGF-β1)作为一种多功能的细胞生长因子,能促进肿瘤血管的生成,在肿瘤中呈现高表达[2-3]。肿瘤微血管密度(microvessel density,MVD)反映血管生成因子与抗血管生成因子的平衡结果,是目前公认的评价肿瘤血管生成的可靠指标[4],MVD的高低与肿瘤的生物学行为,如恶性程度、侵袭性、复发和转移及患者的预后密切相关[5]。现代医学治疗结直肠癌主要采用手术、放疗、化疗等方法,疗效不甚理想,而中医药具有多靶点、多环节、多效应的特点,可作用于肿瘤发生、发展的多个环节,在抑制、杀伤肿瘤细胞,改善患者症状、体征,以及减轻放、化疗不良反应,延长患者生存期等方面具有较好的疗效。复方斑蝥胶囊是将具有活血化瘀、抗肿瘤作用的斑蝥和具有扶正理气作用的人参、黄芪、刺五加等中药组方,采用现代中药制药工艺提取、分离、纯化并经结构修饰制成的双向多靶点抗肿瘤中药,在肿瘤的治疗方面具有广泛的药理活性。为进一步探讨其作用机制,本研究在化疗的基础上加复方斑蝥胶囊治疗中晚期结直肠癌23例,并与常规化疗治疗23例对照,观察对患者TGF-β1水平、MVD的影响,结果如下。
1 资料与方法
1.1 病例选择
1.1.1 纳入标准 明确病理诊断的Ⅱ、Ⅲ期结直肠癌患者[6];既往未行FOLFOX4化疗方案治疗;卡氏(KPS)评分>60分,预计生存期≥3个月;肝肾功能、生化指标等正常;无严重脏器损害及骨髓造血功能障碍;1个月内未参加其他药物临床试验;自愿参加本研究,并签署知情同意书;依从性好,可随访者[7-8]。
1.1.2 排除标准 患有严重的未控制的内科疾病或急性感染者;完全性肠梗阻;有周围感觉神经病变伴功能障碍;妊娠及哺乳期妇女;由于各种原因不能完成研究者[7-8]。
1.2 一般资料 全部46例均为2014-07—2015-12山东省潍坊市中医院肿瘤一科住院的Ⅱ、Ⅲ期结直肠癌患者,其中结肠癌28例,直肠癌18例,按就诊顺序采用简单随机化分为2组。治疗组23例,男15例,女8例;年龄46~70岁,平均(55.61±4.01)岁;结肠癌15例,直肠癌8例;分期:Ⅱ期6例,Ⅲ期17例;美国东部肿瘤协作组(ECOG)体力状况评分[6]0分9例,1分14例。对照组23例,男17例,女6例;年龄48~71岁,平均(57.21±3.97)岁;结肠癌13例,直肠癌10例;分期:Ⅱ期7例,Ⅲ期16例;ECOG体力状况评分0分10例,1分13例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.3 治疗方法
1.3.1 对照组 采用FOLFOX4 化疗方案。注射用奥沙利铂(南京制药厂有限公司,国药准字H20000686)85 mg/m2,加入5%葡萄糖注射液500 mL中,静脉滴注2 h,第1 d;注射用亚叶酸钙(安徽省先锋制药有限公司,国药准字H20093490)200 mg/m2,加入0.9%氯化钠注射液250 mL中,静脉滴注2 h,第1~2 d;氟尿嘧啶注射液(上海旭东海普药业有限公司,国药准字H31020593)400 mg/m2,加入0.9%氯化钠注射液500 mL中,静脉滴注,第1~2 d;氟尿嘧啶注射液600 mg/m2持续静脉滴注44 h,第1~2 d。
1.3.2 治疗组 化疗方案同对照组,同时在化疗开始当日加复方斑蝥胶囊(贵州益佰制药股份有限公司,国药准字Z19993409)3粒,每日2次饭后口,连续服用10 d。
1.3.3 疗程 2组均21 d为1个治疗周期,均常规预防呕吐、抗感染对症处理,并嘱患者在化疗期间不可进食或接触冷物,不要使用其他任何反应调节剂或免疫增强剂。
1.4 观察指标
1.4.1 TGF-β1测定 分别于治疗前及治疗后1、2、3个周期后采集2组患者静脉血5 mL,离心机3 000 r/min,离心10 min,取上清液,采用放射免疫分析法,测定血清中TGF-β1水平。
1.4.2 MVD 按照Weidner等评判标准[9],分别于1、2、3个化疗周期结束后取活检,采用免疫组化法,CD34标记微血管,计算肿瘤区内着色的微小血管和毛细血管,凡呈现棕色单个内皮细胞或内皮细胞群者作为1个MVD计数,计数方法:先在40倍100倍显微镜下找到肿瘤微血管密度最高的区域,即所谓“热点”,再在200倍显微镜下计数MVD,先后计数5个“热点”区域,取其平均值作为MVD。
1.5 疗效标准 根据实体瘤疗效评价标准,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stabldisease,SD)及疾病进展(disease progression,PD)。CR:所有目标病灶消失,至少维持4周;PR:目标病灶最长径之和与基线状态比较,至少减少30%,至少维持4周;SD:介于部分缓解和疾病进展之间;PD:目标病灶最长径之和与治疗开始之后所记录到的最小的目标病灶最长径之和比较,增加20%,或者出现1个或多个新病灶。客观反应率(ORR)= (CR例数+PR例数)/总例数×100%,疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100%[6]。
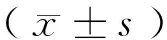
2 结 果
2.1 2组化疗前后TGF-β1水平比较 见表1。
表1 2组化疗前后TGF-β1水平比较
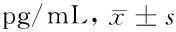

组 别n化疗前化疗1周期化疗2周期化疗3周期治疗组2330.56±4.0127.45±3.12*△16.53±3.31*△14.17±2.91*△对照组2331.06±3.9829.34±3.51*17.62±3.40*15.17±3.35*
与本组化疗前比较,*P<0.05;与对照组同期比较,△P<0.05
由表1可见,化疗前2组TGF-β1水平比较差异无统计学意义(P>0.05);化疗后1、2、3个周期,2组TGF-β1水平均逐渐降低,与本组化疗前比较差异均有统计学意义(P<0.05),且治疗组低于对照组同期(P<0.05)。
2.2 2组化疗前后MVD比较 见表2。
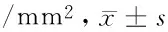
表2 2组化疗前后MVD比较 个
与本组化疗前比较,*P<0.05;与对照组同期比较,△P<0.05
由表2可见,化疗前2组MVD比较差异无统计学意义(P>0.05);化疗后1、2、3个周期,2组MVD均逐渐减少,与本组化疗前比较差异均有统计学意义(P<0.05),且治疗组少于对照组同期(P<0.05)。
2.3 2组近期综合临床疗效比较 见表3。
表3 2组近期综合临床疗效比较 例
由表3 可见,2组ORR及DCR比较差异均无统计学意义(P>0.05),疗效相当。
3 讨 论
3.1 TGF-β1、MVD与结直肠癌 TGF-β1是一种具有调控癌细胞生长、增殖、分化周期作用的多肽链,TGF-β1与相应受体结合后,间接通过介导smads的信号通路对细胞起调控作用,但是其作用机制还不明确[10]。也有研究报道指出,TGF-β1对癌细胞具有双重调控作用,在恶性肿瘤病变早期,TGF-β1抑制肿瘤细胞的生长、分裂、扩散等,当肿瘤细胞增殖到一定的数量时,就会对肿瘤细胞失去抑制作用,于是肿瘤细胞开始无限制的分裂、生长,同时TGF-β1刺激血管增生,为肿瘤细胞供血生长[11]。体内、外实验研究均表明,TGF-β1能够诱导血管生成,而在实体肿瘤中的研究相对较少。阻断TGF-β1产生、抑制其与配体结合或阻断通路中的下游小分子蛋白质可能有助于防治结直癌的转移。
肿瘤的生长和转移依赖于新生血管形成,肿瘤组织的MVD 是衡量血管生成的定量指标。肿瘤组织中TGF-β1呈过度表达状态,且与MVD值呈高度正相关,共同参与了肿瘤的发生、发展过程[12]。Saito等[13]研究胃癌组织中TGF-β1表达与肿瘤血管生成的关系发现,TGF-β1通过上调血管内皮生长因子(VEGF)的表达而刺激肿瘤血管形成,使肿瘤组织MVD增多。随着肿瘤MVD的增加,肿瘤侵袭转移等恶性潜能也明显增加。因此,TGF-β1水平、MVD与肿瘤细胞增殖、转移、侵袭力呈正相关[14],二者联合检测,对于结直肠癌的早期诊断、预后判断、治疗方案的选择都具有重要意义。肿瘤中对微血管的研究有望为恶性肿瘤的治疗提供新的思路,但TGF-β1及MVD在促血管生成协同方面的作用机制有待于进一步研究。
3.2 复方斑蝥胶囊的作用 近年来,在结直肠癌治疗的研究中,根据患者身体具体情况,采用综合治疗、取长补短的方法,将中医扶正祛邪的理念与西医手术、放化疗等进行有机结合,在改善患者生存质量、延长患者生存期方面均取得了较好的疗效,对其作用机制的研究及探讨也不断增多。结直肠癌属中医学“肠蕈”“癥瘕”“脏毒”等范畴。其主要病机为禀赋不足,或久病体虚,正气不足,抗邪能力下降,毒邪内蕴于肠道,结而为肿;或饮食不节,恣食肥腻辛辣刺激之品,损伤脾胃,运化失司,湿毒蕴结,郁而化热,下迫大肠,耗液伤津,气滞血瘀,蕴结日久,积而成块。兼之长期应用大热有毒之化疗药物,更损阴耗气,终致神离气脱,阴阳决离。其病机可归纳为正气不足,湿毒内蕴,阴津耗伤,肠络瘀阻。治宜清热解毒,益气养阴,扶正祛邪。复方斑蝥胶囊具有益气养阴、清热解毒、消瘀散结的功效,近年来被广泛应用于肝癌的治疗,对食管癌、乳腺癌也有较好的疗效。斑蝥味辛、性温,入大肠、小肠经,能够攻毒破结,主治癥瘕肿块;黄芪、人参为补益类中药,能够益气健脾,扶助正气,正气足而邪自退;半枝莲、刺五加、三棱、半枝莲、莪术破血散结,祛瘀解毒;熊胆粉、山茱萸、女贞子清热滋阴。方中诸药配伍,切合结直肠癌的发病机制。现代药理研究显示,复方斑蝥胶囊含有去甲斑蝥素、黄芪皂苷、人参皂苷、刺五加皂苷等多种药理活性成分,具有抗癌及免疫调节的双重作用,能增加淋巴因子激活的杀伤细胞(LAK细胞)、巨噬细胞、自然杀伤细胞(NK细胞)活性,从而提高机体免疫力,抑制及杀灭肿瘤细胞[15]。其中去甲斑蝥素能够诱导肿瘤细胞凋亡,对体外培养的人脐静脉内皮细胞(HUEVC)有显著的抑制作用[16],还可有效抑制、破坏胆囊癌肿瘤血管生成,进而抑制胆囊癌的增殖、生长,其机制可能与去甲斑蝥素诱导血管内皮细胞凋亡、直接破坏血管内皮细胞、改变血管内皮细胞增殖细胞核抗原/凋亡比、下调VEGF等有关[17]。人参皂苷Rg3能够抑制肿瘤新生血管的形成,并逆转肿瘤多药耐药,影响肿瘤细胞信号传导相关基因的表达,同时还能提高机体免疫功能[18-19]。刺五加皂苷能抑制肿瘤细胞DNA的合成,从而抑制肿瘤细胞分裂,诱导细胞凋亡;还能抑制VEGF 介导的肿瘤血管新生,进而抑制肿瘤的生长及转移[20]。半枝莲具有体外抑制人大肠癌HT-29细胞增殖的作用,并呈现明显的剂量依赖效应关系和时间依赖效应,同时使细胞周期分布发生明显变化,表现为S期细胞比例上升,G0/G1期和G2/M期细胞比例下降;半枝莲黄酮类化合物A06能抑制肿瘤细胞分泌VEGF、一氧化氮(NO)等血管生成促进因子[21]。
本研究结果显示,复方斑蝥胶囊与FOLFOX4联合应用对中晚期结直肠癌患者TGF-β1水平、MVD表现出显著的抑制作用,其抗肿瘤转移可能与抑制肿瘤血管生成因子的分泌从而减少肿瘤血管生成有关。总之,FOLFOX4方案能导致大量癌细胞坏死、肿瘤负荷减少,能降低中晚期结直肠癌患者TGF-β1表达量,TGF-β1水平下降可能是疾病得到控制的一个指标[22]。复方斑蝥胶囊联合化疗能加速肿瘤血管生成的抑制和癌细胞的死亡,具有一定的临床效果,值得今后进一步研究。
[1] 万德森.结直肠癌[M].北京:北京大学医学出版社,2008:33-35.
[2] 邓立春,沈伟生,张瑶,等.化疗对晚期结直肠癌患者血清VEGF水平的影响[J].实用临床医药杂志,2010,14(5):90-91,93.
[3] 吴久鸿,史宁,李冠群,等.肿瘤上皮间质转化中TGF-β作用机制及其活化酶抑制剂研究进展[J].中国药学杂志,2011,46(19):1461-1465.
[4] 王泓,曹铁生,乐桂容,等.增强超声诊断小乳腺癌及评价血管生成活性的价值[J].中国医学影像技术,2005,21(10):1519-1521.
[5] Herbst RS,Fidler IJ.Angiogenesis and lung cancer: potential for therapy[J].Clin Cancer Res,2000,6(12):4604-4606.
[6] 中华人民共和国卫生部医政司,中国常见恶性肿瘤诊治规范:第9分册[M].北京:北京医科大学、中国协和医科大学联合出版社,2002:10-11.
[7] 陈文海,田逸,师彦敏,等.中西医结合治疗晚期结肠癌疗效观察[J].现代中西医结合杂志,2014,23(11):1172-1174.
[8] Wang KS,Hu ZL,Li JH,et al.Enhancement of me-tastatic and invasive capacity of gastric cancer cells by transforming growth factor-beta1[J]. Acta Biochim Biophys Sin,2006,38(3):179-186.
[9] Weidner N.Current pathologic methods for measuring intratumoral mocrovessel density in breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
[10] Zhou R,Xiong B,Song H,et al.Soluble transforming growth factor beta type Ⅱ receptor attenuates TGF-beta1 activity in human colorectal cancer LoVo cells[J].Oncol Rep,2008,20(6):1449-1456.
[11] 张伟,胡可胜,孙续国.TGF-β1对单核细胞来源的树突状细胞表型和功能的影响[J].细胞与分子免疫学杂志,2009,25(12):1101-1102.
[12] 熊斌,龚玲玲,张峰,等.大肠癌组织转化生长因子β1表达与血管生成的关系[J].中国肿瘤临床,2002,29(6):392-394.
[13] Saito H,Tsujitani S,Oka S,et al.The expression of transforming growth factor-beta1 is significantly correlated with the expression of vascular endothelial growth factor and poor prognosis of patients with advanced gastric carcinoma[J]. Cancer,1999,86(8):1455-1462.
[14] 周玉汀,邱增华.CXCR4、EGFR、TGFβ1、MVD在食管鳞状细胞癌中的表达及意义[J].中华临床医师杂志:电子版,2015,9(20):8-13.
[15] 张蕻,梁小军,朴晋华,等.复方斑蝥胶囊体内外抗肿瘤作用的实验研究[J].山西中医学院学报,2003,4(3):17-19.
[16] 莫日根,牛建昭,王继峰,等.去甲斑蝥素对人脐静脉内皮细胞株的细胞毒作用[J].北京中医药大学学报,2001,11(6):25-28.
[17] 范跃祖,陈春球,赵泽明,等.去甲斑蝥素对胆囊癌肿瘤血管生成的作用及机制研究[J].中华医学杂志,2006,86(10):693-699.
[18] 安宁,朱文.人参皂苷Rg3抗肿瘤作用机制研究进展[J].现代肿瘤医学,2008,16(4):648-652.
[19] 王兵,高勇,许青,等.人参皂苷Rg3对肺癌诱导血管内皮细胞增殖的抑制作用[J].中国新药杂志,2002,11(9):700-702.
[20] 杨阳,刘玉翠,韩玉坤,等.刺五加成分的多种抗肿瘤作用[J].吉林医药学院学报,2014,35(5):366-369.
[21] 何福根,章红燕,沈斌.半枝莲抗肿瘤作用及其机制研究进展[J].中国肿瘤,2008,17(2):108-112.
[22] 李晓勇,刘少平.结直肠癌患者血清TGF-β1的检测及临床意义[J].广西医科大学学报,2011,28(1):82-84.
(本文编辑:曹志娟)
Prospective clinical study of compound cantharis capsule on TGF-β1and MVD in moderate and advanced colorectal cancer
LIUBingxin*,SUNChanggang,LIYoujie,etal.
*2010GradeofStraightEntrancetheUndergraduateandGraduate,ShandongUniversityofTraditionalChineseMedicine,Shandong,Jinan250355
Objective To observe the effects of compound cantharis capsule on the levels of transforming growth factor-β1(TGF-β1) and microvessel density (MVD) in moderate and advanced colorectal cancer. Methods 46 patients with moderate and advanced colorectal cancer were randomly divided into two groups, 23 cases in each group. The control group received FOLFOX4 chemotherapy, the treatment group received compound cantharis capsule on the basis of control group treatment. The TGF-β1and MVD before and after 1,2, 3 courses were measured, and the short-term curative effect was evaluated in two groups. Results The serum TGF-β1and MVD after 1,2, 3 courses were decreased in two groups, and the decrease in treatment group was lower than control group, with statistical differences (P<0.05). The short-term curative effect showed that the objective response rate (ORR) and disease control rate (DCR) in treatment group were higher than those in control group, with no statistical differences (P>0.05). Conclusion Compound cantharis capsule can down-regulated the expression of TGF-β1in colorectal cancer tissue, decrease the MVD in tumor tissue, can inhibit the growth and infiltration of tumor, which may be related with anti-tumor angiogenesis and tumor cells death.
Colorectal tumor; Chinese medicine therapy; Cantharis
10.3969/j.issn.1002-2619.2016.10.028
刘冰心(1989—),女,本硕连读生。研究方向:恶性肿瘤及血液病的中西医结合治疗。
R735.350.531
A
1002-2619(2016)10-1554-05
2016-05-11)
△ 通讯作者:山东省潍坊市中医院肿瘤一科,山东 潍坊 261041
1 山东省潍坊市中医院肿瘤一科,山东 潍坊 261041

