HepG2细胞胰岛素抵抗模型建立及盐酸小檗碱改善胰岛素抵抗的实验研究
龚 菂,李 芬,邹 欣,王定坤,陆付耳,王开富
(华中科技大学同济医学院附属同济医院 1.中西医结合研究所、2.实验医学研究中心,湖北 武汉 430030)
HepG2细胞胰岛素抵抗模型建立及盐酸小檗碱改善胰岛素抵抗的实验研究
龚 菂1,李 芬2,邹 欣1,王定坤1,陆付耳1,王开富1
(华中科技大学同济医学院附属同济医院 1.中西医结合研究所、2.实验医学研究中心,湖北 武汉 430030)
目的 建立HepG2(人肝胚胎瘤细胞)胰岛素抵抗(insulin resistance,IR)细胞模型,并在该模型上研究小檗碱改善IR的效应。方法 用25 mmol·L-1高糖,并分别用10-9、10-8、10-7、10-6、10-5、10-4mol·L-1胰岛素处理,诱导HepG2细胞产生IR;对2-NBDG(荧光素标记葡萄糖)与HepG2细胞孵育浓度设定为:50、100、200、400、600、800 μmol·L-1、孵育时间设定为:20、40、60、80、100 min,拟筛选最佳胰岛素处理浓度、2-NBDG与HepG2最佳孵育浓度和最佳孵育时间,通过检测细胞培养液中葡萄糖的消耗量及细胞对葡萄糖的摄取量作为判定模型成功的标志;用二甲双胍、盐酸小檗碱干预模型细胞,研究盐酸小檗碱在细胞水平上改善IR的效应。结果 6种浓度的胰岛素均可不同程度诱导HepG2产生IR,虽然10-5、10-4mol·L-1剂量最明显,但细胞死亡较多,以10-6mol·L-1剂量制模有效且细胞成活率高,与正常组比较差异具有统计学意义;当2-NBDG与HepG2细胞孵育浓度大于100 μmol·L-1时,细胞荧光强度与正常组差异有显著性,孵育时间超过20 min荧光强度与正常组比较有明显差异,超过100 min,细胞内荧光有明显淬灭衰减现象;盐酸小檗碱、二甲双胍能明显增加细胞培养上清液中葡萄糖的消耗及细胞对葡萄糖的摄取,与模型组比较差异具有统计学意义。结论 用HepG2制作IR细胞模型时,选择10-6mol·L-1剂量的胰岛素;2-NBDG孵育浓度选择为200 μmol·L-1、2-NBDG孵育时间选择为80min较为适宜,盐酸小檗碱及二甲双胍对HepG2细胞IR具有明显的改善作用。
盐酸小檗碱,HepG2细胞,胰岛素抵抗,细胞模型;葡萄糖摄取;实验研究
目前认为胰岛素抵抗(insulin resistance,IR)不仅是2型糖尿病的发病基础,也是贯穿多种代谢相关疾病的主线,是心血管疾病、高脂血症、高尿酸血症及代谢综合症的共同病理基础[1-2]。构建胰岛素抵抗细胞模型是进行IR相关疾病的病理机制探索及药物研发的重要途径。肝脏及外周组织是胰岛素作用的靶器官,是IR产生的主要部位。HepG2细胞源于人的肝胚胎瘤细胞,系一种表型与肝细胞极为相似的肝胚胎瘤细胞株,在高水平的胰岛素条件下,HepG2细胞表面胰岛素受体的数目下降,下降程度与胰岛素水平及刺激持续的时间呈正相关[3],因此 HepG2是体外研究胰岛素抵抗发病机制和降糖药物作用机制的理想细胞模型[4],鉴于目前许多报道有关HepG2 细胞体外建立胰岛素抵抗的实验条件均不太一致,特别是过去观察细胞成模只是单从细胞上清葡萄糖的消耗量来反映,有很大局限性,因此,我们对该细胞的制模条件、尤其是利用荧光标记葡萄糖-2-NBDG掺入到细胞内,对HepG2 细胞摄取葡萄糖的相关实验及小檗碱改善HepG2 细胞IR效应进行了系列研究,现报道如下。
1 材料与方法
1.1 药品与试剂 DMEM高糖培养基购自Hyclone;胎牛血清(FBS)购自Gibco公司;2-NBDG(荧光标记葡萄糖)购置Cayman Chemical公司;胰岛素购置Sigma公司;盐酸小檗碱(批号:110713-200208,纯度:99.0%)购自中国药品生物制品检定所;二甲双胍(批号:EJ121231,纯度:98.5%)购自天津太平洋化学制药有限公司。葡萄糖测试试剂盒购置南京建成生物工程研究所。
1.2 HepG2细胞培养 HepG2消化后,以每孔1.5×104种到96孔板内(完全培养基),吸去原培养基,加入无血清培养基,饥饿10 h。加不同浓度:0(不加胰岛素)、10-9、10-8、10-7、10-6、10-5、10-4mol·L-1胰岛素处理36 h(母液用无血清培养基稀释),吸去胰岛素,PBS清洗2次,加入无血清培养基,孵育24h,用葡萄糖氧化酶法,于505 nm处以酶标仪分别检测用胰岛素处理的各孔细胞培养上清液及未接种细胞的空白孔(含糖量已知的培养液) OD值,与葡萄糖的标准浓度计算每孔培养液中葡萄糖的含量,并用未接种细胞的空白孔糖含量均值相减,计算葡萄糖的消耗量。
计算方法:待测液葡萄糖含量/mmol·L-1=(待测液OD值/标准液OD值)×5.55 mmol·L-1
葡萄糖消耗量/mmol·L-1=空白孔糖含量均值-每孔细胞培养上清液糖含量
1.3 HepG2细胞与2-NBDG孵育时间 通过对细胞上清葡萄糖消耗量的检测初步筛选胰岛素最佳制模剂量为10-6mol·L-1,细胞成模后再用2-NBDG与HepG2细胞分别孵育20、40、60、80、100 min检测细胞上清葡萄糖消耗量及细胞对2-NBDG(荧光强度)摄取量,计算对照组与模型组的差值,筛选最佳孵育时间。
1.4 HepG2细胞与2-NBDG孵育浓度 通过对细胞上清葡萄糖消耗量的检测初步筛选胰岛素最佳制模剂量为10-6mol·L-1,细胞成模后再分别设定50、100、200、400、600、800 μmol·L-12-NBDG剂量与HepG2细胞共孵育60 min后,检测细胞上清葡萄糖消耗量及细胞对2-NBDG(荧光强度)摄取量,计算对照组与模型组的差值,确定2-NBDG最佳浓度。
1.5 荧光葡萄糖的摄取 将细胞种置于特殊的96孔板,黑板子底部透明,每孔1.5×104个细胞,用上述方法造模后,弃去培养液,PBS洗板2次,加入二甲双胍(终浓度为25 μmol·L-1)、盐酸小檗碱(终浓度为10 μmol·L-1)干预胰岛素抵抗的HepG2细胞,孵育24 h后收集培养上清液,用葡萄糖氧化酶方法检测上清液中葡萄糖的含量,PBS洗板2次,避光加入200 μmol·L-1的2-NBDG 37 ℃孵育1 h后弃去2-NBDG,用预冷的PBS洗2次,加入100 μL的PBS(整个过程避光),快速在酶标仪下,在460 nm 激发光、528 nm发射光,仪器灵敏度为50的条件下检测荧光强度,计算对照组及给药组细胞的葡萄糖消耗量及细胞对葡萄糖的摄取量。
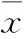
2 结果
2.1 不同浓度的胰岛素对制模的影响 如Tab 1所示,6种浓度的胰岛素均可不同程度的诱导HepG2产生IR,但10-6mol·L-1剂量最适宜,其细胞培养上清中葡萄糖消耗明显增多且细胞成活率高,与正常对照组比较差异具有统计学意义。
2.2 HepG2细胞与2-NBDG孵育时间 由Fig 1可见,当孵育时间>20 min以上,各时间组HepG2细胞对葡萄糖的摄取均明显增多,显示荧光强度明显强于NC组(P<0.05);于80 min摄取的葡萄糖最多,与NC组比较差异具有显著性(P<0.01),结果表明HepG2细胞与2-NBDG孵育时间以80 min较为适宜。
Tab 1 Effect of different concentrations of insulin on model


GroupInsulinconcentration(mmol·L-1)Glucoseconsumption(mmol·L-1)Normalcontrol05.771±0.22210-95.005±0.28310-85.316±0.161Model10-73.712±0.368*10-62.059±0.166*10-51.954±0.215**10-41.543±0.145**
*P<0.05;**P<0.01vsnormal control group (without insulin group)

Fig 1 Effect of different incubating time of 2-NBDG on fluorescence intensity
NC:Normal control;20-100: Different time set,*P<0.05,**P<0.01vsNC
2.3 HepG2细胞与2-NBDG孵育浓度 Fig 2显示,当孵育浓度>100 μmol·L-1以上,各浓度组HepG2细胞对葡萄糖的摄取均明显增多,显示荧光强度明显强于NC组(P<0.05,P<0.01),且孵育浓度与荧光强度具有明显的量效关系。
2.4 盐酸小檗碱对IR的HepG2细胞培养上清葡萄糖消耗的影响 如Tab 2所示,用盐酸小檗碱、二甲双胍分别对胰岛素抵抗的HepG2细胞进行干预后,发现两种药物均能促进细胞培养上清中葡萄糖的消耗,与模型组比较葡萄糖消耗量明显增多(P<0.05)。
2.5 盐酸小檗碱对IR的HepG2细胞内摄取葡萄 糖的影响 Fig 3显示,当盐酸小檗碱、二甲双胍组(西药阴性对照组)干预IR的HepG2细胞后,两组均能明显促进细胞对葡萄糖的摄取,显示细胞内荧光强度明显高于模型组(P<0.01);Fig 4显示,在荧光显微镜下(×200)观察进入到细胞内的2-NBDG,可见盐酸小檗碱及二甲双胍两组细胞内2-NBDG明显增多,荧光强度明显高于模型组。
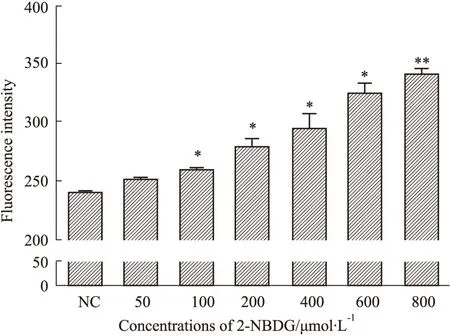
Fig 2 Effect of different concentrations of 2-NBDG on fluorescence intensity
NC:Normal control ;50~800:Different concentration groups.*P<0.05,**P<0.01vsNC.
Tab 2 Effect of berberine hydrochloride on glucose
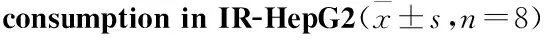

GroupDrugdose/μmol·L-1Glucoseconsumption/mmol·L-1Normalcontrol25.33±0.77Modelgroup11.95±1.94**Berberinehydrochloride1016.85±0.33*#Metformingroup25016.27±1.09*#
*P<0.05,**P<0.01vsnormal control group;#P<0.05vsmodel group
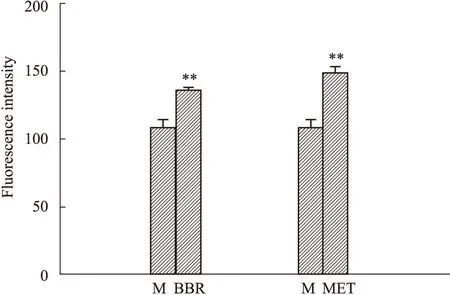
Fig 3 Effect of berberine hydrochloride on 2-NBDG uptake in HepG2 cells
M:Model group,BBR:Berberine hydrochloride; MET:Metformin group.**P<0.01vsmodel.
3 讨论
体外建立胰岛素抵抗细胞模型既能在细胞及分子水平深入探讨胰岛素抵抗的发生机制,又可体外筛选防治胰岛素抵抗的药物,因此建立稳定可靠的细胞模型至关重要,HepG2 细胞源于人的肝胚胎瘤细胞,是目前国内外应用较广泛的研究胰岛素抵抗机制的细胞模型。我们围绕细胞模型制作条件及盐酸小檗碱抗胰岛素抵抗的效应进行了系列研究,实验结果显示,不同浓度胰岛素刺激HepG2细胞均可不同程度诱导产生胰岛素抵抗,并表现为明显的量效关系,用10-5、10-4mol·L-1剂量的胰岛素刺激细胞能使细胞培养上清中葡萄糖消耗量明显减少,表明胰岛素抵抗明显,但MTT检测细胞时发现细胞死亡增多,可能是太高浓度的胰岛素使细胞的生长状态、生长活力有所降低,因此,该剂量制模不可取;用10-8、10-9mol·L-1浓度刺激细胞,虽然细胞存 活率高,但细胞培养上清中葡萄糖消耗量与正常对照组比较差异无显著性,表明胰岛素抵抗不明显,故以10-6mol·L-1诱导的胰岛素抵抗模型效果最佳。许多文献报道[5-6]判定胰岛素抵抗细胞模型成功与否,仅单从细胞培养上清葡萄糖消耗量来反映具有很大的局限性,也有人用同位素标记葡萄糖来监测细胞对葡萄糖的摄取量而反映胰岛素抵抗情况[7],方法虽灵敏可靠,但鉴于同位素对人体的伤害,导致目前国内几乎不生产同位素标记的葡萄糖试剂盒,取而代之的是新型的荧光素标记的葡萄糖-2-NBDG,这种试剂盒可以通过对细胞内荧光强度的检测来反映细胞对葡萄糖摄取量。因此本研究采用两种方法即同时检测细胞培养上清葡萄糖消耗量及细胞对2-NBDG摄取量来反映胰岛素抵抗的模型成功与否,更精细更完善。细胞与2-NBDG的孵育时间和孵育浓度是整个实验的关键,本研究结果显示:当孵育时间>20 min以上时,各时间组HepG2细胞对葡萄糖的摄取均明显增多,细胞内荧光强度明显强于NC组(P<0.05),表明细胞摄取的葡萄糖多,于80min摄取的葡萄糖最多,与NC组比较差异有显著性(P<0.01),结果表明HepG2细胞与2-NBDG孵育时间以80 min较为适宜;当孵育浓度>100 μmol·L-1以上时,各浓度组HepG2细胞对葡萄糖的摄取均明显增多,显示荧光强度明显高于NC组(P<0.05,P<0.01),且孵育浓度与荧光强度具有明显的量效关系。因此认为HepG2细胞与2-NBDG孵育浓度以200 μmol·L-1即可(考虑2-NBDG试药成本而不选用高剂量2-NBDG浓度)。
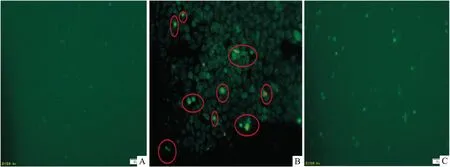
Fig 4 2-NBDG in cells under fluorescence miroscope(×200)
A: Model set B:Berberine hydrochloride(Drug dose:10 μmol·L-1) C:Metformin group(Drug dose:250 μmol·L-1)
盐酸小檗碱是一种常见的异哇琳生物碱,作为中草药其常用于治疗炎症、细菌相关性腹泻、肠道寄生虫感染等,除抗炎作用外,近来有关盐酸小檗碱改善胰岛素抵抗的报道相继增多[8-9]。本研究发现,在HepG2细胞胰岛素抵抗模型成功建立的基础上用盐酸小檗碱和二甲双胍干预细胞后,两种药物均能使细胞培养上清中葡萄糖的消耗量明显增多、细胞内荧光强度也明显增强,与模型组比较差异具有显著性(P<0.01),而两组药物间差异无统计学意义(P>0.05),荧光显微镜下观察也发现HepG2细胞对2-NBDG摄取明显增多(Fig 5),与荧光强度检测结果十分吻合,该结果表明盐酸小檗碱和二甲双胍均能明显改善高糖加胰岛素诱导的HepG2细胞胰岛素抵抗。近年来,小檗碱抗糖尿病已成为研究热点[10-12]但其作用机制尚未完全阐明。磷脂酰肌醇3激酶(PI-3K)途径是胰岛素信号转导的主要通路之一,研究表明,胰岛素刺激包括脂肪和骨骼肌在内的靶组织摄取利用葡萄糖是通过胰岛素受体(InsR)、胰岛素受体底物-1(IRS-1)、PI-3K葡萄糖转运蛋白4 (GLUT4)等一系列信号转导过程完成的[13]。在PI-3K途径中,当胰岛素与靶细胞表面的受体(InsR)结合,InsR即发生自身磷酸化并激活内在的酪氨酸激酶,导致IRS-1等酪氨酸残基磷酸化,磷酸化的IRS-1与PI-3K的p85调节亚单位结合,催化p110而激活PI-3K,活化的PI-3K可加速GLUT4从胞内易位至胞膜,调节肌细胞、脂肪细胞和肝细胞对葡萄糖的摄取[14]。这一信号转导过程的任何环节障碍均可引起胰岛素抵抗。对于体外的胰岛素抵抗细胞模型,盐酸小檗碱可能主要通过胰岛素信号转导途径来改善胰岛素的生物效应,提高细胞对葡萄糖的吸收。本实验结果表明小檗碱可能以胰岛素增敏剂的形式促进细胞对葡萄糖的消耗而改善HepG2细胞的胰岛素抵抗,但它促进细胞葡萄糖消耗或细胞对葡萄糖摄取的机制将在后期进一步的研究报道。
[1] Sowers J R,Frohlich ED. Insulin and insulin resistance impact on bloodpressure and cardiovascular disease[J].MedClinNorthAm,2004,88(1):63-821.
[2] Valeria L Z,Monika Z B. Insulin resistance in hypertension and cardio-vascular disease[J].BestPractice&Research,2006,20(3):355-3671.
[3] Levy J R,Belsky M. Down-regulated insulin receptors in HepG2 cells have an altered intracellular itinerary[J].AmJMedSci, 1990,299(5):302-308.
[4] Dhananjay G,Shailly V,Ramji L K. Long-term effects of tumor necrosis factor-α treatment on insulin sigalling pathway in HepG2 cells and HepG2 cells overexpressing constitutively active Akt/PKB[J].JCellBiochem,2007,100(3):593-607.
[5] 方 飞,吴新荣,罗明俐,吕 欢. HepG2细胞胰岛素抵抗模型的建立及在筛选桑叶有效部位中的应用[J]. 医药导报, 2012,31(6):691-4.
[5] Fang F, Wu X R, Luo M L, et al. Establishment of insulin resistance HepG2 cell model and its application in screening bioactive compoments of mulberry leaves[J].HeraldMed, 2012,31(6):691-4.
[6] 李秀丽,贺嵩敏,朱 莹,等. HepG2 细胞胰岛素抵抗模型的建立与鉴定[J]. 中国实验方剂学杂志, 2013,19(5):203-6.
[6] Li X L, He S M, Zhu Y, et al. Establishment and identify of HepG2 cells model of insulin resistance[J].ChinJExpTraditMedForm, 2013,19(5): 203-6.
[7] 易 屏,陆付耳,陈 广,等. 小檗碱抑制IKKBSer 181磷酸化改善高糖诱导的3T3-L1脂肪细胞胰岛素抵抗的分子机制[J]. 中草药, 2008,39(5):724-8.
[7] Yi P, Lu F E, Chen G, et al. Molecular mechanism of berberine on improving insulin resistance of 3T3-L1 adipocytes induced by high glucose through IKKβ Ser 181 phosphorylation[J].ChinTraditHerbalDrugs, 2008,39(5):724-8.
[8] 丁阳平,叶小利,周 洁,等. 小檗碱降糖作用机制研究进展[J]. 中草药,2013,44(6):763-9.
[8] Ding Y P,Ye X L,Zhou J, et al. Research progress in hypoglycemic mechanism of bererbine[J].ChinTraditHerbalDrugs, 2013,44(6):763-9.
[9] 陈 广,陆付耳,王增四,等. 小檗碱改善2型糖尿病大鼠胰岛素抵抗与PI-3K、GLUT4蛋白相关性的研究[J]. 中国药理学通报, 2008,24(8):1007-10.
[9] Chen G, Lu F E,Wang Z S, et al. Study on the improvement of berberine in type 2 diabetic rats with insulin resistance and the relationship between PI-3K and GLUT4 protein correlation[J].ChinPharmacolBull, 2008,24(8):1007-10.
[10]李 颖,李健琳,范 晨,等. 小檗碱片对2型糖尿病患者胰岛素分泌及抵抗的影响[J]. 现代诊断与治疗, 2015,26(7):1450-1.
[10]Li Y , Li J L, Fan C, et al. Berberine tablets in patients with type 2 diabetes insulin secretion and the influence of the resistance[J].ModernDiagnTreat, 2015,(267):1450-1.
[11]张 青,李 琰,陈 磊. 黄连素对 2 型糖尿病及其并发症的治疗作用及相关机制研究进展[J]. 中国中药杂志, 2015,40(9):1660-5.
[11]Zhang Q, Li Y, Chen L, et al. Effect of berberine in treating type 2 diabetes mellitus and complications and its relevant mechanisms[J].ChinJChinMaterMed, 2015,40(9):1660-5.
[12]马 航,胡慭然,邹宗尧,等.黄连生物碱降糖作用研究及构效关系初探[J]. 中国药理学通报,2015,31(11):1575-9.
[12]Ma H,Hu Y R,Zou Z Y,et al. Preliminary evaluation of antihyperglycemic effect of Rhizoma Coptidis alkaloids and their structure-activity relationships[J].ChinPharmacolBull,2015,31(11):1575-9.
[13]Wojtaszewski J F P,Hansen B F,Kien B, et a.l Insulin signaling in human skeletalmuscle: time course and effectof exercise[J].DiaBetes, 1997,46(11): 1775-81.
[14]Jackson S, Bagstaff S, Yeasman S J, et a.l Decreased insulin re-sponsiveness ofglucose uptake in cultured human skeletalmuscle cells from insulin-resistantnondiabetic relatives ofType 2 diabetic families[J].Diabetes, 2000,49(7): 1169-77.
HepG2 cell IR: Establishment of model and improvement by berberine
GONG Di1, LI Fen2, ZOU Xin1, WANG Ding-kun1LU Fu-er1,WANG Kai-fu1
(1.InsitituteofIntegratedTraqditionalChineseandWesternMedicine, 2.ExperimentMedicalResearchCenter,TongjiHospitalAffiliatedtoTongjiMedicalCollegeHuazhongUniversityofScienceandTechnology,Wuhan430030,China)
Aim To establish insulin resistance cell model on HepG2 cells (human embryonic liver tumor cells ) and investigate the effect of berberine hydrochloride on insulin-resistant HepG2 (IR-HepG2) cells. Methods ① IR model was induced by respectively using 10-9, 10-8, 10-7, 10-6, 10-5, 10-4mol·L-1insulin with 25 mmol·L-1glucose in HepG2 cells. ② HepG2 cells were incubated with 2-NBDG (fluorescent labeled glucose) in a series of concentration: 50, 100, 200, 400, 600, 800 μmol·L-1and a series of incubation time: 20, 40, 60, 80, 100 min, to select the optimum concentration of insulin and the optimum incubation concentration and time of 2-NBDG in HepG2 cells. The success of the model was determined by detecting the consumption of glucose in the cell supernatant and the uptake of glucose in HepG2 cells. ③ To study the effect of berberine hydrochloride on improving insulin resistance on the cell level, metformin and berberine hydrochloride were used in the IR cells. Results Six concentrations of insulin induced the IR model in different degrees. Although 10-4, 10-5mol·L-1insulin was significant, a large amount of cells died. 10-6mol·L-1insulin was effective and had high survival rate of HepG2 cells, which had statistical significance compared with the normal group. When the incubation concentration of 2-NBDG was more than 100 mol·L-1, the fluorescence intensity of the cells was significantly different from the normal group. When the incubation time of 2-NBDG was more than 20 min, fluorescence intensity was significantly different from the normal group. When the incubation time of 2-NBDG was more than 100 min, the fluorescence quenching phenomenon was obvious in the cells. Berberine hydrochloride and metformin significantly increased the glucose consumption and glucose uptake in cell supernatant, which had statistical significance compared with the model group. Conclusions Using 10-6mol·L-1insulin induced IR model in HepG2 cells, the optimum incubation concentration and incubation time of 2-NBDG is 200 μmol·L-1and 80 min, respectively. Berberine hydrochloride and metformin have obvious effect on improving IR in HepG2 cells.
berberine hydrochloride; HepG2 cells; insulin resistance; the cell model; glucose uptake; experimentel research
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.044.html
2016-07-05,
2016-09-10
国家自然科学基金资助项目(No 81373872)
龚 菂(1984-),女,检验师,E-mail:27770583@qq.com; 王开富(1958-),男,硕士,主任技师,通讯作者,Tel:027-83663660,E-mail:wkf58@163.com
10.3969/j.issn.1001-1978.2016.12.022
A
1001-1978(2016)12-1750-05
R284.1;R343.23;R347.8;R458.5;R587.1;R915;R977.15;R977.7

