GM1体外诱导人脐带血间充质干细胞分化为神经样细胞研究
马 延,郭金耀,刘 雷,范 春
(河北省任丘市华北石油管理总医院,河北 任丘 062552)
GM1体外诱导人脐带血间充质干细胞分化为神经样细胞研究
马 延,郭金耀,刘 雷,范 春
(河北省任丘市华北石油管理总医院,河北 任丘 062552)
目的研究单唾液酸四己糖神经节苷脂通过体外诱导人脐带间充质干细胞分化为神经样细胞并探索其最佳诱导浓度。方法取足月妊娠剖宫产健康胎儿的脐带,剔除脐动脉和脐静脉,用酶消化法获得 MSCs,贴壁培养,采用流式细胞技术行细胞表型检测。扩增后,取第4代细胞,分为 A、B、C、D、E 5组,前4组为实验组,E组为对照组,实验组各组 GM1浓度分别为:A组50μg/mL、B组100μg/mL、C组150μg/mL、D组200μg/mL,诱导液用L-DMEM培养基配制,对照组仅使用L-DMEM培养基。观察5组诱导人脐带血间质干细胞向神经样细胞分化的作用,每 60min观察细胞诱导前后的形态,在第360min时采用免疫细胞染色法检测胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经丝蛋白(neurofilaments protein H,NF-H)以及神经元特异性标记物微管结合蛋白-2(microtubule associated protein 2,MAP-2)的表达情况,并计算阳性细胞率。结果①大部分原代细胞在接种9h后贴壁,呈多边形、菱形,之后变为长梭形,细胞开始以漩涡、放射状生长。②P3、P5和 P10代细胞表面的分子标记经流式细胞术检测发现,均表达 CD105、CD90和 CD73,却不表达HLA-DR、CD19、CD11b、CD45以及 CD34。③诱导至第360分钟后,实验组各组细胞均有神经样细胞出现,表现为细胞胞体收缩成椭圆形,伸出较长突起,以双极细胞居多。免疫细胞化学检测显示实验组各组NF-H、MAP-2表达阳性,胶质纤维酸性蛋白GFAP表达为阴性,C组(150μg/mL)细胞 NF-H、MAP-2阳性表达率最高。对照组细胞诱导前后变化不明显。结论GM1可以诱人脐带间充质干细胞向神经样细胞分化,150μg/mL为最合适诱导剂量。
单唾液酸四己糖神经节苷脂; 人脐带间充质干细胞; 诱导分化; 神经样细胞
间充质干细胞(mesenchymal stem cells,MSCs)作为一种可以自我复制通过具有多向分化潜能的成体干细胞,这种干细胞能够发育成硬骨、软骨、脂肪和其他类型的细胞。Baksh等[1]目前已经从脐带静脉中分离出间充质干细胞,同时发现脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)具有很好的增殖及分化能力,其取材过程不具有侵袭性以及伦理学限制,因此被认为科研以及临床研究中的间充质干细胞来源。神经节苷脂(ganglioside,GS)是一类含唾液酸的糖鞘脂,广泛存在于脊椎动物各组织细胞膜上,以大脑灰质中含量最高,其与神经细胞的分化、神经树突的伸长、突触的形成有重要关系[2]。较早的研究就已发现外源性施加神经节苷脂可以促进神经系统的再生和突触的形成。本实验进行了GM1体外诱导 HUMSCs向神经样细胞分化的研究,并对 HUMSCs的神经分化机制进行了探讨。
材料和方法
1 脐带来源
取足月妊娠剖宫产健康的新生儿脐带,华北石油管理总医院妇产科提供。
2 主要试剂
单唾液酸四己糖神经节苷脂钠注射液,低糖及高糖DMEM/F-12培养基,胎牛血清,胰蛋白酶,青、链霉素霉素溶液(上海拜力生物),DMSO(美国赛默飞世尔科技公司),Triton-X 100(上海索莱宝生物科技有限公司),多聚甲醛(天津市化学制剂研究所),表皮生长因子,FITC-CD19抗体,FITC-CD34抗体,PE-CD11b抗体,PE-CD73抗体,PE-CD45抗体,PECD105抗体,PE-CD90抗体,GFAP抗体(BD公司),NF-H抗体(Cell Signaling Technology公司),MAP-2抗体(Millipore公司),PS免疫组化试剂盒(北京中杉金桥公司)。
3 HUMSCs的体外分离与扩增
收集足月健康胎儿的脐带,用磷酸缓冲盐溶液进行冲洗,去除脐静脉以及动脉,然后把切割余下脐带间质组织成1mm3小块,胶原酶Ⅱ(0.2%)进行消化,最后放于DMEM/F12培养基中培养(2ng/mL表皮细胞生长因子、20%胎牛血清、25mM左旋谷氨酰胺、100μg/mL链霉素以及100U/mL青霉素)。待细胞至90%以上融合后弃去培养基,磷酸缓冲盐洗涤,加胰酶EDTA消化液2mL,37℃消化3min,吹打细胞到完全脱落,离心上清后用培养液重悬细胞,吹打均匀,按照1∶2的比例传代。在5%CO2、37℃培养,24h后换液,将未贴壁细胞除去,以后每48~72h换液,倒置相差显微镜观察细胞形态及生长状况。
4 HUMSCs的细胞表型分析
用一对成长期的人脐带间充质干细胞,采用0.25%胰蛋白酶以及0.2g/L的EDTA混合液进行消化,接下来采用PBS冲洗悬浮成单细胞悬液后用细胞计数板进行计数,分别装于10只1.5mL的EP管中,每管大于106个细胞,之后分别加5μL的鼠抗人单克隆抗体CD45-PE、CD11-PE、CD90-PE、CD73-PE、CD105-PE、CD19-FITC、CD34-FITC以及 HLADR-PE,剩余两个 EP管分别加入7μL抗鼠 IgG1-FITC以及 IgG1-PE为对照组,4℃避光孵育 30s;加入少量 PBS冲洗、离心、去上清,重悬细胞后,采用BD公司 LSRFortessa型号流式细胞仪进行检测。
5 GM1诱导HUMSCs向神经样细胞分化
按照随机数表法将细胞分为对照组和观察组。取生长状态良好且处于 对数生 长期的 P3代HUMSCs,PBS清洗2次后消化,采用 FBS终止消化离心,最后加 1mL培养液重悬细胞,将细胞按 1× 105/mL浓度分别加入多聚赖氨酸包被的5个六孔板中,随机分为A、B、C、D、E共5组,置于培养箱中培养,待各组细胞融合至80%时,A、B、C、D各组分别加入 GM1浓度为 50μg/mL、100μg/mL、150μg/mL、200μg/mL的诱导液,E组只加入等量 L-DMEM培养基,各组均置于37℃、5%二氧化碳、饱和湿度条件的细胞培养箱中诱导6h。每1h用倒置相差显微镜下观察细胞形态变化1次。
6 诱导细胞的鉴定
于诱导后第6h,用免疫细胞化学染色的方法检测各组MAP-2、NF-H、GFAP的表达情况,具体方法如下:除去六孔板中的培养液,PBS轻洗一次;4%多聚甲醛室温固定20秒;PBS洗涤三次;用含0.5%Triton-X 100的 PBS室温避光破膜 15秒;PBS洗涤三次;加入含3%H2O2的去离子水孵育 5秒;PBS冲洗三次;加入封闭血清工作液,孵育 15秒,倒去,不用洗;按照MAP-2与GFAP(1∶200)、NF-H(1∶200)添加稀释一抗,4℃过一夜;PBS洗涤三次;添加生物素化的二抗工作液,室温孵育 15 min;PBS洗涤三次;滴加辣根酶标记的链霉卵白素工作液,室温下孵育15秒;PBS洗涤三次;新鲜配制的 DAB显色1秒;苏木素进行复染,自来水反复冲洗。拍照时弃去六孔板中的培养液,PBS轻洗一次;4%多聚甲醛室温固定20秒;PBS洗涤三次;用含 0.5%Triton-X 100的 PBS室温避光破膜15秒;PBS洗涤三次;用含2%小牛血清白蛋白的PBS室温封闭 1h,倒去,不用洗;按MAP-2与GFAP(1∶200)比例、NF-H(1∶200)稀释壹抗,4℃过一夜;PBS洗涤三次;铝箔包裹后在 37℃用二抗孵育0.5h以上;吸除二抗,加入 DAPI染色液室温作用 15秒以上;PBS洗涤三次;荧光显微镜下观察,用合适波段激发,照相保存结果。
7 主要观察指标
①观察HUMSCs形态以及生长情况。②观察HUMSCs表面的标志物表达情况。③观察细胞诱导分化后的特异性标志物表达情况。
8 神经样细胞特异性标记物的统计
显微镜下各组随机取12个非重叠视野,计算神经样细胞数,采用社会科学统计程序 19.0版,计量数据以±s表示。
结 果
1 各组中神经样细胞的形态及数量变化
按1∶1将神经细胞传代,1d后多数细胞已经贴壁,呈三角或菱形,2d后细胞开始增多并呈长梭形,7d后80%细胞开始融合,细胞按照漩涡或放射状排列。诱导后1h,各组均可见部分细胞胞体收缩为椭圆状,两端伸出突起,呈纺锤样,以D组神经样细胞数量最多,A组最少;第2、3h各组神经样细胞数量逐渐增加,突起伸长,以 D组比率最高;第4h时,A、B、C组神经样细胞数继续增加,表现为双极或多极细胞,以双极细胞为主,D组神经样细胞开始脱落,比率不再增加;第 5h时,A、B组神经样细胞增加不明显,可见部分细胞脱落,C组神经样细胞数目最多,也伴随少量细胞脱落,D组神经样细胞呈片状脱落,比率明显下降;第 6h时,A、B组神经样细胞不再增加,C组神经样细胞未见明显变化,D组只有少量没有脱落的神经样细胞;E组细胞诱导前后的形态并未发生明显变化。图 1为观察到的双极细胞。
2 免疫细胞化学检测神经细胞特异性标志物
选择 P2、P5以及 P10代的细胞利用流式细胞技术进行细胞表面分子标志物检测,结果显示细胞均表达CD73、CD90以及CD105,同时发现细胞不表达CD11b、CD19、CD34、CD45以及HLA-DR(MHC-II)。经6 h不同浓度的 GM1诱导后,多数神经样细胞的NF-H、MAP-2出现黄绿色荧光,为阳性,GFAP为阴性;而对照组并未出现阳性表达,且 PBS组也为阴性。其中箭头所指的细胞即为神经样细胞,多为双极细胞。A、B、C、D组细胞中表达的 NF-H及MAP-2均高于 E组,差异均具有统计学意义(P<0.01),且C组神经样细胞抗原表达率最高。表1为根据荧光显微镜观察后所统计的数据。
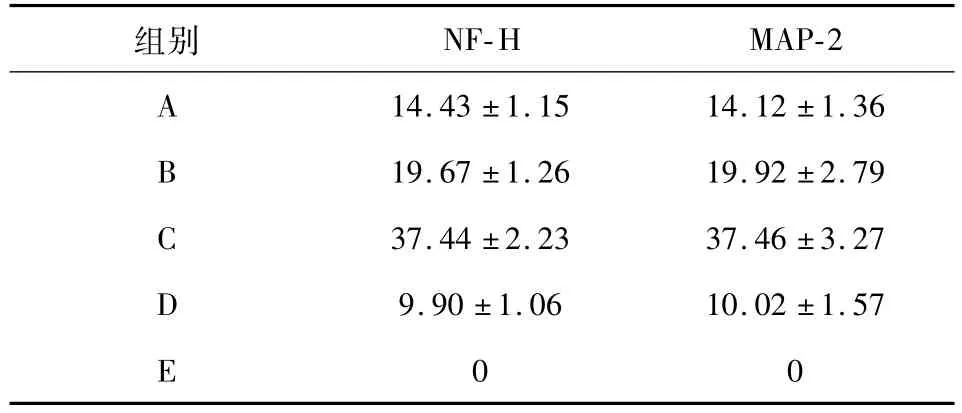
表1 不同质量浓度 GM1诱导液诱导 HUMSCs 6h后神经样细胞抗原表达率的比较
讨 论
MSCs通常是中胚层的成体干细胞中起源,并从骨髓、胎盘以及脐带血等组织中分离而来,具有高度增殖、自我更新以及多向分化的潜力。研究发现HUMSCs比 MSCs优势有以下几点:1、脐带的来源并不受限于伦理学,且成本低;2、HUMSCs具有抑癌性不会导致畸胎瘤发生,此外HUMSCs还具有低免疫原性,免疫调节稳定性等,因此具有良好的临床治疗潜力[3]。目前大多数报道发现 MSCs移植治疗神经系统疾病效果令人满意[4-5]。然而动物实验发现,MSCs移植到损伤神经组织后,仅少量分化成神经样细胞[6-7];体外诱导实验证实损伤的脊髓组织液仅能低效的诱导 BMSCs分化成神经样细胞[8-9]。因此,寻找能诱导或促 MSCs分化的药物具有重要意义。本实验证实了神经节苷脂可以在体外诱导 HUMSCs分化为神经样细胞,并表达神经元特异性蛋白:微管结合蛋白-2、NF-H,但并不表达GFAP。
GS是由亲水的单唾液酸的寡糖链以及疏水的神经酰胺组成含有单唾液酸的鞘糖脂,研究发现其影响细胞粘附、识别以及的跨膜信息传导,其机制主要利用多肽生长因子来促进细胞增殖以及成熟。外源性的神经节苷脂通过血脑屏障后促进神经元轴索再生形成突触[10],从而提高神经营养因子对细胞的作用[11],抑制损伤的神经细胞凋亡[12],保持神经干细胞的快速增长[13]。
赵春华等[14]发现,亚全能干细胞群的亚全能基因组除了原始干细胞表型丢失外,其在胚胎发育成熟后仍然具有干细胞的作用。在适宜的环境刺激下,细胞可以进一步分化为各种组织细胞。HUMSCs在 GM1诱导下可以激活神经细胞特异性的表达,促使HUMSCs分化成神经细胞,其激活的机制可能为:①对 HUMSCs的跨膜离子流产生影响,Ca2+作为细胞内信息传递的第二信使,其在细胞内外的浓度变化以及跨膜流动受到 Ca2+-ATP酶的调节并可引起不同生物学效应。崔文[15]等人的研究表明,外源性的 GM3对 Ca2+-ATP酶有双向调节作用,即低浓度抑制,高浓度激活。刘云云[16]等人发现,Ca2+螯合剂川芎嗪可以抑制胞内Ca2+信号,增加NSE和Nurrl基因的表达,最终促使 HUMSCs分化为神经细胞。由此可以推断 150μg/mL GM1诱导液是否抑制了HUMSCs细胞膜上的 Ca2+-ATP酶,从而减少了细胞内 Ca2+的浓度,进而影响了跨膜信号的传递,导致一些神经元特异基因的表达,最终促使HUMSCs向神经细胞分化;②对神经生长因子的作用,GM1可以促进 NGF的产生[17],高浓缩的神经营养因子培养液模拟了胚胎发育阶段神经发生的微环境,在神经营养因子作用下,上调 MSC膜蛋白表达,其中TrkA、TrkB、TkrC和神经营养因子受体结合后可以重拍基因表达程序[18],让 MSC分化为神经细胞。③影响神经突出,GM1通过激活细胞膜表面的异位蛋白激酶,传递信号至胞内,从而调节神经突起的生长以及延长。
目前,神经节苷脂作为一种神经营养药物已经广泛应于临床并发挥了治疗作用,但 GM1能否在体内将移植的HUMSCs有效地诱导为神经细胞并发挥作用还待于进一步的研究证实。
[1]Baksh D,Yao R,Tuan RS.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow.Stem Cells,2007,25(6):1384-1392.
[2]宁娜,陈乃宏.神经节苷脂的生物学活性.生理科学进展,2009,40(1):24-30.
[3]王艳,张晋林,黄晓兵,等.脐带间充质干细胞研究现状与临床治疗.重庆医学,2013,42(18):2161-2163.
[4]于靓霞,陈芳,孙军,等.脐带间充质干细胞移植治疗大鼠重症肌无力的研究.中国实验血液学杂志,2011,19(3):744-748.
[5]杨华强,王云甫,李东升,等.脐带间充质干细胞移植治疗遗传性痉挛性截瘫 2例.中国组织工程研究,2011,15(1):167-170.
[6]赵宗茂,张庆俊,韩忠朝,等.骨髓间质干细胞移植对大鼠脊髓损伤神经功能恢复的影响.中华神经外科杂志,2003,19(1):58-62.
[7]Lee J B,Ku roda S,Shichinohe H,et al.A pre-clinical asses smentmodel of rat autogenetic bone marrowstromal cell transplant action into the central nervous system.Brain Res Brain Res Protoc,2004,14(1):37-44.
[8]唐云安,王瑞淑,张成,等.大鼠脊髓匀浆上清液对骨髓间质干细胞的诱导分化作用.中风与神经疾病杂志,2003,20(3):196-198.
[9]梅晰凡,秦书俭,范广宇,等.损伤脊髓组织液对大鼠骨髓基质细胞向神经细胞诱导分化的研究.中国临床解剖学杂志,2005,23(3):264-267.
[10]Schengrund C L,Mummert C M.Exogenous gangliosides.How do they cross the blood-brain barrier and how do they inhibit cell proliferation.Ann N Y Acad Sci,1998,845(1):278-283.
[11]常艳,薛毅珑,潘静坤,等.神经干细胞体外诱导分化为胆碱能神经细胞.标记免疫分析与临床,2004,11(4):204-207.
[12]卓豫,廖维宏,吴宝明,等.GM-1对脊髓损伤后神经细胞凋亡的影响.中国脊柱脊髓杂志,2003,13(9):536-538.
[13]舒赛男,魏来,方峰,等.免疫磁珠分选系统在分离大鼠骨髓干细胞群中的应用.标记免疫分析与临床,2006,13(1):35-37.
[14]赵春华,房伯俊,韩钦,等.亚全能干细胞群生物学特性及移植应用研究.微循环技术,2004(5):345.
[15]崔文,刘银坤,张夏英,等.外源性神经节昔脂GM3对Ca2+-ATP酶及红细胞胞浆 Ca2+浓度的影响.上海医科大学学报,1994,31(5):385-387.
[16]刘云云,赵兴绪,赵洪斌,等.Ca2+信号介导川芎嗪诱导小鼠骨髓间充质干细胞向神经细胞的定向分化.甘肃农业大学学报,2010,45(2):1-5.
[17]Liberini P,Pioro E P,Maysinger D,et al.Long-term protective effects of human recombinant nerve growth factor and monosialoganglioside GM1 treatment on primate nucleus basalis cholinergic neurons after neocortical infarction.Neuroscience,1993,53(3):625-637.
[18]袁源,杨树源,韩忠朝,等.人脐带间充质干细胞体外扩增和向神经元样细胞定向诱导分化的研究.中华神经医学杂志,2006,5(3):230-236.
(杨 欢 张增武编辑)
Differentiation of Human Umbilical Cord Blood Mesenchymal Stem Cells into Neuron Like Cells in Vitro Induced by GM1
MA Yan,GUO Jin-yao,LIU Lei,FAN Chun
(General Hospital of Huabei Petroleum Administration,Renqiu 062552,China)
ObjectiveTo study the monosialo four hexose ganglioside(GM1)induced human umbilical cord mesenchymal stem cells into neuron like cells and to explore the optimal concentration in vitro.MethodsThe umbilical cord,umbilical artery and umbilical vein were collected from the healthy fetus in full term pregnancy.The MSCs was obtained by enzyme digestion method and the cell phenotype was determined by flow cytometry.After amplification,the fourth generation cells were divided into A,B,C,D,E five groups.The first 4 groups were the experimental groups,E as control group.The experimental group cells were treated with different concentrations of GM1,group A 50μg/mL,B 100μg/mL group and C group 150μg/mL group D 200μg/mL.Inducing medium was diluted by L-DMEM,the control group was only treated with L-DMEM medium.The morphology of 5 groups was observed and compared every 60 min.At 360 min,the expression of glial fibrillary acidic protein(GFAP)and neurofilament protein(neurofilaments protein H,NF-H)and neuron specific markers of microtubule-associated protein 2(MAP-2)was examined by immunohistochemistry,and calculate the rate of positive cells.ResultsMost of the primary cells were adherent at 9h after inoculation.The cells evolved from polygonal and diamond shapes to spindle shape,and then into spiral and radial shape.Expression of CD105 and CD73,but not HLA-DR,CD90,CD19,CD11b,CD45,CD34,and P3 were detected by flow cytometry.The molecular markers of P5 and P10 on cell surface were detected by flow cytometry.At 360th minutes after induction,the cells of the experimental group were found to be neuron like cells,which showed that the cell bodies were contracted into oval shape,extending out longer processes,and the bipolar cells were the majority.The expression of NF-H and MAP-2 were detected in the experimental group,whereas GFAP was negative.NF-H and MAP-2 in C group(150μg/mL)was at highest rate.Conclusionmonosialo four hexose ganglioside,GM1 can induce umbilical cord mesenchymal stem cells to differentiate into neuron like cells.The concentration of 150μg/mL was the most appropriate induction dose.
Monosialo four hexose ganglioside; Human umbilical cord mesenchymal stem cells;Differentiation; Euron like cells
10.11748/bjmy.issn.1006-1703.2016.12.030
2016-10-27;
2016-11-21

