热成像技术与近红外光谱技术结合无损检测西拉葡萄叶片水分含量
李光君
(墨尔本大学农业与动物医学学院,维多利亚墨尔本300457)
热成像技术与近红外光谱技术结合无损检测西拉葡萄叶片水分含量
李光君
(墨尔本大学农业与动物医学学院,维多利亚墨尔本300457)
西拉是一个古老而优质的酿酒葡萄品种,改良其种植技术与方法越来越受到人们的关注。其中,葡萄植株水分含量的测定与控制对其种植与收获有很重要的影响,因此,寻找其快速简便且非破坏性的测量方法十分重要。为了探究实现对葡萄藤叶水分含量的无损且简便快捷的测量方法,用热成像技术与近红外光谱法结合对叶片水分进行检测,并找出其与叶片含水量之间的相对应关系。结果表明,使用热成像技术和近红外光谱技术分别测量葡萄藤叶片水分含量参数CWSI与IG,可以通过计算得出二者均与叶片水分丢失有明显的线性关系。热成像技术与近红外光谱法结合可以用来较为精确地测量叶片水分含量,同时做到快速无损。
热成像技术;近红外光谱检测技术;水分流失;温度变化;作物干旱指数
作为一种古老的农作物,葡萄最初起源于黑海和里海之间的区域。2 500多年前,人类已经开始在西班牙种植葡萄并开始酿造葡萄酒[1]。葡萄是适应能力较强的作物之一,它可以生长于各种气候和土壤条件下。尽管如此,高温、缺水、害虫和疾病仍然会影响葡萄生长。近年来,葡萄酒产业发展迅速,用来生产出优质葡萄和葡萄酒的商业种植的葡萄园受到广泛的关注。在澳大利亚,西拉是种植最广泛的葡萄品种之一,超过40%的澳洲红酒都是由西拉为原料酿制的[2]。西拉最初产自法国,于1831年被引入澳大利亚。到了18世纪60年代,西拉在澳大利亚成为一种主要的酿酒葡萄品种,在整个澳大利亚,自湿热的南部地区到阳光充足的北部地区均有种植。此外,西拉的生长会受到不同生长条件尤其是水文环境的影响。
由于近年来气候变化,地表环境温度升高,降雨量增加,可能会导致树冠很大程度上的蒸腾量增加,但水吸收效率降低,会影响葡萄藤内水平衡和藤蔓的营养生长[3]。
葡萄栽培学中,水分条件是影响葡萄质量与数量最重要的指标之一。一方面,经常缺水会导致产量减少,特别是在季节初期[4];然而,轻度缺水可在一定程度下提高葡萄的质量[5]。在某些特殊的情况下,缺水也可以提高酿酒葡萄的质量[6]。因此,这个特殊的临界值必须时刻处于监控之下,以防过度缺水给葡萄的产量和质量带来不良的影响。
葡萄藤水状况的监测是保障葡萄和葡萄酒优质的基本部分。这里包含有一些测量葡萄藤中水分状况的技术[7]。蒸散计是一种直接测量农作物中水状态的设备,其作用是通过测量整个系统中质量以及权重的减少量,来记录水分在叶子中的传送或蒸发过程,这种技术非常成熟而且简单。通常,蒸散计是一种用于地表下的敏感测量设备,其结构和维护保养非常复杂,且费用昂贵。因此,目前该设备仅仅用于葡萄藤的科学研究中[8],很难在葡萄园中推广应用。而中子探测仪是运用中子水分探针与中子散射技术测量土壤中水的含量,这可以测量不同深度土壤中的水分张力。根据由蒸散计提供的不同水分质量以及土壤中水分张力的数据,可以计算出葡萄藤中的水分状态及水分用量。这种设备可以建立整体根系部分的水分剖面模型,以及能在毫米级上估计土壤中的水分。另外,中子探测器可以精确地检测土壤中水分的相关数据。这些优势在决定用水量方面是很实用的。然而,其也仍然存在很多缺点。中子探测器分析结果非常复杂,通常由专业的技术人员操作,普通种植户支付不起这笔费用。而且,中子探测器是用射线来测量土壤中的水分,可能对操作者和环境有害。
由于上述方法的局限性,应该发展一些其他的技术来保障葡萄种植农场的水管理系统。因此,一些先进技术已被引入到农作物种植中,比如图像处理技术。现如今热成像分析法中2种最先进的技术分别是温度记录法和温度测定法。其中,温度记录法通常使用红外温度探测器,这种探测器可以固定在例如飞行器等装载物上从叶片和葡萄藤上不同的部分测得不同的数据,这种数据可表明葡萄藤中的水分状态。通常用于温度记录,这种方法是通过采集不同的热成像得到相关的数据[9]。
另一种被广泛应用的方法是近红外光谱检测法,其可以提供分子键C-H键、O-H键之间明显的理化性质。所以,近红外光谱检测法可以检测水中的O-H键,从而可以应用在葡萄园种植的水分管理系统上[10]。
本试验通过检测葡萄藤在不同时间内的水分减少,从而找出失水与温度变化的关系。使用热成像分析法确定叶片区域温度,同时使用近红外光谱检测法确定叶片构成,从而分析出水分含量变化;通过建立偏最小二乘回归法模型分析水分状态与叶片构成的关系,帮助预测葡萄园中的水分状态和控制水分供给。
1 葡萄藤叶水分的传统检测方法
基于葡萄园的基本特征,人们想出一些非破坏性的测量监控葡萄藤和叶片水分含量的方法,如热力学方法包括温度记录法和温度检测法,以及近红外光谱法。
1.1 红外温度测量法和温度记录法(热成像法)
作为测量和描绘植物中水分状态的工具,红外温度测量法和热成像技术都是具有应用于多种作物及不同地形测量工作的潜力的测量方法[11]。温度高于绝对零度的物体均会由于分子运动向四周辐射红外线,以热成像技术为例,红外探测器可以将待测物体的辐射信号转换成电信号,然后利用扫描成像设备输出信号,模拟待测物体表面温度的空间分布,获得目标物体的温度数据。通过使用热成像技术,可以实现温度的远程测量,并进行了相关分析。
作为植物水分胁迫的一个指示标准,植物冠层温度在热成像技术发明之前很难被检测。利用这些红外热能技术,植物冠层温度可以通过热成像相机或温度传感器在不同的视野和角度被测量[12]。Taghvaeian等[13]利用红外热成像技术测量出玉米植株的作物水分胁迫指数(CWSI)和实际蒸腾量。通过远程传感器及温度测量技术监测科罗拉多州北部的向日葵植株中的水分胁迫指数以及DANS指数,从而确定水分含量及状态[14]。热成像技术(温度记录)也可以用于测定葡萄藤树冠的温度变化,从而计算出气孔导度指数(IG)和作物水分胁迫指数(CWSI),证明气孔导度的变化可以通过水分状态显示[15]。
有研究发现,热成像方法可以提供较为准确的接近实时精确度的葡萄园水分胁迫程度的相关数据以及所测图像中的所有像素的温度数据。因此,它可以很容易区分阳光照射下的树叶区域和阴影区域,从而评估葡萄藤叶中的水分状态。此外,这种方法操作简便,可以保证葡萄种植过程不受干扰,同时适用于普通葡萄种植者,可帮助其改善灌溉计划。这种方法主要依靠软件分析,不需要专业顾问,用户可以利用软件将图像转换成作物水分胁迫指数,从而直接得出葡萄藤的水分状态[13]。然而,该方法也存在缺点:用于图像数据分析处理的相应软件非常昂贵;为获得准确的温度数据,数据校正十分必要,但这个过程耗时长且乏味;利用飞行器采集数据,飞行器的稳定性会显著影响图像的质量,而质量较差的图像可能会导致复杂且昂贵的后续处理过程[16]。
1.2 近红外光谱技术
近红外光谱是一种介于可见光和红外光之间的电磁波辐射。根据美国材料测试学会检测研究,近红外光谱是指波长在780~2 526 nm范围内的电磁波,通常被分为两大部分,780~1 100 nm的近红外短波和1 100~2 526 nm的近红外长波[17]。近年来,常使用近红外光谱法和近红外高光谱法这2种方法进行葡萄植株水分含量测定。
1.2.1 近红外光谱法近红外光谱吸收光谱属于分子振动光谱,主要是由于分子运动产生的振动能量使得能级迁移,从基态能级跃迁到高能级。近红外光线主要吸收氢基的振动频率XH(X=C,N,O),其中,包含有大多数类型的化合物分子结构和组成的信息。不同化合物含有不同氢基的基团,处于不同的能量水平,不同的基团和同一种基团在不同的物理和化学环境中对近红外光的吸收波长均有显著差异。因此,近红外光谱可以用来获取有效的信息载体[17]。
当受到近红外光辐照时,相同频率的光和自由基将发生共振现象,光能量将通过改变分子的偶极矩传递给分子,但如果近红外光的振动频率与样本分子不同时,此特定频率的近红外线将不会被相应分子吸收。由于样品有选择地吸收特定范围的近红外光,使得此波段近红外光强变弱[17]。因此,只有不断改变近红外光的频率来照射样品,才能得到由近红外光所携带的待测物质的结构和组成的信息。基于传播或反射光的密度,可以确定待测样品的相关信息。
近红外光谱技术包括定性和定量的分析,其目的是确定样本的组成和结构,并确定各组分的具体含量。与传统的化学分析方法相比,近红外光谱法是一种利用统计学方法建立表示样本属性值与近红外光谱数据之间关系的关联模型(也称为校准模型),从而进行分析的间接分析技术。因此,在分析未知样品前,需要一定数量的样本用于建立关联模型,进而收集获得由近红外光谱仪测得的光谱数据和由化学分析方法测得的真实数据。
1.2.2 近红外高光谱技术作为一个快速且非破
坏性的测量技术,近红外高光谱技术已经被应用在许多农作物和食品检测中,例如茶叶。Deng等[18]使用近红外高光谱技术测量了龙井茶叶的含水量,首先将茶叶分为2组(对照组和测试组),在整个失水过程中多次测量叶片质量;同时,使用高光谱图像系统在每次失水过程中扫描每一片茶叶得到相应的近红外光谱图像;接下来利用偏最小二乘回归法(PLS)构建模型,并利用模型预测龙井茶叶中的含水量。不同的反射光谱可以显示叶片中不同的水分含量。因此,处理样品的数据可以计算测试样品的水分含量。此外,近红外高光谱成像也用来测量葡萄果实中花青素含量的变化[19]和油菜叶中氮(N)、磷(P)、钾(K)三大营养元素的含量[20]。
1.2.3 近红外光谱和高光谱之间的比较近红外光谱法被认为是比其他分析技术如气相、高效液相色谱法和传统化学方法更可靠的方法,因为它操作简便、快速,不需要化学试剂,且对受试对象没有破坏性。近红外光谱分析方法的主要缺点是依赖化学计量学方法得出的模型和对照参考法。近红外光谱分析方法只能提供样品的平均光谱值,从而失去了样品中各组分的空间分布信息。相比之下,近红外高光谱方法吸收了近红外光谱方法的优势,可以同时测定待测物质的空间信息和光谱信息[21]。
2 材料和方法
试验分为3个步骤。第1步是葡萄藤叶的准备:墨尔本大学农学院和动物医学学院开展葡萄藤的种植。第2步是用质量检测仪检测葡萄叶中水分的流失;同时,红外热成像仪以及近红外光谱检测相同样品的相应数据。最后一步是分析水分压力以及各项结果之间的关系。
2.1 样品的准备
样品叶片取自盆栽西拉葡萄藤,葡萄藤已在Mt Langi Ghiran葡萄农场生长了3 a。葡萄藤在4℃的冷藏箱中处于休眠状态,冬天过后于2015年9月25日移栽出来。保持合理灌溉和施肥直至新叶片长出,之后用Seasol Foliar Spray喷雾剂(浓度0.5%,v/v)每2 d喷一次,持续20 d,喷于葡萄的叶片上。停止2 d后,随机从不同的葡萄藤上剪下10片带柄叶子,标号,并且分别放在不同的塑料存储袋中,然后放置在冰袋中。另外,将整个葡萄藤连盆一起放到实验室,与叶片样本放置于同一位置。准备2把干燥清洁的刷子,肥皂水(浓度0.01%,v/v),纯净的凡士林和电子天平。
2.2 葡萄藤中的水分流失的检测
叶子中水分的蒸发作用会让水分从气孔中流失,所以当叶子从植物上被剪下来后,它们开始通过蒸发作用失水,并且由于无法从植物中得到水分的补充而持续失水[22]。
本试验中,用电子天平(精度为0.001 g,最小测量质量为0.000 1 g)依次测量10片叶子减掉叶柄后的质量减少量,并且记录数据。然后,将其放在实验桌清洁的白纸上,并置于通风良好且直接光照处。10 min后,按照之前的方法重新测量一遍。不断重复上述过程直至叶片的质量没有明显的变化为止。
2.2.1 红外热成像技术法测定红外照相机用来获取物体的温度分布图,方便监测物体的温度变化,不同的温度用不同的形状和颜色表示。每一片叶子均用一张白纸作为背景,在电子天平称质量后再立即用FLIR ONE型红外照相机拍摄热成像图。参数参考温度T干和T湿,取自于大小相似、距离较近但不在同一藤上的2片叶子上的红外检测结果。在获取热成像图之前,分别用2把清洁干燥的刷子蘸取肥皂水和凡士林并涂满整个叶子的两面,等待2 min后拍摄图像。参考温度T干和T湿将由涂满凡士林的叶子和涂满肥皂水的叶子上得到。所有的图片都会保存在相应的软件中(FLIR QuickReport),用于之后的数据分析。
农作物水分胁迫指数(CWSI)是用来描述植物中水分状态,可以用公式(1)进行计算[23-24]。气孔导度指数(IG)可以建立叶片温度和叶片电导率之间的关系,也可用公式(2)得出[22,25]。
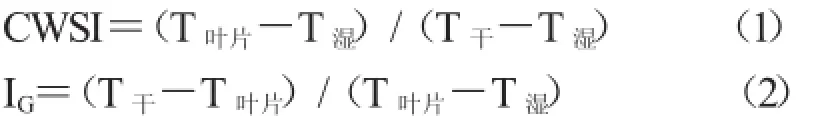
2.2.2 近红外光谱法测定近红外光谱可以通过不同物质对波长的吸收率不同测量出被测物体的成分组成[26],从而得出各成分的准确数据。微型热电偶RX分析仪是一种便携式的测量仪器,可以通过简单、低成本的样品制备操作和快速、非破坏性的测量过程,从而帮助监控样品的质量,得到精确的数据[27]。
在本研究中,基于水可以在1790~1940nm被检测到,近红外光谱区域选择在1 590~2 370 nm[17]。
微型热电偶RX分析仪需要首先在(25±1)℃的室温下进行校准,然后在对叶子进行热成像拍照之后,立刻分别测量其上部中心点、左下中心点和右下中心点的光谱值,从而求得平均值(图1)。

2.3 数据分析
热成像图片通过MatLab软件2014(Math-Works,MA)的定制代码进行分析,并保存在Excel表格中。这种半自动化的方法可以通过选择叶片面积,分析其颜色,得出相应温度数据,从而获得待测数值,算出CWSI和IG值。
近红外光谱图像和主成分分析图由近红外光谱分析仪测量出的数据经过Unscrambler软件(version X 10.1 CAMO,Oslo,Norway)分析处理完成。PCA用于选择主要的变量和分析样本及其特征之间的关系,从而建立出可能的关系模型[27]。应用偏最小二乘回归法(PLSR)可以建立出包含多个因变量和多个自变量的回归模型,尤其是在内部线性相关的情况下[28],最能反映出数据的可变性,同时预测数据的趋势。在本研究中,通过展示预测值和真实值的线性相关性和差异显著性水平,偏最小二乘回归法被用来构建和校准可以表达出水分流失和CWSI值、IG值之间关系的模型。
3 结果与分析
3.1 葡萄叶片失水分析
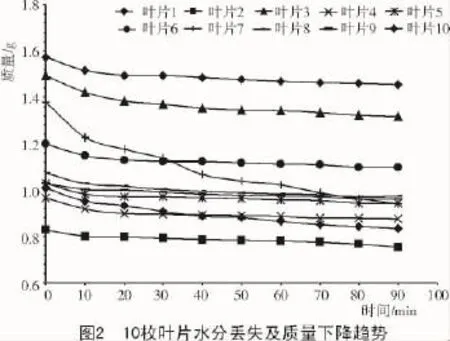
所有的叶子初始质量均在0.8~1.6 g之间,使用电子天平每隔10 min测量一次各叶片的质量,直到第90分钟时停止,质量显著下降(图2),换句话说,每片叶子均被测量10次。图2显示出所有叶片在第一个10 min的质量均显著减小,除叶片7外,大部分叶片的失水状态处于一个缓慢和稳定的下降趋势,所有叶片在最后一个10 min质量都没有显著变化。
3.2 热成像结果
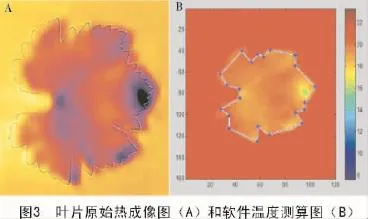
Matlab软件中的特殊代码可以将原始的热成像图转换成带有目标图像的温标,这样可以比较容易地区分出目标区域,然后可以自动地检测不同区域的温度与它们的SD值,用来确认是否在这些数据中有明显区别,以及这些叶片的平均输出温度(图3)。
参考温度(T干与T湿)与统计分析结果列于表1,与提供的公式(1)与公式(2)中的基本数据一起来计算叶片中CWSI和IG值。在这些叶片中的参考温度没有明显的区别,说明在相同叶片的不同部位温度基本相同,并且可以被认同为参考温度。
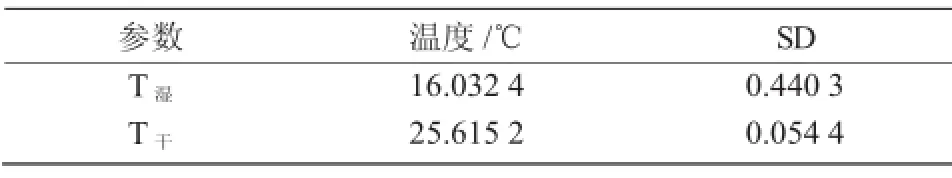
表1 参考温度数据
表2中的SD值表明叶片在不同时间段内的平均温度,显示在不同叶片中,相同时间段内的温度没有明显区别。另外,随着时间的增加,平均温度呈现出下降的趋势,从24.665 65℃降到19.188 67℃。
叶片的CWSI和IG值可以用参考温度T干,T湿和叶片温度T叶片计算出来。表3显示了CWSI和IG在不同时间段内的平均值。从表3可以看出,随着时间的增长,IG值呈增加趋势,而CWSI值呈减少趋势,其中,IG值由0.112 01升至2.389 94,CWSI值从0.900 91降到0.329 36。
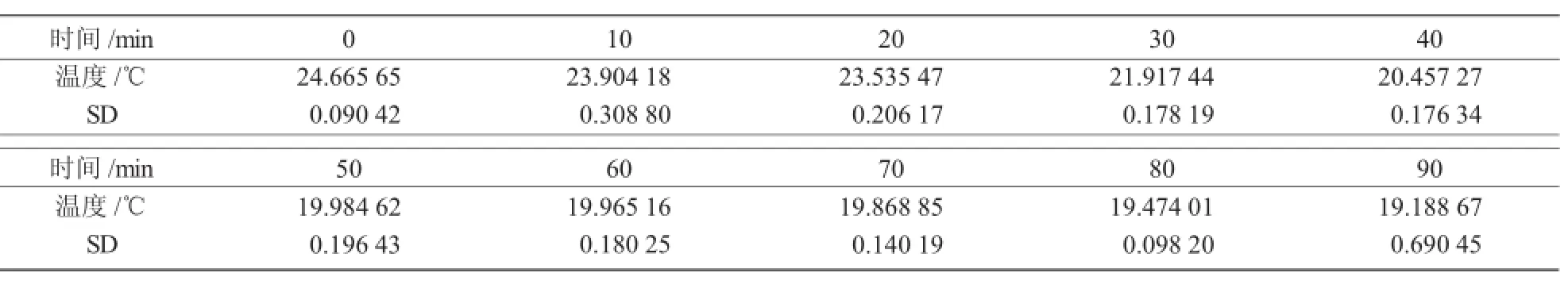
表2 不同时间叶片平均温度
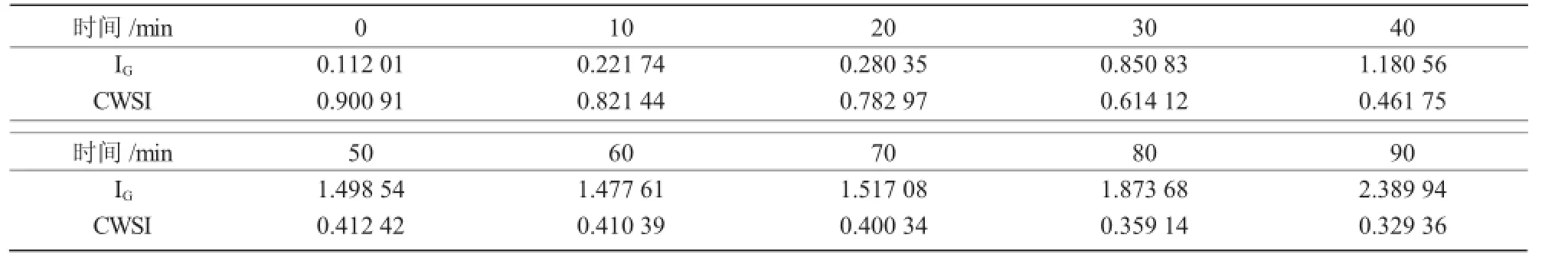
表3 叶片平均CWSI与IG值
3.3 近红外光谱结果
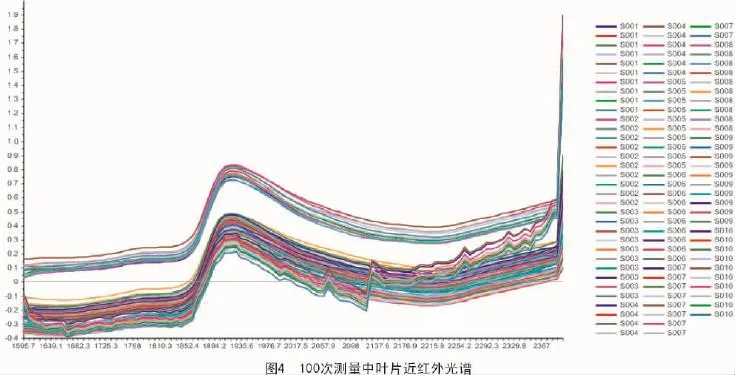
光谱连续性是建立回归模型最重要的因素[18]。图4展现了近红外光谱在光谱范围1 595.7~2 367 nm的100次测量结果,显示出了总体趋势在光谱曲线中几乎相同,基于光谱曲线所包含的相关信息可以分析出样品的相关成分。
不同的化合物有不同的吸收波长,用于确定不同类型的分子、原子或特定的原子基团,由于叶片包含大量复杂的化学成分,近红外光谱显示一个广泛的吸收波长。
波长和对应的化合物水分的典型波段1 790~1 940 nm在图4中也有显示。另外,最高特征波段大约为1 930 nm,很有可能由纤维素或者淀粉或者氢氧基团组成。同时发现,整个光带趋势有一个连续性的降低,光谱吸收量在延长时间和最后的时间段中为最小值。
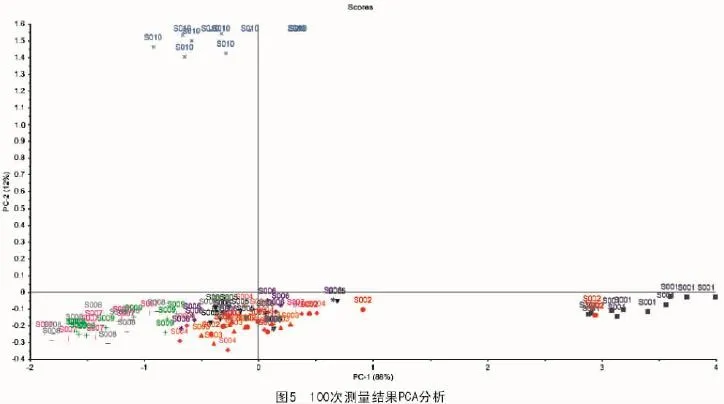
关于PCA,2个PC解释了100%的总方差(图5),第1种主要成分量占了所有变量的88%,第2种占了12%。这10组样品被大概分成3组,第1组为前10 min,第2组为后10 min,其余的为第3组。其中,第3组中,样品的颜色相同,说明他们在相同时间内集合在一起,少部分异常值除外。
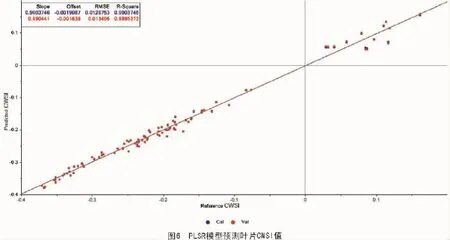
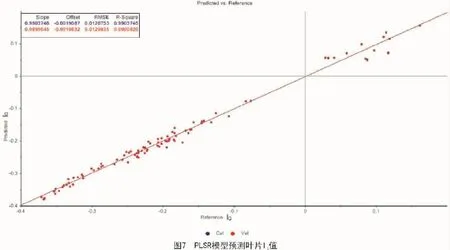
所有近红外光谱的原始数据在10个时间组中的波长介于1 595.7~2 367 nm,被用来建立和CWSI和IG值,相符的预测模型。然后去除模型线中的异常值,从而重新修正模型。图6和图7为修正的CWSI和IG值的PLSR模型。
图6中,蓝色的线(标记为Cal)是CWSI的理想预计线,红色线(标记为Val)是由没有异常值的数据建立的模型线。如果用公式来体现产出,理想模型PLSR模型是y=0.990 441。2个模型的R2都大于95%,同时2条模型线彼此非常接近。
相同的理想模型表示IG值在图7中,PLSR模型RMSE=0.012 983 5。同样,2个模型的R2都大于95%,同时2条模型线几乎彼此重叠。
3.4 水分流失与温度和水分状态在葡萄藤中的关系
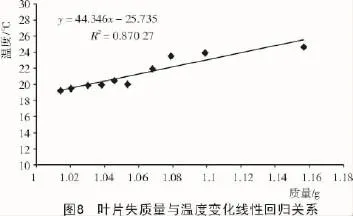
叶片质量的减少最主要是由蒸发和呼吸作用共同影响,后者所造成的质量流失在较短的时间段中可以被忽略[28]。由于叶片的蒸发作用会导致叶片表面温度下降,叶片失水和温度变化之间应该有一定关系[29]。图8显示了叶片失水和相应的叶片表面温度变化之间的图像关系。由图8可知,随着叶片中水分的流失,叶片表面温度在稳定下降,所以在一定范围内,叶片表面温度可以指示叶片中的水分状况。
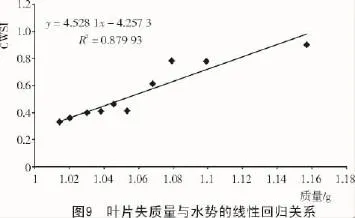
CWSI是样本温度与参考温度测定出的指数,通常被用来描述农作物中的水分状态。从图9可以看出,CWSI值与相应的葡萄藤叶片中的水分丢失在不同时间内相互对应。在草莓的试验中发现了GS值(气孔导度),也通常用来显示水分状态,与叶片温度和CWSI值呈负相关,也就是说彼此之间为正相关[29]。
4 讨论
4.1 近红外光谱和PCA分析
近红外光谱图显示,随着时间的延长,叶片中水分含量持续下降。说明样品叶片随着时间的流逝水分也在流失。
PCA在图5中显示了10个叶片在10个不同时间段内的相对位置,所有的样品在前10 min内被分为一组,显示了他们具有相同的特性,最后10 min也与其相同。至于中间的时间段内,所有的样品彼此接近,表明水分流失并没有明显的区别。对于每组来说,10个样品有着相似的相关位置,这显示它们的脱水速度相似。此外,近红外光谱显示了水分流失和时间之间的趋势。
4.2 CWSI和IG的PLSR模型分析
根据图6,7,CWSI和IG值有相同的理想模型,因为他们使用相同的原始温度数据。R2显示了趋势的拟合程度,值越高说明实际数据和估计数据越接近,同时说明趋势线越可靠。这2个数据中,R2都接近于99%(分别是98.953 73%和99.008 26%)。说明变量的实际值与预测值有极其相关的线性关系。同时,RMSE值仅仅是0.01,说明样品误差非常小,可以被忽略掉。总的来说,由于2个预测模型线都与理想模型线一致,2个预测模型都达到了令人满意的表现。因此,这些预测模型可以被用来估计葡萄藤叶片中水分状态。Diniz等[25]、Deng等[18]也在近红外光谱数据上建立了PLSR预测模型来预测茶叶叶片中的水分状态。
5 结论
作为2种间接和非破坏性的测量水分的方法,热成像和近红外光谱测量法在测量葡萄叶片水分中均有各自的优缺点。对于相同样品的测量,热成像和近红外光谱法都表现出良好的精确测量结果,并可以联合通过构建PLSR模型显示出CWSI和IG真实值和预测值之间良好的线性关系。表明热成像和近红外光谱法结合是一种可靠的可以用来检测葡萄植株水分状态的方法。
[1]Lloret J,Bosch I,Sendra S,et al.A Wireless sensor network for vineyard monitoring that uses image processing[J].Sensors,2011,11:6165-6196.
[2]Mayr C,Geue J,Holt H,et al.Characterization of the key aroma compounds in Shiraz wine by quantitation,aroma reconstitution,and omission studies[J].Journal of Agricultural and Food Chemistry,2014,62:4528-4536.
[3]Kizildeniza T,Meknia I,Santestebana H,et al.Effects of climate change including elevated CO2concentration,temperature and water deficit on growth,water status,and yield quality of grapevine(Vitis vinifera L.)cultivar[J].Agricultural Water Management,2015,159:155-164.
[4]Merli MC,Gatti M,Galbignani M,et al.Comparison of whole-canopy water use efficiency and vine performance of cv.Sangiovese(Vitis vinifera L.)vines subjected toa post-veraison water deficit[J].Scientia Horticulturae,2015,185:113-120.
[5]Fuentes S,Echeverria C P,Lobos G,et al.Size does not matter for infrared water status assessment:Newly-developed infrared scanners could offer comparable results against high-resolution thermal cameras[J].Wine and Viticulture Journal,2014,29(3):45-51.
[6]Leeuwen C V,Tregoat O,Choné X,et al.Vine water status is a key factor in grape ripening and vintage quality for red bordeaux wine. Howcan it be assessed for vineyard management purposes?[J].Journal International des Sciences de la Vigne et du Vin,2009(3):121-134.
[7]Williams L E,Phene C J,Grimes D W,et al.Midday measurements of leaf water potential and stomatal conductance are highly correlated with daily water use of Thompson Seedless grapevines[J].Irrigation Science,2012,30:201-212.
[8]Johnson R S,Williams L E,Ayars J E,et al.Weighing lysimeters aid study of water relations in tree and vine crops[J].California Agriculture,2005,59(2):133-136.
[9]Bellvert J,Marsal J,Girona J,et al.Seasonal evolution of crop water stress index in grapevine varieties determined with high resolution remote sensing thermal imagery[J].Irrigation Science,2015,33:81-93.
[10]Yin Z,Lei T,Yan Q,et al.A near-infrared reflectance sensor for soil surface moisture measurement[J].Computers and Electronics in Agriculture,2013,99:101-107.
[11]Cohen Y,Alchanatis V,Sela E,et al.Crop water status estimation using thermography:multi-year model development using ground based thermal images[J].Precision Agriculture,2015,16:311-329.
[12]Alchanatis V,Cohen S,Moller M,et al.Evaluation of different approaches for estimating and mapping crop water status in cotton with thermal imaging[J].Precision Agriculture,2010,11:27-41.
[13]Taghvaeian S,Chávez J L,Altenhofen J,et al.Remote sensing for evaluating crop water stress at field scale using infrared thermography:potential and limitations[J].Hydrology Days,2013,4:74-83.
[14]Taghvaeian S,Comasb L,DeJongeb K C,et al.Conventional and simplified canopy temperature indices predict water stress in sunflower[J].Agricultural Water Management,2014,144:69-80.
[15]Pou A,Diago MP,Medrano H,et al.Validation of thermal indices for water status identification in grapevine[J].Agricultural Water Management,2014,134:60-72.
[16]Handcock R N,Torgersen C E,Cherkauer K A,et al.Thermal infrared remote sensing of water temperature in riverine landscapes [J].Fluvial Remote Sensing for Science and Management,2012,12:85-113.
[17]Ciurczak E W,Burns D A.Handbook of near-infrared analysis[M]. Third Edition.Florida,USA:CRC Press,2007:357.
[18]Deng S,Xu Y,Li X,et al.Moisture content prediction in tealeaf with near infrared hyperspectral imaging[J].Computers and Electronics in Agriculture,2015,118:38-46.
[19]Chen S,Zhang F,Ning J,et al.Predicting the anthocyanin content of wine grapes by NIR hyperspectral imaging[J].Food Chemistry,2015,172:788-793.
[20]Zhang X,Liu F,He Y,et al.Detecting macronutrients content and distribution in oilseed rape leaves based on hyperspectral imaging [J].Biosystems Engineering,2013,115:56-65.
[21]Manley M.Near-infrared spectroscopy and hyperspectral imaging: non-destructive analysis of biological materials[J].Chemical Society Reviews,2014,43:8200-8214.
[22]Reinert S,Bögelein R,Thomas F M.Use of thermal imaging to determine leaf conductance along a canopy gradient in European beech(Fagus sylvatica)[J].Tree Physiology,2012,32:294-302.
[23]Id so S B.Non-water-stressed baselines:a key to measuring and interpreting plant water stress[J].Agriculture Meteorology,1982,27(1/2):59-70.
[24]Jones H G.Use of infrared thermometry for estimation of stomata conductance as a possible aid to irrigation scheduling[J].Agriculture Forest Meteorology,1999,95:139-149.
[25]Diniz P H G D,Pistonesi M F,Araujo M C U.Using iSPA-PLS and NIR spectroscopy for the determination of total polyphenols and moisture in commercial tea samples[J].Analytical Methods,2015,7:3379-3384.
[26]Abdi H.Partial least squares regression and projection on latent structure regression(PLS regression)[J].Wiley Interdisciplinary Reviews:Computational Statistics,2010,2:97-106.
[27]Catoni R,Gratani L.Variations in leaf respiration and photosynthesis ratioin response toair temperature and water availability among Mediterranean evergreen species[J].Journal of Arid Environments,2014,102:82-88.
[28]Holbrook N M,Sinclair T R.Water balance in the arbores cent palm,Sabal palmetto.II.Transpiration and stem water storage[J]. Plant,Cell and Environment,1992,15:401-409.
[29]Grant O M,Davies MJ.Thermal imaging and carbon isotope composition indicate variation amongst strawberry(Fragaria×ananassa)cultivars in stomatal conductance and water use efficiency[J]. Environmental and Experimental Botany,2012,76:7-15.
Combination of Thermal Imaging and NIR Spectroscopy Technology to Test Water Content in Shiraz Leaves
LI Guangjun
(College of Agriculture and Animal Medicine,Melbourne University,Melbourne 300457,Australia)
Shiraz is one of the ancient and high quality wine grape varieties,improving its cultivation technologies and the methods are more and more important in current wine making industry.Grapevine water content measuring and control plays a significant role in its cultivation and harvest.Therefore,looking for a quick,easy and non-destructive measurement is very important.To explore the relations between grapevine water content and CWSI by thermal technology and NIR,this paper uses thermal imaging and near-infrared spectroscopy combination to test the leaf water content and temperature,and finding out their corresponding relation.The results show that the combination of thermal imaging technology and near-infrared spectroscopy can be used tome a sure the water content of grapevine leaf to come up to CWSI and IG,and show an obvious linear relation between them.Thermal imaging technology combined with near infrared spectroscopy can be used for more accurate measurements of leaf water content,and be quick and non-destructive at the same time.
thermal imaging technology;NIR;water loss;temperature change;CWSI
O657.7+8;O657.33
A
1002-2481(2016)10-1467-09
10.3969/j.issn.1002-2481.2016.10.11
2016-06-08
李光君(1991-),女,山西太原人,在读硕士,研究方向:葡萄酒感观评价。

