洋葱S-腺苷甲硫氨酸合成酶基因的克隆及分析
王 晶,刘恩科,王永勤
(1.吕梁学院生命科学系,山西吕梁033001;2.山西省农业科学院旱地农业研究中心,山西太原030031;3.北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,北京100097)
洋葱S-腺苷甲硫氨酸合成酶基因的克隆及分析
王 晶1,刘恩科2,王永勤3
(1.吕梁学院生命科学系,山西吕梁033001;2.山西省农业科学院旱地农业研究中心,山西太原030031;3.北京市农林科学院蔬菜研究中心,农业部华北地区园艺作物生物学与种质创制重点实验室,北京100097)
根据洋葱转录组测序结果设计了S-腺苷甲硫氨酸合成酶基因(AcSAMS)引物,利用RT-PCR技术和RACE技术克隆了洋葱S-腺苷甲硫氨酸合成酶基因的cDNA全长,命名为AcSAMS。该cDNA全长1 475 bp,ORF为1 191 bp,编码396个氨基酸的多肽。生物信息学分析表明,AcSAMS氨基酸序列与紫萼同源性为95%,与短花药野生稻为94%,与桔梗和粳稻为93%。系统发育树结果显示,AcSAMS与唐菖莆SAMS的亲缘关系最近。该基因的克隆可为进一步研究AcSAMS在抗旱、抗冻、耐盐等抗逆过程中的作用机理提供理论依据,为开展抗逆基因工程奠定基础。
洋葱;S-腺苷甲硫氨酸合成酶基因;克隆;分析
S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthetase,SAMS,EC:2.5.1.6)是生物体内S-腺苷甲硫氨酸代谢途径中的关键酶,它催化三磷酸腺苷(ATP)和L-甲硫氨酸(Met)反应合成S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)[1],也是目前已知的生物体内合成SAM的唯一途径。SAM是广泛存在于生物中的一种生理活性分子,也是S-腺苷甲硫氨酸代谢途径关键的中间产物,参与转甲基、转硫、转氨丙基等反应[2-4]。SAM作为主要的甲基供体,在大多数甲基化反应中起着核心作用,如核酸、蛋白质、脂类和多糖的甲基化[5]。它参与多种不同的代谢过程,其中主要有合成多胺(精胺、亚精胺和腐胺等)、乙烯及谷胱甘肽[6]。此外,SAM还可与RNA结合参与体内基因表达的调控[6-7]。因此,研究SAMS基因功能对植物具有重要的意义。
目前,多种植物中SAMS的cDNA已被克隆出来,如拟南芥[7-8]、小麦[9]、杨树[10]、石蒜[11]、芜菁[12]、松树[13]、大白菜[14]、芥菜[15-16]和杜梨[17],但是未见洋葱SAMS基因的报道。由于SAMS的重要生物学功能,存在多种类型的SAMS基因,它由一个多基因家族所编码,共同调节着SAM的合成速率。因此,克隆不同物种的SAMS基因具有重要的意义。
洋葱(Allium cepa L.)为葱科(Liliaceae)葱属(Allium)2年生草本蔬菜作物,是重要的世界性蔬菜,也是我国主要栽培和出口蔬菜品种,具有较强的抗冻、抗旱能力。本研究拟以洋葱为材料,克隆SAMS基因,并对其序列特征进行分析,旨在为研究AcSAMS在洋葱抗旱和耐冻过程中的作用机理提供理论依据,为开展洋葱抗性分子育种奠定基础。
1 材料和方法
1.1 材料
以红皮洋葱叶片为材料提取RNA。
根据洋葱转录组测序获得的SAMS基因的中间片段序列,设计了RACE引物。本研究所需引物如表1所示。

表1 引物及序列
1.2 总RNA提取及第1链cDNA合成
用多糖多酚植物RNA提取试剂盒(北京华越洋生物科技有限公司)提取洋葱叶片总RNA。提取总RNA的操作步骤按照试剂盒的说明书进行。
利用B26作为引物,以3 μg总RNA作为模板,合成cDNA第1链。第1链cDNA合成的反应体系及具体操作步骤参照PrimeScript II 1stStrand cDNA Synthesis Kit(TaKaRa)说明书进行。
1.3 RACE
1.3.1 利用3′-RACE技术扩增AcSAMS基因3′端序列 以合成的第1链cDNA为模板,利用C1与B26引物进行PCR扩增3′末端序列。PCR反应程序为:95℃预变性2 min;94℃40 s,55℃30 s,72℃2 min,共35个循环;72℃延伸7 min;4℃保存备用。
1.3.2 利用5′-RACE技术扩增AcSAMS基因5′端序列 其参照李洪有等[18]的方法,略有改进。
TdT加Poly(C)尾反应:在加入加尾反应试剂前,将纯化好的20 μLcDNA在94℃下变性6 min,之后再在冰上冷却1 min,按照如下体系加入反应试剂:5×TdT Buffer(10 μL),0.1%BSA(5 μL),100 mmol/L dCTP(0.8 μL),TdT(15 U)和ddH2O(补至总体积50 μL),置于PCR仪中37℃1 h,65℃10 min进行加尾反应。
PCR扩增:采用巢式PCR策略,进行2轮PCR扩增。第1轮扩增以加尾的cDNA为模板,以引物AP和基因特异引物C2为上下游引物。PCR反应程序:95℃预变性2 min;94℃30 s,62~54℃30 s(62~54℃每次降2℃,其中,54℃前每个温度2个循环,最后54℃27个循环),72℃1 min,共35个循环;72℃10 min;4℃保存备用。第2轮PCR反应以第1轮PCR扩增产物为模板,以巢式引物NP和基因特异引物C2为上下游引物。PCR扩增程序为:95℃预变性1 min;94℃30 s,60℃30 s,72℃1 min,35个循环;72℃延伸10 min;4℃保存备用。
PCR产物经琼脂糖凝胶电泳,用琼脂糖凝胶回收试剂盒(天根生化科技(北京)有限公司)回收目的条带。回收的产物连接到 pEASY-T1载体(TransGen Biotech公司)上,转化大肠杆菌DH5α,蓝白斑筛选,挑白斑摇菌过夜培养。经检测为阳性菌株送北京三博生物技术公司进行测序。
1.4 序列分析及其系统进化树的构建
将一步RT-PCR及RACE获得的cDNA序列利用DNAMAN软件进行拼接,得到目的基因的全长cDNA序列。将该基因推测的氨基酸序列和来自NCBI数据库中其他物种的同源序列进行多序列比对和系统发育分析。蛋白序列比对用Clustalx2.0软件进行。系统发育树用MEGA5.0软件中的邻近相连法进行构建,并进行Bootstrap检测。
2 结果与分析
2.1 基因克隆及序列分析

采用一步RT-PCR扩增获得一条386 bp的3′端目的片段(图1-A),测序结果表明,该片段长度约为400 bp。利用TdT加尾5′-RACE方法,PCR扩增后得到一个约为540 bp的5′端目的片段(图1-B)。利用软件DNAMAN将3条序列进行比对去除重叠部分并进行拼接,得到长度为1 475 bp的基因全长cDNA序列,命名为AcSAMS。
对AcSAMS全长序列进行分析,结果显示,该基因全长cDNA序列包含1个80 bp的5′非编码区;1个1 191 bp完整的开放阅读框(ORF),编码396个氨基酸,推测蛋白分子量为43.13 kD,等电点为5.568;1个204 bp的3′非编码区,该非编码区含有植物mRNA典型的Poly(A)尾序列(图2)。

2.2 氨基酸序列比对及其系统发育分析
AcSAMS基因编码396个氨基酸残基,其中,碱性(+)氨基酸(K,R)42个、酸性(-)氨基酸(D,E)54个、疏水氨基酸(A,I,L,F,W,V)133个、极性氨基酸89个。对AcSAMS基因编码蛋白序列进行二级结构预测,其中,26.52%的氨基酸残基构成α-螺旋(alpha helix),14.39%的氨基酸残基构成β-折叠(beta sheet),59.09%的氨基酸残基构成随机卷曲(randomcoil)。
将AcSAMS基因推测的氨基酸序列在NCBI数据库中执行BLASTx比对检索,结果发现,该氨基酸序列与紫萼同源性为95%;与短花药野生稻为94%;与桔梗和粳稻为93%。将洋葱AcSAMS的氨基酸序列与其他来源于不同物种的SAMS氨基酸序列进行多序列比对发现,AcSAMS包含SAMS的特征序列,分别为GHPDK(第17~21位氨基酸残基)、GAGDQGhmfGY(第122~132位氨基酸残基)和GGGAFSgKD(第269~277位氨基酸残基)。
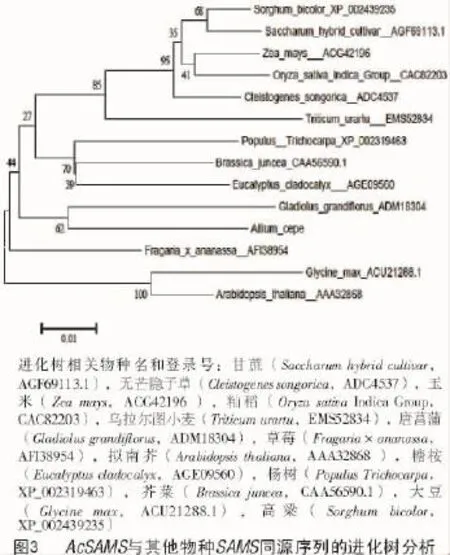
为了进一步研究洋葱种子AcSAMS基因与其他物种SAMS基因之间的关系,用MEGA 5.0软件采用邻近相连法构建了AcSAMS的系统进化树(图3)。系统进化树分析结果显示,洋葱AcSAMS基因与唐菖莆的SAMS聚在一起,表明它们的亲缘关系最近。
3 讨论
腺苷甲硫氨酸,在动植物体内广泛存在,具有重要的生理生化作用。它参与渗透调节物质多胺的形成,对植物抗逆性具有重要作用。大量数据表明,SAMS基因受干旱和盐胁迫的诱导表达,例如糜子[19]的SAMS基因受干旱胁迫的诱导表达,盐地碱蓬[20]、大洋洲滨藜[21]、烟草[22]、陆地棉[23]等的SAMS基因受盐胁迫的诱导表达。蝴蝶兰SAMS基因参与了蝴蝶兰低温胁迫的分子调控[24];SAMS基因在甘蔗抗寒、抗旱、抗盐和抗氧化等胁迫过程中也起某种作用[25]。将盐地碱蓬的SsAMS2转化烟草,转基因植株中多聚胺含量显著高于未转基因烟草,且其耐盐性也比未转基因烟草提高[26-27]。在洋葱的抗旱和耐盐过程中,AcSAMS基因的组织表达模式和作用方式都有待进一步研究。
[1]张建国,李新华,袁中一.腺苷甲硫氨酸合成酶的基因及结构研究进展[J].工业微生物,2005,35(3):39-44.
[2]MatoJ,AlvarezL,Ortiz Pajares MA.S-adenosylmethionine synthesis:molecular mechanisms and clinical implications[J].Pharmacol Therapeutics,1997,73:265-280.
[3]Fontecave M,Atta M,Mulliez E.S-adenosylmethionine:nothing goes to waste[J].Trends BiochemSci,2004,29:243-249.
[4]Belbahri L,Chevalier L,Bensaddek L,et al.Different expression of an S-adenosylmethionine synthetase gene in transgenic tobacco callus modifies alkaloid biosynthesis[J].Biotechnology Bioengineering,2000,69:11-20.
[5]易乐飞,王萍,周向红,等.条斑紫菜SAMS基因克隆与生物信息学分析[J].中国生物工程杂志,2009,29(7):43-49.
[6]柴兴苹,张玉秀,谭金娟,等.Zn胁迫下小麦腺苷甲硫氨酸代谢途径关键基因表达模式分析 [J].植物生理学报,2013,49:375-384.
[7]Peleman J,Saito K,Cottyn B,et al.Structure and expression analyses of the S-adenosylmethionine synthetase gene family in Arabidopsis thaliana[J].Gene,1989,84:359-369.
[8]Sedira M,Butler E,Gallagher T,et al.Verification of auxin-induced gene expression during adventitious rooting in rol B-transformed and untransformed apple Jork[J].Plant Sci,2005,168:1193-1198.
[9] Sodabeh J G,Zahra S,Elnaz R N.Analysis of bioinformatical S-adenosylmethionine synthetase and cold-regulated(COR)proteins in wheat under cold stress[J].J Inform Technol,2013(1):12-19.
[10]Van Doorsselaere J,Gielen J,Van Montagu M,et al.A cDNA encoding S-adenosyl-L-methionine synthetase from poplar[J].Plant Physiol,1993,102:1365.
[11]Li X D,Xia B,Wang R,et al.Molecular cloning and characterization of S-adenosylmethionine synthetase gene from Lycoris radiata [J].Mol Biol Rep,2013,40:1255-1263.
[12]Kim S B,Yu J G,Lee G H,et al.Characterization of Brassica rapa S-adenosyl-L-methionine synthetase gene including its roles in biosynthesis pathway[J].Hortic Environ Biote,2012,53:57-65.
[13]Lindroth AM,Saarikoski P,Flygh G,et al.Two S-adenosylmethionine synthetase-encodinggenes differentially expressed during adventitious root development in Pinus contorta[J].Plant Mol Biol,2001,46:335-346.
[14]Yu J G,Lee G H,Park Y D.Physiological role of endogenous S-adenosyl-L-methionine synthetase in Chinese cabbage[J].Hortic Environ Biote,2012,53:247-255.
[15]Lim C C,Liu J Z,Pua E C.Characterization of S-adenosylmethionine synthetase genes and its expression is associated with ethylene synthesis in mustard(Brassica juncea)[J].Physiol Plantarum,2002,116:522-530.
[16]Mo H,Pua E C.Up-regulation of arginine decarboxylase gene expression and accumulation of polyamines in mustard(Brassica juncea)in response to stress[J].Physiol Plantarum,2002,114:439-449.
[17]张梅,王然,马春晖,等.杜梨S-腺苷甲硫氨酸脱羧酶基因的克隆与生物信息学分析[J].华北农学报,2013,28(1):82-87.
[18]李洪有,王婵,李丽林,等.洋葱花器官B类MADS-box基因AcPI的克隆及表达分析 [J].中国农业科学,2012,45(23):4759-4769.
[19]林凡云,王士强,胡银岗,等.糜子SAMS基因的克隆及其在干旱复水中的表达模式分析 [J].作物学报,2008,34(5):777-782.
[20]Ma X,Wang Z,Qi Y,et al.Isolation of S-adenosylmethionine synthetase gene from Suaeda salsa and its diferential expression under NaCl stress[J].Acta Botanica Sinica,2003,45(11):1359-1365.
[21]Schrfder G,Eichel J,Breinig S,et al.Three differentially expressed S-adenosylmethionine synthetases from Catharanthus roseus:molecular and functional characterization[J].Plant Molecular Biology,1997,33(2):211-222.
[22]Tabuchi T,Kawaguehi Y,Azuma T,et al.Similar regulation patterns of choline monooxygenase,phosphoethanolamine N-methyltransferase and S-adenosyl-l-methionine synthetase in leaves of the halophyte Atriplex nummularia L[J].Plant and Cell Physiology,2005,46(3):505-513.
[23]周凯,宋丽艳,叶武威,等.陆地棉耐盐相关基因GhSAMS的克隆及表达[J].作物学报,2011,37(6):1012-1019.
[24]袁秀云,雷志华,梁芳,等.蝴蝶兰S-腺苷甲硫氨酸合成酶基因的克隆及低温下的表达分析 [J].植物生理学报,2015(5):754-762.
[25]宋修鹏,张保青,黄杏,等.甘蔗S-腺苷甲硫氨酸合成酶基因(ScSAM)的克隆及表达[J].作物学报,2014,40(6):1002-1010.
[26]戚元成,马雷,王菲菲,等.过量表达腺苷甲硫氨酸合成酶基因能提高转基因烟草中多聚胺的生物合成[J].植物生理学通讯,2009,45(8):791-793.
[27]戚元成,王菲菲.盐胁迫下过量表达腺苷甲硫氨酸合成酶基因的转基因烟草的生长 [J].植物生理学通讯,2010,46(2):150-152.
Molecular Cloning and Bioinformatic Analysis of S-adenosylmethionine Synthetase Gene from Allium cepa
WANG Jing1,LIU En-ke2,WANG Yong-qin3
(1.Department of Life Sciences,Lyuliang University,Lyuliang033001,China;2.Research Center of Arid Farming,Shanxi Academy of Agricultural Sciences,Taiyuan 030031,China;3.Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(North China),Ministry of Agriculture,Beijing Vegetable Research Center,Beijing Academy of Agriculture and Forestry Sciences,Beijing100097,China)
Primers of S-adenosylmethionine synthetase gene were designed based on the result of onion transcriptome sequencing, and full-length cDNA of S-adenosylmethionine synthetase gene in onion was cloned using RT-PCR combined with RACE technology, named AcSAMS.The total length ofcDNA was 1 475 bp and its ORF encoding a polypeptide of396 amino-acid residues was 1 191 bp. Bioinformatics analysis showed that the homology between the amino acid sequence of AcSAMS and grimmia was 95%,and the short anthers of wild rice was 94%,and the japonica and platycodon grandiflorum were 93%,respectively.The dendrogram result indicated that the closest genetic relationship existed in AcSAMS and SAMS Gladiolus grandiflorus.The cloning of the gene lays a foundation for further research on the functional mechanism of AcSAMS in the process of drought resistance and salt tolerance and the development of genetic improvement.
onion;AcSAMS;cloning;analysis
S633.2
A
1002-2481(2016)05-0575-04
10.3969/j.issn.1002-2481.2016.05.02
2016-03-17
国家自然科学基金项目(31372066);北京市农林科学院科技创新能力建设专项(KJCX201101010)
王 晶(1993-),女,山西兴县人,在校学生,研究方向:分子生物学。刘恩科、王永勤为通信作者。

