植物内生菌透射电镜负染标本制备方法的对比研究
黄远洁,李卫东,莫肖敏
(广西医科大学医学科学实验中心电镜室,广西南宁530021)
植物内生菌透射电镜负染标本制备方法的对比研究
黄远洁,李卫东,莫肖敏
(广西医科大学医学科学实验中心电镜室,广西南宁530021)
通过比较4种不同方法处理的植物内生菌负染标本的透射电镜检测结果,探讨植物内生菌透射电镜负染标本的理想制备方法。采用直接刮取法、双蒸水冲洗法、双蒸水冲洗离心重悬法和双蒸水冲洗静置法制备菌悬液,应用10 g/L磷钨酸漂浮法负染,透射电子显微镜检测,根据菌的形态特征及菌毛、鞭毛形状数量等指标判断取材及处理方法的各自优缺点。结果显示:直接刮取法的样品原始状态保存较好,但杂质多,背景重;双蒸水冲洗的样品背景较干净;双蒸水冲洗离心重悬法和双蒸水冲洗静置法的样品视野清晰、分布均匀,背景干净、杂质少,但前者菌的形态结构较易受影响。可见,透射电镜是植物内生菌检测的重要工具,需根据实际情况选用样品制备方法。在严格控制静置时长的前提下,双蒸水冲洗静置法制备菌悬液后应用负染技术可获得较理想的检测效果。
植物内生菌;透射电镜;负染
100多年前人们就已发现在健康植物组织的内部存在微生物,1866年德国科学家De Bary提出了“内生菌”(Endophyte)一词。1992年美国科学家Kloepper第一次提出了“植物内生菌”的概念,即是指那些在其生活史的一定阶段或全部阶段生活于健康高等木本、草本植物,单子叶植物和双子叶植物各种组织和器官内部的真菌或细菌,主要包括内生真菌(Endophytic fungi)、内生细菌(Endophytic bacteria)和内生放线菌(Endophytic actinomyces)三大类。
近年来,植物内生菌作为一种新的微生物资源受到了广泛的关注,越来越多的研究发现植物内生菌能增强宿主抵御病害的能力,还可以分泌抗生素、毒素等代谢物质诱导植物产生系统抗性(Induced Systemic Resistance,ISR),起到生物防治效果,此外,其代谢产物有抗肿瘤、抗菌、抗病毒等作用。从内生菌中寻找和发现新的活性化合物已成为国内外研究的又一热点[1],具有良好的应用前景。广西植物资源丰富,是植物内生菌研究领域的宝贵资源库,充分利用各种研究工具推动和促进植物内生菌的研究对广西的科研及经济发展具有十分重要的意义。
透射电子显微镜(Transmission electron microscope,TEM)简称透射电镜,能直观、准确地检测动植物组织细胞的超微结构改变[2-3],是医学生物学研究的重要工具。其中,利用重金属盐溶液如磷钨酸、醋酸双氧铀等进行负染色反衬出透亮的样品,在电镜下可快速完成样品的检测,是研究植物内生菌的重要手段。本实验室采用4种方法分别进行植物内生菌的电镜负染标本制备,对染色结果进行综合对比分析,总结4种方法的优缺点及注意事项,以期在今后的植物内生菌检测工作中获得满意的电镜检测结果。
1 材料与方法
1.1 材料
植物内生芽孢杆菌和假单胞菌(广西农业科学院微生物研究所岑贞陆副研究员惠赠),外径3 mm,孔径80 μm铜网(ZB-AZH200,北京中兴百瑞技术有限公司),10 g/L磷钨酸染液(美国SPI公司)。
1.2 仪器
日立H-7650型透射电镜(日本日立公司)。
1.3 方法
按以下4种方法分别制备菌悬液后,立即吸取约20 μL菌液滴于蜡板上,用镊子夹取外径3 mm,孔径80 μm铜网,支持膜面覆扣于菌液滴上2 min,用滤纸从铜网边缘吸去多余液体,滴加约20 μL 10 g/L磷钨酸染液于蜡板上,将铜网带菌样品面朝下覆扣于染液滴上各染色5~120 s,用滤纸吸去染液,自然晾干后进行电镜检测采图。
1.3.1 直接刮取法:高压灭菌的竹签轻轻刮取培养皿中琼脂上的单菌落,放入装有双蒸水的5 mL离心管中,用一次性吸管轻柔吹打混悬菌液备用。
1.3.2 双蒸水冲洗法:用一次性吸管吸取双蒸水,缓缓冲洗培养皿中琼脂上的单菌落至5 mL离心管中,轻柔吹打混悬菌液备用。
1.3.3 双蒸水冲洗离心重悬法:用一次性吸管吸取双蒸水,缓缓冲洗培养皿中琼脂上的单菌落至5 mL离心管中,轻柔吹打后1 000 r/min离心5 min,弃上清后加入双蒸水重悬菌液备用。
1.3.4 双蒸水冲洗静置法:用一次性吸管吸取双蒸水,缓缓冲洗培养皿中琼脂上的单菌落至5 mL离心管中,静置5 min后,吸取上清菌液备用。
2 结果及分析
在取材和制备菌悬液样品方面,4种电镜负染标本制备方法各有优劣,详见表1。而在负染方面,染色时间也十分关键,染色时间为2 min的样品菌体着色较重,鞭毛着生部位及菌膜结构较难辨别(图1E、F),而染色时间为10 s的样品着色效果较理想,菌体表面结构清楚,鞭毛清晰可辨(图1G、H)。
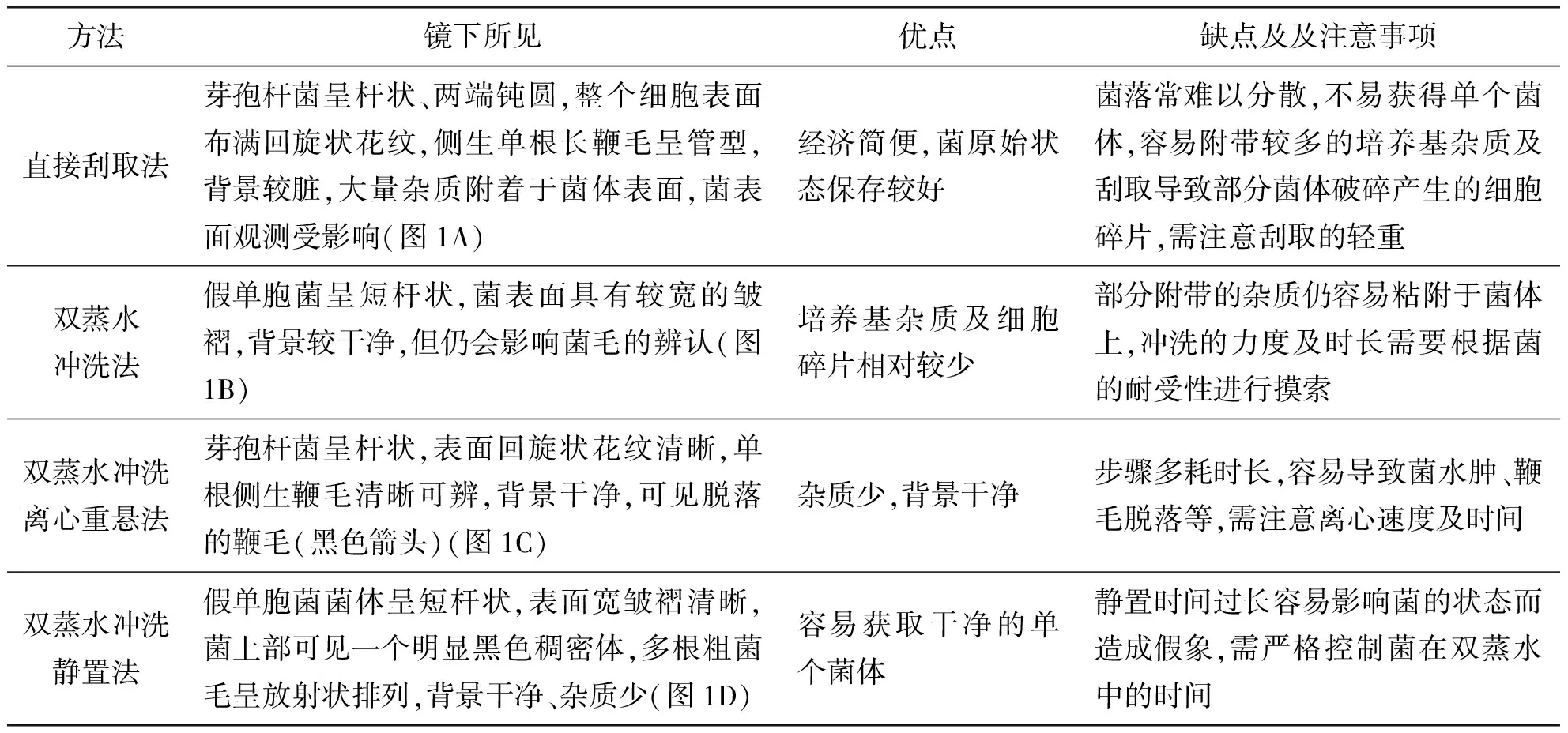
表1 4种透射电镜负染样品制备方法比较
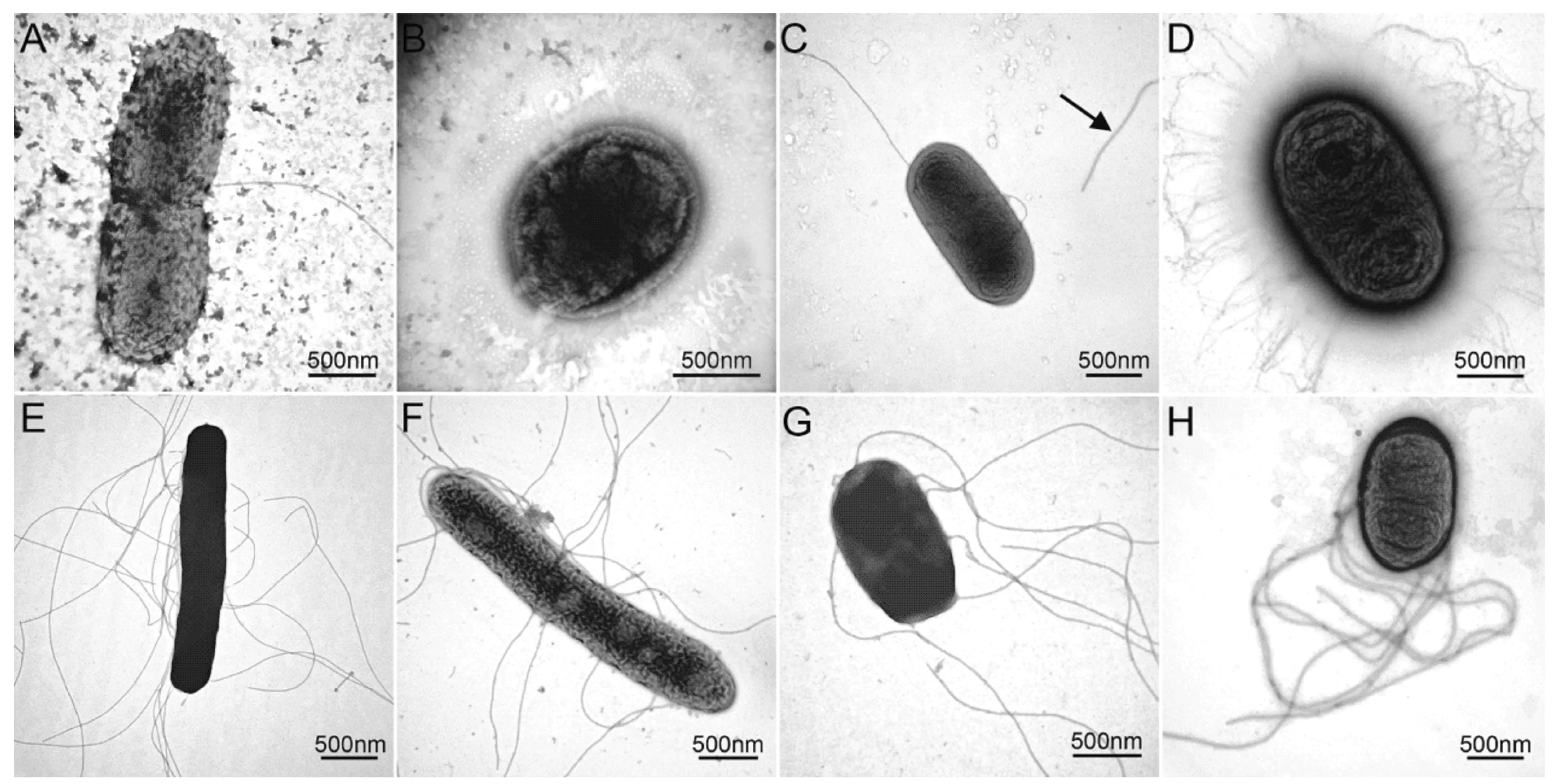
A.直接刮取法样品;B.双蒸水冲洗法样品;C.蒸水冲洗离心重悬法样品;D.双蒸水冲洗静置法样品;E.染色时间2 min的芽孢杆菌;F.染色时间10 s的芽孢杆菌;G染色时间2 min的假单胞菌;H.染色时间10 s的假单胞菌图1 H-7650透射电镜下4种方法样品制备的结果Fig.1 Results of the samples prepared by 4 kinds of methods under H-7650
3 讨论
截至2010年,在各种农作物及经济作物中发现的植物内生细菌已超过129种,分属于54个属,主要为假单胞菌属Pseudomonas、肠杆菌属Enterobacter、芽孢杆菌属Bacillus、土壤杆菌属Agrobacterium、克雷伯氏菌属Klebsiella、泛菌属Pantoea、甲基杆菌属Methylobacterium等。内生真菌主要为子囊菌类Ascomycet及其无性型,包括核菌纲Pyrenomyetes、盘菌纲Discomyetes和腔菌纲Loculoascomyetes等。内生放线菌主要为链霉菌属Streptomyces、链轮丝菌属Streptoverticillum、游动放线菌属Antinoplanes、诺卡氏菌属Nocardia、小单孢菌属Micromonospora等。随着各研究领域对植物内生菌的深入研究,植物内生菌在农业生产[4]、医药研究应用[5]、生物防治[6]、环境改造[7]等方面将大放异彩。透射电镜作为植物内生菌鉴别研究的重要工具,能通过负染技术快速对内生菌进行检测鉴别,成为科研工作者内生菌形态学研究的首选。
本实验室对4种常用内生菌电镜负染标本制备方法进行了比较总结。其中,直接刮取法的步骤简单,在刮取适当的情况下可较好地保持菌的原始状态,故在需要重点观察菌落整体情况和菌落中的菌与菌之间的表面情况时可选用该法进行快速初步的观测。部分对冲洗、离心等外界施加因素敏感的菌采用此法也能减少人工假象。双蒸水冲洗法相对简便,能减少直接刮取法所导致的培养基杂质和细胞碎片附着于菌体的情况,改善采图效果。双蒸水冲洗离心重悬法需要针对菌的耐受性进行离心速度和时间的摸索,制样成本增加且耗时较长,但样品背景干净,视野清晰,故对冲洗及离心耐受性较好的菌采用此法效果较佳。双蒸水冲洗静置法其优势在于双蒸水冲洗下来的菌体短暂静置后,单个菌体能浮动至上清液中,不需离心重悬即可获得干净的单个菌体,在严格控制菌静置时间的前提下对菌的影响相对较小,是理想的样品制备方法。此外,除了染色的时间长短,负染的时机对样品最后的成像也十分重要,覆扣于菌液的铜网用滤纸吸去多余的菌液后,需等到肉眼看不到残留的液体时再覆扣于染液上进行染色,否则样品完全干了之后染色会出现大片颗粒性团块附着影响观测,而在肉眼可见菌液水珠时进行染色,则会出现边缘效应影响染色结果。
综上所述,透射电镜是植物内生菌检测的重要工具,根据实际情况选用不同的负染标本制备方法,能大大提高标本制备的成功率。在严格控制菌静置时间的前提下,双蒸水冲洗静置法是较理想的样品制备方法。
[1] SHEHATA H R, LYONS E M, JORDAN K S, et al.Relevance of in vitro agar based screens to characterize the anti-fungal activities of bacterialendophyte communities[J].BMC Microbiol,2016,16(1):8.
[2] 宋西娇,陈浙,何步远,等. 西瓜花叶病毒和小西葫芦黄花叶病毒复合侵染南瓜的透射电镜诊断[J]. 电子显微学报,2015,34(2):126-131.
[3] 池雪林,曾显成,黄小红,等. 羊口疮病毒感染OFTu细胞的超微结构电镜观察[J]. 福建农林大学学报(自然科学版),2015,44(1):69-73.
[4] SOUZA R D, AMBROSINI A, PASSAGLIA L M. Plant growth-promoting bacteria as inoculants in agricultural soils[J].Genet Mol Biol,2015,38(4):401-419.
[5] JUNG H J, KIM Y, LEE H B, et al.Antiangiogenic activity of the lipophilic antimicrobial peptides from an endophytic bacterial strain isolated from red pepper leaf[J].Mol Cells,2015,38(3):273-278.
[6] HARDOIM P R, VAN OVERBEEK L S, BERG G, et al. The hidden world within plants: ecological and evolutionary considerations for defining functioning of Microbial Endophytes[J].Microbiol Mol Biol Rev,2015,79(3):293-320.
[7] 彭安萍,刘娟,凌婉婷,等. 功能内生菌对植物体内有机污染物代谢的影响[J]. 农业科学环境学报,2013,32(4):668-674.
(责任编辑 马殷华)
Comparative Study on the Preparation Methods of Transmission Electron Microscope Negative Staining Specimens for Plant Endophyte
HUANG Yuanjie, LI Weidong, MO Xiaomin
(Electron Microscope Laboratory of the Medical and Scientific Research Center, Guangxi Medical University, Nanning Guangxi 530021, China)
The results of transmission electron microscope tests of the negative staining specimens of plant endophyte were comparatively studied to explore the ideal preparation methods of transmission microscope negative staining specimens of plant endophyte. Firstly, four methods were used to prepare endophyte suspension, such as direct scraping, double distilled water flushing, double distilled water flushing followed by centrifugal separation and re-suspension and double distilled water flushing followed by static placing. Then, 10 g/L phosphotungstic acid was applied for floating negative staining and the transmission electron microscope test was carried out. And finally, the morphological characteristics, the shape and the quantity of the pilus and the flagellum of the endophyte were used as indicators to assess the advantages and disadvantages of these extracting and processing methods. Results: (1) The original state of the direct scraping sample is better, but the background is heavy, and the surface of the cell is affected easily by impurities. (2) The sample background of the double distilled water flushing is better. (3) The sample of the double distilled water flushing followed by centrifugal separation and re-suspension, and the sample of the double distilled water flushing followed by static placing have a clear vision, uniform distribution, clean background and less impurity under the transmission electron microscope. But the morphology structure of endouphyte of the former one was more easily affected. Transmission electron microscopy is an important tool for endophyte research. However, it is necessary to choose sample processing methods based on the actual situation. Under strict control of the static time, double distilled water flushing followed by static placing with the negative staining technique can achieve better test results.
plant endophyte;transmission electron microscope; negative staining
10.16088/j.issn.1001-6600.2016.03.018
2016-01-27
国家自然科学基金资助项目(81560608);广西自然科学基金资助项目(2015GXNSFAA139123);广西医科大学青年科学基金资助项目(GXMUYSF2014022)
黄远洁(1979—),女,广西北海人,广西医科大学助理研究员,博士。E-mail:renee927@126.com
Q93-33
A
1001-6600(2016)03-0127-04

