肝干细胞移植治疗肝损伤的研究进展①
杨献光 和春翠 朱 琳 徐存拴
(河南师范大学生命科学学院,新乡453007)
肝干细胞移植治疗肝损伤的研究进展①
杨献光 和春翠 朱 琳 徐存拴
(河南师范大学生命科学学院,新乡453007)
肝脏是人体重要的器官,执行合成代谢、解毒和免疫防御等许多重要的功能。近年来,由于病毒性感染、毒性损伤、遗传缺陷及长期接触代谢金属铁和铜等造成肝功能紊乱和急、慢性肝损伤和肝硬化[1],使得肝脏相关疾病的发病率和死亡率不断上升。原位肝移植被认为是治疗终末期肝损伤最有效的方法之一,但由于缺乏合适的肝供体、手术风险、免疫排斥、高成本及长期并发症等问题严重限制其临床应用[2]。近年来,将干细胞或由其分化产生的功能细胞植入病变部位的细胞疗法逐渐受到人们的关注。然而,人类原代肝细胞的数量和增殖能力有限,并且在体外培养时存在快速去分化的缺陷,使得分离后的肝细胞需要持续不断的提供大量的氧和营养物质来维持它们的表型和特定的肝功能,为了解决这个问题,依赖肝干细胞的疗法越来越受到人们的重视[3]。
肝干细胞是成人体内存在的具有自我增殖和多向分化潜能的一类细胞,在终末期肝病患者模型中肝干细胞可分化形成肝细胞、胆管上皮细胞和其他组织细胞[4]。干细胞移植具有供体来源丰富、手术损伤小、免疫排斥小、费用低等优点。通过肝干细胞移植可以修复损伤的肝脏,提高患者存活率。因此,本文对肝干细胞的来源,肝移植的相关技术和移植细胞在损伤组织的迁移作一综述。
1 诱导肝损伤的模型
1.1 药物中毒性肝损伤的模型 Proctor等[5]首次提出了四氯化碳(CCl4)中毒诱导啮齿类动物肝损伤的模型。将溶于橄榄油或花生油中的0.5~1 ml/kg CCl4通过腹腔或皮下组织注入到小鼠体内,每周注射2次,持续4~8周后将会诱导小鼠的肝损伤[6]。其作用机制是:CCl4的活性代谢产物三氯甲基自由基刺激活性中间产物(ROI)的产生,ROI造成脂质过氧化,从而引起细胞损害和结缔组织增多,进而造成肝损伤。
对乙酰氨基酚(APAP)也是造成肝脏严重坏死的最常见的药物毒素,通过腹腔注射300 mg/kg的APAP会造成急性肝实质损伤[7]。Kofman等[8]证明APAP具有剂量依赖性的特点,过量的APAP将会诱导活性代谢产物N-乙酰对苯醌亚胺(NAPQI)的积累,从而造成线粒体中过氧化亚硝酸盐生成。这种氧化应激和溶酶体的铁吸收共同形成线粒体膜通透性转换孔(mPTP),破坏线粒体膜电位的平衡,抑制ATP的合成,进而造成肝损伤。
1.2 酒精诱导肝损伤的模型 长期过量饮酒将会引起中毒性肝脏疾病如酒精性脂肪肝、酒精性肝炎和酒精性肝硬化等。肝脏是酒精代谢的重要场所,在肝内,乙醇主要被细胞质中的乙醇脱氢酶(ADH)和细胞色素P450ⅡE1(CYPⅡE1)及过氧化物酶系氧化,由此产生的氧化应激和膜磷脂过氧化可在短期内导致肝损伤[9]。
1.3 手术诱导肝损伤的模型 肝切除术也是诱导肝损伤的一种方法。在全身麻醉的条件下切除小鼠2/3的肝脏后,再加入2 mg/kg的等小鼠体重的2-乙酰氨基芴(2-AFF)来抑制肝脏再生,进而造成肝损伤[10]。上述几种模型诱导的肝损伤可通过干细胞的移植来得以修复。
2 肝干细胞的类型和功能
肝干细胞(HSC)是成人体内存在的一种具有自我更新和多向分化潜能的细胞,是与肝脏发育和再生有关的各类具有干细胞特性类型细胞的总称。HSC在特定条件下可分化形成肝细胞参与肝脏损伤后的结构和功能的修复,与肝脏的发育、再生、纤维化等过程密切相关。HSC是多源的,如成熟肝细胞、肝卵圆细胞、胚胎干细胞、成体干细胞、诱导多能干细胞等。肝干细胞的肝样分化流程如图1所示[11]。
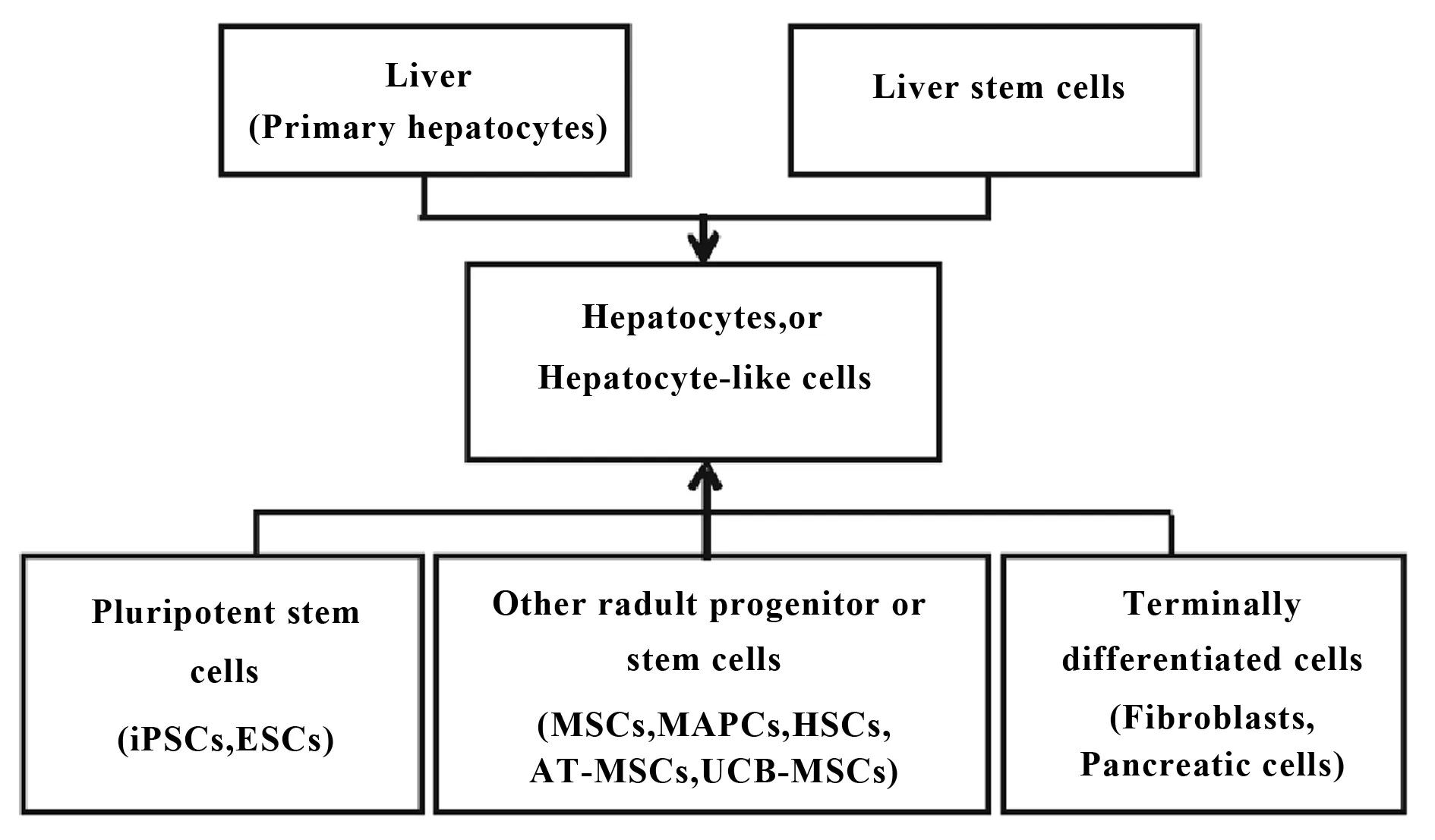
图1 肝干细胞的肝样分化Fig.1 Hepatocyte-like cells differentiation of hepatic stem cell
2.1 成熟肝细胞 人们普遍认为它是一种终末分化细胞,不再具有增殖和分化能力。但近年来研究发现,成熟肝细胞不仅可以自我复制70次以上,而且还具有归巢能力[12],即成熟肝细胞具有一定的可塑性和增殖分化潜能。当肝脏受到轻微的损伤时,肝脏肝细胞将重新进入到细胞周期,通过代偿性增生促进肝脏的修复和再生。对于终末期肝损伤,可通过体外移植成熟肝细胞来缓解肝损伤。De等[13]表明在进行性家族性肝内胆汁淤积Ⅲ型小鼠损伤模型中,通过肝细胞的移植可明显降低肝纤维化的程度和恢复磷脂的分泌。但由于肝细胞稀少珍贵、增殖能力有限、不耐冷冻保存且移植肝细胞的功效具有时间依赖性等缺陷,使得肝细胞移植疗法的大规模使用存在一定的局限性。
2.2 肝卵圆细胞 1956年,Farber等[14]首次发现了肝前体细胞并根据形状将其命名为卵圆细胞,它是一种小的,具有较大核质比的双向分化干细胞。对于肝卵圆细胞(HOC)的来源存在一定的争议,大部分学者认为HOC是位于门静脉周围肝细胞和最小终末支胆管细胞过渡区的Hering管中。目前,通常利用2-乙酰氨基芴(2-AAF)结合2/3肝切除大鼠模型来诱导HOC的激活,使其定向迁移至受损伤的肝脏。Evarts等[15]研究表明HOC首先转变为嗜碱性小肝细胞,再形成完全成熟的肝细胞,同时检测到放射性标记的胸苷从卵圆细胞转移到新形成的肝细胞中。Li等[16]将HOC移入肝损伤的小鼠体内能显著降低血清中肝损伤标志物如丙氨酸氨基转移酶(ALT)、直接胆红素(DBil)、谷酰转肽酶(GGT)、碱性磷酸酶(ALP)等的水平,从而缓解肝损伤。因此,HOC可作为一种内源性的肝干细胞发挥肝损伤修复作用。
2.3 胚胎干细胞 胚胎干细胞(ESCs)是从受精卵内胚层中分离出来的一类多潜能细胞,当ESCs在去除小鼠胚胎成纤维细胞(MEF)饲养层或白血病抑制因子(LIF)的悬浮培养基培养时,能够聚集形成包含三个胚层细胞的胚状体(EBs),进而分化形成各类细胞[17]。当ESCs在含有丁酸钠、小鼠肝细胞生长因子(rMuHGF)和地塞米松(Dex)的培养基中培养,可被诱导分化为表达肝细胞标志物如白蛋白(ALB)、甲胎蛋白(AFP)、转甲状腺素蛋白(TTR)的肝样细胞;利用类似的细胞因子组合如激活素A(Activin A)、亚硒酸(ITS)、成纤维细胞生长因子4(FGF4)、碱性成纤维细胞生长因子(bFGF)及骨形态发生蛋白4(BMP4)可将人的ESCs逐步诱导为肝样细胞。将小鼠ESCs注射到CCl4诱导的肝损伤小鼠体内,在小鼠体内出现功能性的肝样细胞,通过与肝实质融合发挥损伤修复功能。但ESCs的使用存在伦理道德和免疫排斥问题,我们需要不断寻找新的细胞来源。
2.4 诱导多能干细胞 诱导多能干细胞(iPSCs)是通过病毒载体把一些特定的转录因子组合(oct4、 sox2 、klf-4 和c-cmy)导入体细胞而获得具有干细胞特性的一类细胞。iPSCs具有与ESCs相似的多样分化潜能,除形成神经、骨、造血和内皮细胞外,还是应用于再生医学和药物开发中的肝细胞的潜在来源[18]。Sun等[19]研究大鼠iPSCs的肝样分化,分别在诱导的0~5、5~10、10~20 d用wnt3a、Activin A组合、FGF4和BMP2组合、OSM、HGF和Dex组合分阶段诱导。结果显示在内胚层诱导阶段有其特异标志蛋白FOXA2、SOX17的表达,在肝细胞诱导阶段有其特异标志物ALB、AFP、CK18等和功能性的蛋白AAT、CYP1A2和CYP3A4的表达。因此iPSCs可作为一种替代的细胞疗法用于肝再生。
2.5 成体干细胞 成体干细胞(ASCs)是存在于分化组织中的未分化细胞,具有自我更新能力,能够形成该类组织或其他组织的新细胞。间充质干细胞(MSC)是最重要的ASCs,可以从成体组织如骨髓、脂肪组织、胎盘、脐血等分离获得,且能在生长因子、细胞因子、肝细胞或非实质肝细胞的作用下分化形成肝样细胞。目前,骨髓间充质干细胞(BMSCs)和脂肪间充质干细胞(ADMSCs)研究较多。
2.5.1 骨髓间充质干细胞 骨髓间充质干细胞(BMSCs)是研究最早、最深入的成体干细胞,因其具有获取容易、易培养、免疫原性低和多向分化潜能等优点,逐渐成为肝细胞移植的理想细胞。20世纪60年代,Friedenstein等[20]首次通过密度梯度离心法从骨髓中分离出BMSCs,研究发现BMSCs在骨髓中的含量很少,约占有核细胞的0.001%~0.01%,但却能高效的分化成各类细胞系。目前认为BMSCs主要通过细胞转分化和细胞融合两种途径在体内或体外被诱导分化为肝前体细胞(HLCs)。将从人类、大鼠、小鼠骨髓中分离的BMSCs连续暴露于FGF-4、HGF、胰岛素-转铁蛋白-硒和Dex中培养,可以检测到肝细胞标志物HNF-3β、ALB、AFP 、GATA4和CK19的表达,并具有分泌尿素和ALB、储存细胞糖原、摄取LDL等功能,经苯巴比妥诱导可表达细胞色素P450。体外实验表明将人类BMSCs与胰岛素生长因子-1(IGF-1)、烟酰胺、肝细胞核因子4ɑ(HNF-4ɑ)、丙戊酸混合培养时,能显著提高其向肝细胞的分化率和肝细胞特征基因表达水平。此外,BMSCs与宿主肝实质细胞通过细胞融合机制参与组织修复,呈现典型的肝细胞表型,可形成肝脏特定的三维结构[21]。最新研究发现将BMSCs在含有特定生长因子(GFs)的海藻酸盐支架中培养,也会表达肝脏特异性标志物[22]。
BMSCs的肝样分化潜能可以用来治疗肝损伤。实验表明BMSCs移植后通过减少炎性细胞的浸润和抑制肝细胞的凋亡来缓解肝损伤。Li等[23]表明自体BMSCs可分化形成肝细胞促进残余肝脏再生,且通过上调血管上皮生长因子(VEGF)、HGF、IL-10和基质金属蛋白酶9(MMP-9)的基因表达减少胶原沉积,缓解肝硬化门静脉栓塞现象。此外,BMSCs还可以通过旁分泌机制释放各种细胞因子如SDF-1ɑ、VEGF、bFGF、IGF-1、HGF等改善肝脏微环境,研究发现BMSCs可通过SDF-1ɑ/CXCR4、SDF-1ɑ/VEGF参与BMSCs的归巢和促进坏死细胞凋亡,提高BMSCs治疗急性肝损伤的疗效[24]。
BMSCs作为治疗肝损伤的有效替代疗法,还需大量的随机和对照试验评估其作用,以期达到临床应用的安全性。
2.5.2 脂肪间充质干细胞 脂肪间充质干细胞(ADMSCs)具有与BMSCs相似的自我更新和多样分化潜能。ADMSC含量丰富,且能很容易的从脂肪抽吸物或切除的脂肪中获取,因此逐渐成为人们研究的热点。2001年,Zuk等[25]首次利用胶原酶分离得到ADMSCs。随后研究发现ADMSCs在含有OSM、HGF、二甲基亚砜(DMSO)的培养基中悬浮培养时,细胞形态由扁平、细长、梭状转变为紧密相连的圆形上皮细胞,有明显的胆小管结构和成熟肝细胞表型。此外,在ADMSCs诱导分化培养基中加入曲古抑菌素A(TSA)[26],将明显提高其肝样分化率。
移植的ADMSCs和BMSCs一样,也能够改善肝功能,促进肝再生[27]。ADMSCs通过释放可溶性因子如HGF、LIF、前列腺素E2抑制免疫细胞的激活,降低免疫排斥反应,从而提高移植效率。Zhang等[28]表明与单层培养获得的ADMSCs相比,球体派生的ADMSCs具有更好的治疗肝损伤的效果。
由于ADMSCs具有来源广泛、获取容易、多样分化潜能和没有伦理道德问题等优点,逐渐受到人们的青睐,但ADMSCs治疗肝损伤的具体作用机制还需要进一步的阐明。
3 肝干细胞移植的部位和方法
肝干细胞可以通过不同的部位移植到实验动物大鼠(小鼠)体内,移植的细胞通过聚集黏附、存活、产生肝脏来修复肝损伤。移植肝干细胞的方法主要有以下几种:
3.1 门静脉 门静脉由于具有大量的血管通路,因此是最常用的干细胞的移植路径。将1×106个悬浮培养于30 μl PBS或DMEM中的细胞通过门静脉移植到试验动物体内,可达到预期的试验目的。Yuan等[24]表明与尾静脉注射BMSCs相比,门静脉注射后能更显著增加血清中SDF-1、VEGF水平来治疗急性肝衰竭(ALF)。
3.2 脾内注射 脾内注射也是最常用的治疗肝损伤的细胞传递路线,当90%的肝切除或肝脏严重受损不适合干细胞移植时,脾内细胞移植将成为有效的替代方式。移植的肝干细胞通过脾内血液流入残余肝脏,使其在肝脏中维持较高的细胞浓度来促进残余肝再生。由于脾内移植的大部分细胞是通过门静脉迁移至肝脏,可能会造成门静脉栓塞等并发症,因此为了防止注射时细胞泄露,可以通过脾血管暂时封闭来减少栓塞、猝死和门静脉高压。
3.3 腹腔内注射 腹腔体积较大,允许大量细胞移植,易于操作,侵入性和创伤较小,没有器官栓塞等优点,逐渐被用作治疗性细胞移植的良好场所。
3.4 肝内注射 肝干细胞直接灌注于肝脏有利于这些细胞快速在肝脏增殖再生,大大提高增殖效率,然而此方法操作复杂,侵入性损伤较大。此外,当细胞移植到病肝中,此时的肝脏微环境可能已不适合干细胞发挥其作用。
4 肝干细胞在肝脏内定居、迁移和分化的示踪观察
为了更好地了解细胞输注路线、定向迁移和移植后的治疗效果,通过使用磁性、荧光标记、射频成像等标记方法来追踪移植的细胞。
4.1 红色荧光染料PKH26 红色荧光染料PKH26[6]是一种无毒的,且对标记细胞的生物活性和增殖能力没有任何影响的标记物,通过与细胞膜结合而能高效追踪移植的细胞。将PKH26与肝细胞混合培养4 min后,肝细胞便很容易被染色标记,因此便于细胞追踪。
4.2 高对比度纳米颗粒标记移植细胞的磁共振成像技术 MRI由于具有较高的软组织对比和高度的解剖分辨率被广泛用于日常的临床实践中。可以通过造影剂观察特定类型干细胞的富集或用超顺磁性氧化铁(SPIO)直接标记移植的细胞来观察它们在损伤组织中的迁移。目前,通过对SPIO标记细胞的MRI成像技术可实现对活体非损伤性监测移植细胞的迁移。随着技术的进步,将SPIO与钆结合形成高对比度纳米颗粒,可更加有效地观察移植细胞在组织中的存活和增殖情况[29]。
5 肝干细胞移植的临床应用
由于肝干细胞来源广泛,免疫原性低和具有分化形成肝细胞的潜能,在医学领域逐渐受到人们的关注,许多临床试验研究表明肝干细胞可以有效地治疗慢性肝炎、肝硬化、肝癌和先天性肝脏疾病。将肝干细胞通过肝动脉移植到患有失代偿性肝硬化病人体内,6个月后可以明显地观察到MELD评分的降低(P<0.01),多个诊断和生化参数得到改善。Jorns等[30]将肝细胞移植到2名肝切除后的克里格勒-纳贾尔综合征患者体内,试验发现患者血清胆红素显著减少,各项肝脏指标得到改善,表明肝细胞可以用于临床治疗肝损伤。Peng等[31]对158例乙型肝炎患者进行研究,53例治疗组(接受自体BMSCs移植)与105例空白对照组相比,治疗组在3~24周后ALB水平提高、3~36周观察到MELD评分有效改善、在4~12周后TBIL(总胆红素)和PT(凝血酶原时间)也明显得到改善,此外,治疗组患者发展为HCC的可能性仅约为对照组的1/5。通过静脉、脾脏或肝动脉注射到患有慢性乙(丙)型肝炎和酒精性肝硬化病人体内,一段时间后观察发现Child-Pugh评分显著改善,同时AST、ALT、TBIL、TGF-β1和ɑ-SMA降低[32]。
此外,将肝脏干细胞与工程学的原理和技术相结合的肝脏干细胞组织工程学是再生医学中的另一个研究热点。利用各种材料和方法使有限的肝脏干细胞在类似体内组织结构的三维空间培养,从而再生出具有正常肝细胞代谢功能的肝脏组织,通过体内植入对肝病患者达到治疗的目的。
6 结语与展望
肝干细胞作为治疗肝损伤的有效替代疗法越来越受到人们的关注,但作为一种新兴疗法,还存在一些问题需要进一步阐明:(1)肝干细胞分化成肝样细胞的分子机制;(2)肝干细胞的最佳移植路径、移植数量、移植时间的选择;(3)肝干细胞治疗肝损伤时,如何预防其向肿瘤细胞的恶化。因此,还需要大规模的随机和对照试验,来检测肝干细胞临床应用的安全性。
[1] Wu XB,Tao R.Hepatocyte differentiation of mesenchymal stem cells [J].Hepatobiliary Pancreat Dis Int,2012,11(4):360-371.
[2] Duan BW,Lu SC,Wang ML,etal.Liver transplantation in acute-on-chronic liver failure patients with high model for end-stage liver disease (MELD) scores:a single center experience of 100 consecutive cases[J].J Surg Res,2015,183(2):936-943.
[3] Hu CX,Li LJ.In Vitro and in vivo hepatic differentiation of adult somatic stem cells and extraembryonic stem cells for treating end stage liver diseases[J].Stem Cells Int,2015,2015:871972.
[4] 吴雄伟,张丹琴,胡惠琼,等.肝干细胞移植的研究进展及其应用前景[J].四川生理科学杂志,2015,37(3):139-142.
[5] Proctor E,Chatamra K.High yield micronodular cirrhosis in the rat[J].Gastroenterology,1982,83(6):1183-1190.
[6] Hashemi Goradel N,Darabi M,Shamsasenjan K,etal.Methods of liver stem cell therapy in rodents as models of human liver regeneration in hepatic failure[J].Adv Pharm Bull,2015,5(3):293-298.
[7] Yin H,Cheng L,Holt M,etal.Lactoferrin protects against acetaminophen induced liver injury in mice[J].Hepatology,2010,51(3):1007-1016.
[8] Kofman AV,Morgan G,Kirschenbaum A,etal.Dose-and time-dependent oval cell reaction in acetaminophen-induced murine liver injury[J].Hepatology,2005,41(6):1252-1261.
[9] 蔡昌豪,董雪娟.酒精与肝损伤[J].中华老年医学杂志,2008,27(3):238-241.
[10] Chinzei R,Tanaka Y,Shimizu-Saito K,etal.Embryoid-body cells derived from a mouse embryonic stem cell line show differentiation into functional hepatocytes[J].Hepatology,2002,36 (1):22-29.
[11] 樊晋宇,王 妍,李丽丽,等.不同途径与策略获取成熟肝(样)细胞的研究进展[J].中国细胞生物学学报,2013,35(8):1196-1204.
[12] 朱越锋,沈来根.肝硬化门脉高压症治疗的新途径-干细胞移植研究进展[J].国际外科学杂志,2007,34(2):119-123.
[13] De Vree JM,Ottenhoff R,Bosma PJ,etal.Correction of liver disease by hepatocyte transplantation in a mouse model of progressive familial intrahepatic cholestasis[J].Gastroenterology,2000,119(6):1720-1730.
[14] Farber E.Similarities in the sequence of early histological changes induced in the liver of the rat by ethionine,2-acety-lamino-fluorene,and 3′-methyl-4-dimethylaminoazobenzene[J].Cancer Res,1956,16:142-148.
[15] Evarts RP,Hu Z,Omori N,etal.Precursor-product relationship between oval cells and hepatocytes:comparison between tritiated thymi-dine and bromodeoxyuridine as tracers[J].Carcinogenesis,1996,17(10):2143-2151.
[16] Li Z,Chen J,Li L,etal.In vitro proliferation and differentiation of hepatic oval cells and their potential capacity for intrahepatic transplantation[J].Braz J Med Biol Res,2013,46:681-688.
[17] Hamazaki T,Iiboshi Y,Oka M,etal.Hepatic maturation in differentiating embryonic stem cells in vitro[J].FEBS Lett,2001,497(1):15-19.
[18] Noto FK,Determan MR,Cai J,etal.Aneuploidy is permissive for hepatocyte-like cell differentiation from human induced pluripotent stem cells[J].BMC Res Notes,2014,7(1):1-9.
[19] Sun C,Hu JJ,Pan Q,etal.Hepatic differentiation of rat induced pluripotent stem cells in vitro[J].World J Gastroenterol,2015,21(39):11118-11126.
[20] Friedenstein AJ,Chailakhjan RK,Lalykina KS.The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells[J].Cell Tissue Kinet,1970,3(4):393-403.
[21] Dong X,Pan R,Zhang H,etal.Modification of histone acetylation facilitates hepatic differentiation of human bone marrow mesenchymal stem cell[J].PLoS One,2013,8(5) :e63405.
[22] Lin N,Lin J,Bo L,etal.Differentiation of bone marrow-derived mesenchymal stem cells into hepatocyte-like cells in an alginate scaffold[J].Cell Prolif,2015,43(5):427-434.
[23] Li T,Zhu J,Ma K,etal.Autologous bone marrow-derived mesenchymal stem cell transplantation promotes liver regeneration after portal vein embolization in cirrhotic rats[J].J Surg Res,2015,184(2):1161-1173.
[24] Yuan SF,Jiang T,Sun LH,etal.Use of bone mesenchymal stem cells to treat rats with acute liver failure[J].Gene Mole Res,2014,13 (3):6962-6980.
[25] Zuk PA,Zhu M,Mizuno H,etal.Multilineage cells from human adipose tissue:implications implications for cell-based therapies[J].Tissue Engineering,2001,7( 2):211-228.
[26] Yin LB,Zhu YH,Yang JA,etal.Adipose tissue-derived mesenchymal stem cells differentiated into hepatocyte-like cells in vivo and in vitro[J].Mole Med Rep,2014,11(3):1722-1732.
[27] Sun J,Yuan Y,Qin H,etal.Serum from hepatectomized rats induces the differentiation of adipose tissue mesenchymal stem cells into hepatocyte-like cells and upregulates the expression of hepatocyte growth factor and interleukin-6 in vitro [J].Int J Mole Med,2013,31(3):667-675.
[28] Zhang S,Liu P,Chen L,etal.The effects of spheroid formation of adipose-derived stem cells in a microgravity bioreactor on stemness properties and therapeutic potential [J].Biomaterials,2015,41:15-25.
[29] Habeeb MA,Vishwakarma SK,Bardia A,etal.Hepatic stem cells:A viable approach for the treatment of liver cirrhosis [J].World J Stem Cells,2015,7(5):859-865.
[30] Jorns C,Nowak G, Nemeth A,etal.De novo donor-specific HLA antibody formation in two patients with crigler-najjar syndrome type I following human hepatocyte transplantation with partial hepatectomy preconditioning[J].Am J Transplant,2015,16(3):1021-1030.
[31] Peng L,Xie DY,Lin BL,etal.Autologous bone marrow mesenchymal stem cell transplantation in liver failure patients caused by hepatitis B:Short-term and long-term outcomes[J].Hepatology,2011,54:820-828.
[32] Beradis S,Dwisthi Sattwika P,Najimi M,etal.Use of mesenchymal stem cells to treat liver fibrosis:Current situation and future prospects[J].World J Gastroenterol,2015,21(3):742-758.
[收稿2016-01-06 修回2016-02-22]
(编辑 倪 鹏)
10.3969/j.issn.1000-484X.2016.12.029
①本文为国家自然科学基金项目(No.U1404312)、河南省教育厅科学技术研究重点项目(No.13A180532)和河南师范大学博士启动基金和青年骨干教师项目。
杨献光(1980年-),男,博士,副教授,硕士生导师,主要从事肝再生分子机理方面研究,E-mail:yangxg@htu.cn。
R657.3
A
1000-484X(2016)12-1854-05

