持续输注右美托咪定在停跳冠状动脉旁路移植术中对高迁移率族蛋白1表达的影响*
陈胜阳 胡 杰 张永强 王更富 岳修勤
(新乡医学院第一附属医院麻醉科,新乡 453100)
·临床论著·
持续输注右美托咪定在停跳冠状动脉旁路移植术中对高迁移率族蛋白1表达的影响*
陈胜阳 胡 杰**①张永强 王更富 岳修勤
(新乡医学院第一附属医院麻醉科,新乡 453100)
目的 探讨右美托咪定在冠状动脉粥样硬化性心脏病(冠心病)停跳冠状动脉旁路移植手术中对高迁移率族蛋白1(high mobility group box-1 protein,HMGB-1)的影响。方法选取我院2015年2~12月常规行停跳冠状动脉旁路移植手术60例,采用随机数字表随机分为右美托咪定组和对照组,每组各30例。2组均用咪达唑仑、舒芬太尼、维库溴铵进行麻醉诱导,术中采用丙泊酚和舒芬太尼靶控输注,间断注射维库溴铵,维持脑电双频指数(bispectral index,BIS) 40~60,右美托咪定组从诱导开始加注右美托咪定0.5 μg·kg-1·h-1进行维持麻醉,对照组给予等量生理盐水。监测麻醉诱导后、切皮、体外循环前、术后1 h 4个时间点血压、心率情况。分别于T1(体外循环前)、T2(体外循环结束时)、T3(术后6 h)、T4(术后24 h)、T5(术后48 h)5个时点取血5 ml进行HMGB-1,TNF-α酶联免疫法检测分析。结果麻醉诱导后血压右美托咪定组显著高于对照组[(65.2±11.4) mm Hg vs.( 52.2±13.6) mm Hg,t=-4.012,P=0.000],切皮后右美托咪定组显著低于对照组[(66.1±9.3) mm Hg vs.(74.9±14.8) mm Hg,t=2.758,P=0.008];心率右美托咪定组在诱导后、切皮后、体外循环前、术后1 h均显著慢于对照组[(63.7±8.0) 次/min vs. (75.6±9.4) 次/min,t=5.280,P=0.000;(59.1±7.6) 次/min vs. (81.8±9.8) 次/min,t=10.026,P=0.000;(54.6±6.1) 次/min vs. (61.6±8.5) 次/min,t=-3.665,P=0.000;(62.5±6.5) 次/min vs. (68.6±7.2) 次/min,t=3.444,P=0.001]。右美托咪定组HMGB-1光密度(optical density,OD)值在T2、T3、T4、T5均明显低于对照组(T2:1.65±0.24 vs. 2.58±0.35,t=12.003,P=0.000;T3:2.15±0.30 vs. 3.72±0.61,t=12.650,P=0.000;T4:1.82±0.20 vs. 2.53±0.39,t=8.873,P=0.000;T5:1.95±0.32 vs. 2.92±0.46,t=9.481,P=0.000)。右美托咪定组TNF-α OD值在T2、T3、T4、T5均明显低于对照组(T2:2.04±0.32 vs. 3.08±0.41,t=10.952,P=0.000;T3:2.59±0.51 vs. 4.98±0.96,t=12.042,P=0.000;T4:1.76±0.35 vs. 2.93±0.34,t=13.133,P=0.000;T5:1.42±0.25 vs. 2.51±0.30,t=15.288,P=0.000)。结论在冠心病停跳冠状动脉旁路移植手术中应用右美托咪定能够降低机体HMGB-1含量,发挥其抗炎及免疫调节作用,起到保护作用。
右美托咪定; 冠状动脉粥样硬化性心脏病; 高迁移率族蛋白1
心肺转流术(cardiopulmonary bypass,CPB)技术的应用使心血管手术发生了质的飞跃,同时也不可避免给机体带来损伤。心脏手术病人发生全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)不是手术后立即发生,而是一种迟发的,时间滞后的晚期炎症反应。Wang等[1]研究显示炎症反应的时效恰恰与目前发现的晚期炎症介质——高迁移率族蛋白1(high mobility group box-1 protein,HMGB-1)的作用时间重叠,其特殊、强大、迟发的致炎效应也与心脏术后的SIRS相符。TNF-α主要是由缺血再灌注的心肌细胞释放,与CPB时间及升主动脉阻断时间相关,阻断越长,TNF-α水平越高。中等剂量TNF-α促进IL-6、IL-1急性反应蛋白产生[2]。TNF-α是SIRS中最早和最重要的被释放的细胞因子之一。右美托咪定是一种新型高选择性α2肾上腺素受体激动剂,Schoeler等[3]研究证实右美托咪定具有免疫调节作用,可降低炎症反应,激活抗凋亡信号通路产生细胞保护效应,对包括脑、心、肺、肾等在内的多种器官具有保护作用。刘海林等[4]的研究显示右美托咪定能够降低心血管手术风险,起到HMGB-1抑制剂相似的作用,但具体机制尚存在争论。2015年2~12月我们对60例冠状动脉旁路移植术在麻醉诱导开始分别采用加注右美托咪定0.5 μg·kg-1·h或等量生理盐水2种不同的麻醉处理方式,对患者围术期HMGB-1的变化进行比较,探讨右美托咪定可能存在的围术期保护的相关机制。
1 临床资料与方法
1.1 一般资料
本研究通过我院伦理委员会批准(批文号:20150105)。病例选择标准:①无肝、肾等重要器官功能不全,无感染性疾病或过敏病史;②左室射血分数(left ventricular ejection fraction,LVEF)≥40%,且无左心房血栓,近4周内未发生心肌梗死,心电图未见传导阻滞;③心功能Ⅱ~Ⅳ级;④均无心脏手术史,无电解质或酸碱平衡紊乱;⑤患者或家属均自愿参加本研究,并签署知情同意书。排除标准:合并明显呼吸功能不全、肝肾衰竭;Ⅱ级以上房室传导阻滞、冠状动脉严重狭窄以及心动过缓;有精神病史、麻醉药物过敏史;术前未经控制的严重高血压史和糖尿病史(未规律服药或血压控制不佳)。选择60例限期冠状动脉旁路移植,ASA分级Ⅱ~Ⅲ级,心功能分级Ⅱ或Ⅲ级,根据国际心脏病学会冠心病诊断标准或冠状动脉造影诊断为冠心病。年龄60~75岁,血管病变为2~3支侧支(以前降支、左旋支阻塞90%以上为主,左主干和右冠状动脉完全梗死者排除),术前患者无肺通气和换气功能障碍。患者按入院顺序编号,采用随机数字表分为2组:右美托咪定组和对照组,每组30例。2组患者一般资料无统计学差异(P>0.05),有可比性,见表1。
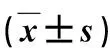
表1 2组患者一般资料比较
1.2 方法
①术前用药:入室前肌肉注射吗啡10 mg,东莨菪碱0.3 mg。②麻醉诱导和维持:建立静脉通路,连接心电图(electrocardiograph,ECG),脉搏氧饱和度(SpO2),无创血压(blood pressure,BP),脑电双频指数(bispectral index,BIS)监测,在局部麻醉下完成左侧桡动脉穿刺置管和右颈内静脉穿刺置管分别监测动脉压和中心静脉压。采用丙泊酚靶控输注 (target controll infusion,TCI)联合舒芬太尼全凭静脉麻醉(total intravenous anesthesia,TIVA)。术中丙泊酚靶浓度4~6 mg/L,舒芬太尼0.5~0.8 μg/L,间断注射维库溴铵,维持BIS在40~60。术中常规监测ECG、血压、SpO2、血气、鼻咽温、有创动脉压、中心静脉压及BIS值。术中给予间歇正压通气,吸呼比1∶1.5,潮气量为6~8 ml/kg,频率10~12次/min,根据呼气末二氧化碳分压调节呼吸参数。③右美托咪定组给药方法和剂量:静脉通路建立后,持续泵入右美托咪定(0.5 μg·kg-1·h-1)至手术结束。对照组:等量生理盐水持续泵注至手术结束。术中循环管理:平均动脉压(mean arterial pressure,MAP)低于60 mm Hg给予补液和升压处理,MAP高于120 mm Hg给予加深麻醉或降压处理。术中CPB前常规甲泼尼龙20 mg。④手术方法:胸正中切口,常规建立CPB,腔房管引流,2组术中每隔30 min采用4∶1冰晶体停跳液灌注行心肌保护。⑤体外循环方法:应用进口人工心肺机,采用全身中度低温(27~32 ℃),血液中度稀释;应用4∶1冰晶体停跳液,流量50~70 ml/kg;肝素用量为血预冲液:5 mg/100 ml,体内:3 mg/kg。转流期间激活全血凝固时间维持在480 s以上,转流结束后以硫酸鱼精蛋白中和肝素(1∶1.3)。转流期间鼻咽温维持在25.3~34.5 ℃,MAP 60~70 mm Hg。⑥术后情况及处理:术后常规心电监护,呼吸机辅助呼吸,酌情使用正性肌力药、心血管活性药及呼末正压通气(positive end-expiratory pressure,PEEP)维持循环呼吸功能稳定。术后常规监测血常规、动脉血气、肝、肾功能及电解质的变化。
1.3 观察指标
监测麻醉前基础值、麻醉诱导后、切皮、CPB前、术后1 h 5个时间点血压、心率。分别于T1(CPB前)、T2(CPB结束时)、T3(术后6 h)、T4(术后24 h)、T5(术后48 h)取血5 ml,采用淋巴细胞分离液按密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),取约2×106个细胞数冻存。标本收集齐后,复苏PBMC进行HMGB-1、TNF-α酶联免疫吸附试验,按试剂盒(美国Sigma公司)说明进行加样、孵育、洗板、覆膜孵育、甩干、洗板、终止反应等步骤处理,通过酶标仪450 nm波长测各孔的光密度(optical density,OD)值进行定量分析。
1.4 统计学处理
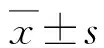
2 结果
右美托咪定组术中出血量、手术时间比对照组明显减少/缩短(P<0.05),见表2。右美托咪定组MAP在麻醉诱导后显著高于对照组,切皮即刻显著低于对照组。右美托咪定组HR在麻醉诱导后和切皮即刻、CPB前、术后1 h显著低于对照组,见表3,表明右美托咪定对整个手术过程尤其是麻醉诱导和切皮时刻的血压和心率波动更小,循环较稳定。2组患者围术期外周血HMGB-1和TNF-α OD值在T2开始升高,T3达峰值,T4下降,HMGB-1 T5升高,2组同一时间点比较,右美托咪定组在T2、T3、T4、T5时点均显著低于对照组(P<0.05),见表4、5。
右美托咪定组ICU时间(17.23±2.31)h,明显短于对照组(28.03±3.48)h(t=-14.162,P=0.003)。术后右美托咪定组未发生低氧血症,对照组3例,通过雾化排痰等措施改善。

表2 2组手术情况比较

表3 2组患者术中血压、心率比较

表4 2组患者外周血HMGB-1 OD值比较
T1:CPB前;T2:CPB结束时;T3:术后6 h;T4:术后24 h;T5:术后48 h

表5 2组患者外周血TNF-α OD值比较
T1:CPB前;T2:CPB结束时;T3:术后6 h;T4:术后24 h;T5:术后48 h
3 讨论
冠心病的围术期血流动力学以维持心肌氧的供需平衡为主[5]。对冠心病患者,其心肌组织的氧交换主要取决于冠状动脉的供血,而HR作为心肌氧供平衡的主要因素之一,一定程度降低HR有助于心脏耐受缺血[6]。CPB为心脏直视手术提供可靠的保障,但CPB导致的灌注肺及炎症反应同样可以从SIRS发展到到严重的多器官功能不全综合征(multiple organ dysfunction syndrome,MODS)。本研究右美托咪定组手术时间和术中出血量均明显短于/少于对照组(P<0.05),可能与右美托咪定组患者心肌保护更好,复跳后心率较慢,更利于外科血管吻合,循环调整更快有关,但由于样本量较小,还需要增大样本量加以证实。
HMGB-1是一种进化中高度保守的非组蛋白染色体蛋白,以往研究认为HMGB-1主要在细胞核内起着骨架蛋白和转录调节的作用。HMGB-1可被内毒素或促炎因子激活的单核巨噬细胞和垂体后叶细胞分泌[7],也可通过坏死细胞释放到细胞外[8],发挥强大的致炎作用。HMGB-1在炎症和细胞凋亡的病理生理学意义得到学术界的高度重视。HMGB-1出现晚、持续时间长,可能处于炎症反应的下游阶段,起维持并延长炎症反应的作用,为炎症反应的治疗干预提供相对更长的时间窗,其独特的促炎功能和特点,使其比一些早期炎症介质更具有潜在的研究价值。HMGB-1在细胞核内主要参与细胞分化、稳定染色质结构、调节基因转录和翻译以及类固醇激素调控等生命活动,核内的HMGB-1还可通过炎症细胞的主动分泌排出至胞外。HMGB-1释放至胞外后,可视为“内源性的危险信号”而被免疫系统识别,启动系列免疫应答反应[9]。胞外的HMGB-1扮演着“双重”的角色:凋亡或坏死细胞被动释放HMGB-1,启动早期炎症应答,及时清除异物,对损伤组织或器官起到修复作用;单核巨噬细胞等免疫细胞以及神经元主动分泌HMGB-1,作为促炎细胞因子样物质,启动晚期炎症应答,在趋化因子的作用下,使更多的炎症细胞浸润到受损的组织,使病理损伤进一步加重[10]。HMGB-1参与多种疾病的发生发展,这些疾病包括感染性疾病、肿瘤、自身免疫性疾病、创伤、冠状动脉硬化和血管再狭窄等[11]。HMGB-1是一种独特的晚期炎症介质,出现晚,持续时间长。右美托咪定是一种新型高选择性仅2受体激动剂,Yang等[12]用高潮气量通气模式诱导大鼠肺损伤,当注射10倍剂量的右美托咪定,在其病理形态、炎症因子、血气、趋化因子等方面可显著改善高潮气量通气所致肺损伤效应。Diao等[13]通过内毒素诱导或盲肠结扎及穿破肠的脓毒症模型显示,右美托咪定可以降低TNF-α和IL-6的浓度及脓毒症大鼠的死亡率。α2肾上腺素能受体的激动可以使离体巨噬细胞的吞噬能力增强,从而可能会增加非特异性免疫系统的细菌清除能力[14]。Hofer等[15]研究显示右美托咪定应在术前给药以达到最大抗炎效果。
本研究通过在整个手术过程中持续输注右美托咪定,通过不同时点监测经典的炎症因子TNF-α和HMGB-1的变化趋势, 在T2、T3、T4、T54个时点右美托咪定组HMGB-1均显著低于对照组(P=0.000),同时TNF-α也显著低于对照组(P=0.000),说明右美托咪定组的炎症反应在这几个时间点轻于对照组,间接说明右美托咪定能够抑制CPB后的炎症反应,减少HMGB-1的释放,减少冠心病患者冠状动脉旁路移植手术围术期的HMGB-1的含量,起到抑制HMGB-1的作用,从而抑制冠状动脉旁路移植术中患者的炎症反应,避免可能发生SIRS,避免机体炎症细胞的应答和激活,对机体产生炎症保护作用。
1 Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endotoxin lethality in mice.Science,1999,285(5425):248-251.
2 Cohen J. The immunopathogenesis of sepsis. Nature,2002,420(6917):885-891.
3 Schoeler M,Loetscher PD,Rossaint R,et al. Dexmedetomidine is neuroprotective in an in vitro model for traumatic brain injury.BMC Neurol,2012,12(20):1471-1478.
4 刘海林,钱燕宁.右美托咪定对心脏瓣膜置换术患者围术期炎性反应的影响.中国应用生理学杂志,2013,29(4):316-317.
5 方仲蓉,赵晓琴,王古岩,等.右美托咪定对冠状动脉旁路移植术患者麻醉诱导期BIS和血流动力学的影响.中国微创外科杂志,2011,11(2):113-118.
6 Olutoye OA,Glover CD,Diefenderfer JW,et al. The effect of intraoperative dexmedetomidine on postoperative analgesia and sedation in pediatric patients undergoing tonsillectomy and adenoidectomy.Anesth Analg,2010,111(2):490-495.
7 Abraham E,Arcaroli J,Carmody A,et al.HMG-1 as a mediator of acute lung inflammation.J Immunol,2000,165(6):2950-2954.
8 Watanabe T,Kubota S,Nagaya M,et al.The role of HMGB-1 on the development of necrosis during hepatic ischemia and hepatic ischemia/reperfusion injury in mice.J Surg Res,2005,124(1):59-66.
9 Klune JR,Dhupar R,Cardinal J,et al.HMGB1:endogenous danger signaling.Mol Med,2008,14(7-8):476-484.
10 Yang QW,Wang JZ,Li JC,et al. High-mobility group protein box-1 and its relevance to cerebral ischemia.J Cereb Blood Flow Metab,2010,30(2):243-254.
11 Hou LC,Qin MZ,Zheng LN,et al. Severity of sepsis is correlated with the elevation of serum high-mobility group box 1 in rats.Chin Med J(Engl),2009,122(4):449-454.
12 Yang CL,Tsai PS,Huang CJ. Effects of dexmedetomidine on regulating pulmonary inflammation in a rat model of ventilator-induced lung injury. Acta Anaestheiol Taiwan,2008,46(4):151-159.
13 Qiao H,Sanders RD,Ma D,et al. Sedation improves early outcome in severely septic Sprague Dawley rats. Crit Care,2009,13(4):R136.
14 Gets J,Monroy FP. Effects of alpha and beta-adrenergic agonists on toxoplasma gondi infection in murine macrophages. J Parasitol,2005,91(1):193-195.
15 Hofer S,Steppan J,Wagner T,et al. Central sympatholytics prolong survival in experimental sepsis. Crit Care,2009,13(1):R11.
(修回日期:2016-05-16)
(责任编辑:李贺琼)
Effect of Continuous Infusion of Dexmedetomidine on HMGB-1 Expression in Coronary Artery Bypass Grafting
ChenShengyang*,HuJie,ZhangYongqiang*,etal.
*DepartmentofAnesthesiology,FirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453100,China
HuJie,E-mail:13721624858@163.com
Objective To study the effect of dexmedetomidine on the high mobility group box-1 protein (HMGB-1) in coronary heart disease (CHD) bypass surgery. Methods Sixty patients undergoing cardiac arrest bypass coronary artery grafting were randomly assigned into either control group (C) or treatment group (D),with 30 patients in each group. Both groups were given anesthesia induction with midazolam,sufentanil,and vecuronium,target controlled infusion of propofol and sufentanil,and intermittent injection of vecuronium. The bispectral index (BIS) was maintained in the range of 40-60. The D group was given dexmedetomidine at 0.5 μg·kg-1·h-1for anesthesia maintenance,while the C group was given same amount of normal saline. The blood pressure and heart rate were monitored at time points of after induction of anesthesia,after the skin incision,before cardiopulmonary bypass,and 1 h after operation. Blood samples (5 ml) were taken for HMGB-1 western blot testing at T1(before cardiopulmonary bypass),T2(end of cardiopulmonary bypass),T3(6 h postoperatively),T4(24 h postoperatively),and T5(48 h postoperatively),respectively. Results The D group had significantly higher blood pressure than the C group after anesthesia induction [(65.2±11.4) mm Hg vs.(52.2±13.6) mm Hg,t=-4.012,P=0.000] and significantly lower blood pressure than the C group after the skin incision [(66.1±9.3) mm Hg vs. (74.9±14.8) mm Hg,t=2.758,P=0.008]. At the time points of after induction,after skin incision,before cardiopulmonary bypass,and 1 h after operation,the D group had significantly lower heart rate than the C group [(63.7±8.0) beats/min vs. (75.6±9.4) beats/min,t=5.280,P=0.000; (59.1±7.6) beats/min vs. (81.8±9.8) beats/min,t=10.026,P=0.000; (54.6±6.1) beats/min vs. (61.6±8.5) beats/min,t=-3.665,P=0.000; (62.5±6.5) beats/min vs. (68.6±7.2) beats/min,t=3.444,P=0.001]. The optical density of HMGB-1 was significantly lower in the D group than that in the C group at T2,T3,T4and T5(1.65±0.24 vs. 2.58±0.35,t=12.003,P=0.000; 2.15±0.30 vs. 3.72±0.61,t=12.650,P=0.000; 1.82±0.20 vs. 2.53±0.39,t=8.873,P=0.000; 1.95±0.32 vs. 2.92±0.46,t=9.481,P=0.000). The optical density of TNF-α was significantly lower in the D group than that in the C group at T2,T3,T4and T5(2.04±0.32 vs. 3.08±0.41,t=10.952,P=0.000; 2.59±0.51 vs. 4.98±0.96,t=12.042,P=0.000; 1.76±0.35 vs. 2.93±0.34,t=13.133,P=0.000; 1.42±0.25 vs. 2.51±0.30,t=15.288,P=0.000). Conclusion During coronary heart disease bypass grafting,application of dexmedetomidine can decrease the level of HMGB-1 and exert functions of anti-inflammation and immune regulation,so as to effectively prevent perioperative complications and play a protection role.
Dexmedetomidine; Coronary heart disease; HMGB-1
河南省洛阳市科技局基金项目(项目编号:1503006A-2)
**通讯作者,E-mail:13721624858@163.com
①(郑州大学附属洛阳中心医院麻醉科,洛阳 471000)
A
1009-6604(2016)07-0601-05
10.3969/j.issn.1009-6604.2016.07.007
2016-01-27)

