非小细胞肺癌血内皮干细胞检测及临床意义
江一鸣 徐瑶 杨新妹 俞丹璐 王燕
非小细胞肺癌血内皮干细胞检测及临床意义
江一鸣 徐瑶 杨新妹 俞丹璐 王燕
目的探讨化疗对非小细胞肺癌(NSCLC)患者血内皮干细胞(cEPCs)的影响。方法51例晚期NSCLC患者紫杉醇联合顺铂化疗过程中,分别于化疗前1d、化疗开始后第7天、第15天和第42天用流式细胞仪检测外周血cEPCs数量。cEPCs的分子标志物定义为CD34+/CDl33+/VEGFR-2+。结果化疗周期的不同时间点外周血cEPCs数量存在差异。化疗后第15天cEPCs最多(F=5.153,P=0.002),化疗获益者化疗后cEPCs减少(t=3.716,P<0.001),疾病进展者cEPCs增加(t=4.215,P<0.001),cEPCs数量变化与化疗疗效相关(r=0.708,P<0.001)。化疗获益者治疗前的cEPCs数量低于化疗无效者(t=5.081,P<0.001)。结论NSCLC的化疗疗效与cEPCs数量密切相关;监测非小细胞肺癌患者的cEPCs有可能作为一种新的判断预后的指标。
非小细胞肺癌 血管生成 化疗 循环内皮干细胞
当前肺癌是常见恶性肿瘤的首位死因,其中绝大多数为晚期非小细胞肺癌(NSCLC)。化疗是晚期NSCLC的主要治疗手段,临床获益率为20%~50%。近年来,肿瘤的血管生成理论和抗肿瘤血管生成治疗受到越来越多的重视,内皮干细胞(EPCs)与肿瘤血管生成关系密切[1]。有研究发现,NSCLC患者外周血中的循环内皮干细胞(cEPCs)增多[2]。本资料通过检测对晚期NSCLC患者采用紫杉醇联合顺铂化疗过程中外周血cEPCs的动态变化,探讨化疗疗效与cEPCs的关系及其临床意义。
1 临床资料
1.1 一般资料 2010年11至2012年9月本院收治经病理确诊的晚期复发转移的NSCLC患者51例,男34例,女17例;年龄39~73岁,中位年龄53岁。患者卡氏评分≥70,肝肾功能,心电图和血常规均在化疗规定的范围内,患者同意接受紫杉醇联合顺铂方案化疗。排除血糖、血脂等代谢异常,近3个月内出现凝血功能异常或血栓,外伤、手术或近期有活动性出血,2年内曾明确患有动脉粥样硬化和冠心病。
1.2 治疗方法 紫杉醇175mg/m2,第1天3h内静脉滴注,常规地塞米松、西咪替丁针等预防性抗过敏处理。顺铂,75mg/m2,分3d静脉滴注,常规水化利尿。21d为1个周期,连续2个周期。2周期后疗效评价(RECIST标准),分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。不良反应根据NCICTC 2.0标准,分为0~Ⅵ°。化疗后白细胞≤3×109/L时开始使用粒细胞集落刺激因子(G-CSF),至WBC≥10×109/L停止。
1.3 标本收集及制备 化疗前1d(D-1)、化疗后第7天(D7)、第15天(D15)及2个周期化疗完成时(D42)取外周血10ml置入EDTA 抗凝管(广州阳普公司),经过免疫荧光抗体标记标本至少45min后(标记完需避光),标本溶血,离心过滤制成细胞悬液,上机检测。标本完成时间<2h。
1.4 流式细胞仪检测 以CD34+/CDl33+/VEGFR-2+为EPCs标志,检测机器为美国贝克曼库尔特公司PC500,溶血机器为美国贝克曼库尔特公司TQ-Prep,方法参照文献[3]。CD34免疫荧光抗体、EDTA及红细胞裂解液均为美国贝克曼公司产品,CDl33、VEGFR-2免疫荧光抗体为Santa Cruz公司产品。红细胞裂解、单细胞悬液制备及抗体温育等操作均按说明书进行。
1.5 统计学方法 采用SPSS 19.0统计软件。计量资料用(x±s)表示,采用t检验和方差分析;疗效与cEPCs的相关性采用Spearman法分析;化疗、G-CSF对cEPCs的影响采用多元线性回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 疗效与化疗过程中cEPCs数量的变化 51例患者均完成了2个周期化疗。所有患者cEPCs于D-l、D7、D15和D42分别为(0.130±0.043)、(0.129±0.039)、(0.152±0.040)和(0.121±0.045),显示cEPCs在不同时间点差异有统计学意义(F=5.153,P=0.002),其中D15最多,显著高于D-1时(P<0.05),D7、D42与D-1时比较,差异无统计学意义(P>0.05)。51例患者中,临床获益39例,其中CR 3例,PR 16例,SD20例,化疗前后cEPCs分别为(0.118±0.035)和(0.095±0.027),下降明显(t=3.716,P<0.001)。而化疗无效(PD)12例,化疗前后cEPCs分别为(0.158±0.044)和(0.196±0.047),提示化疗后cEPCs显著增加(t=4.215,P<0.001)。见图1。与治疗前比较,临床获益者cEPCs少于化疗无效者,差异有统计学意义(t=5.081,P<0.001)。化疗2个周期后cEPCs的减少与临床获益相关(r=0.708,P<0.001)。
2.2 回归分析 将化疗后测得的外周血cEPCs数量作为因变量,近期疗效和G-CSF的使用情况作为自变量,进行多元线性回归分析,变量入选模型的方法为逐步回归法,见表1。
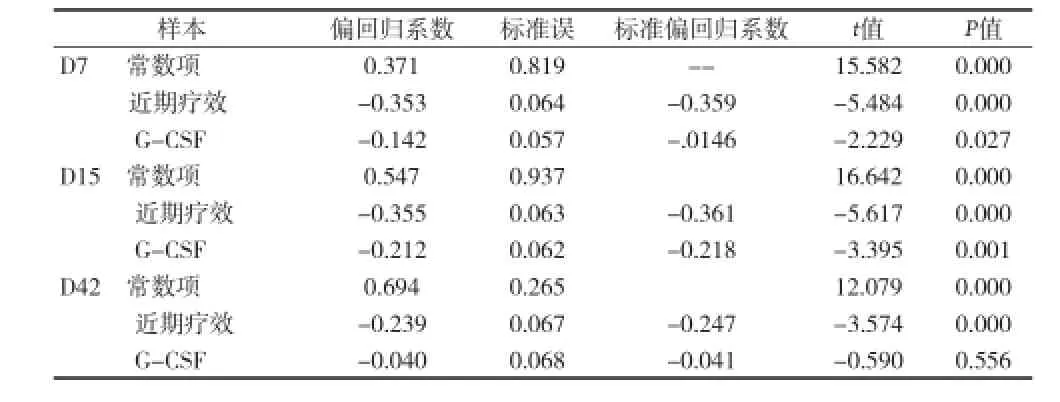
表1 NSCLC患者外周血cEPCs的多重线性回归分析
3 讨论
血管生成在肿瘤的进展中至关重要,当肿瘤组织生长达到一定体积时,其微环境已不能满足其生长所需求的营养,此时会诱使肿瘤细胞启动所谓的“血管形成开关”[4],通过促使原血管生成蛋白的表达,使原先存在的毛细血管扩散,促进新血管形成。有研究发现骨髓来源的外周血EPCs在肿瘤血管形成中发挥重要作用,最近有多组研究在人类肿瘤血管中发现了CD133的EPCs,且多种肿瘤患者外周血中EPCs的水平上升,如乳腺癌[5]、肝癌[6]、淋巴瘤[7]等。并且已经证实,EPCs参与NSCLC的肿瘤血管生成。
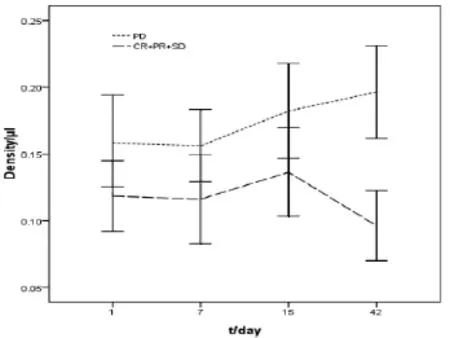
图1 NSCLC化疗的近期疗效与cEPCs的变化
本资料显示,化疗后第15天cEPCs数量显著增加,较化疗前和化疗后第7天分别增加了16.92%和17.83%,显示化疗可能会招致EPCs大量动员、增殖、招募。作者注意到,绝大多数患者化疗因骨髓抑制不同程度地使用了粒细胞集落刺激因子,而化疗后第15天正处于骨髓功能抑制后的恢复期,骨髓抑制的代偿和自我修复以及外源性粒细胞集落刺激因子的使用都可能促使cEPCs增加[8-9]。化疗前、化疗后第7天以及化疗2个周期完成时,虽然cEPCs数量差异不显著,但不同患者治疗前后的cEPCs变化较大,提示化疗对cEPCs的影响并不一致。进一步的亚组分析发现,临床获益的患者,2个周期化疗后cEPCs较治疗前平均减少约19%;而化疗无效者,化疗后cEPCs较治疗前平均增加29%。作者认为,化疗前NSCLC细胞大量分泌VEGF、bFGF等促血管生成细胞因子,刺激EPCs增殖并迁移至肿瘤部位,外周血cEPC数量增加。化疗有效后,癌细胞生长受到抑制,促血管生成因子分泌减少,cEPCs减少;而化疗无效,肿瘤失控,促血管生成因子分泌增多,加之与化疗相关的血管损伤导致的代偿性或修复性促血管生成因子增多,造成cEPCs进一步增多。因此,有效的化疗可抑制EPCs动员入血,而无效化疗则导致cEPCs动员。另外,作者在分析化疗临床获益者和化疗无效者治疗前cEPCs时发现,化疗无效者治疗前cEPCs浓度显著高于临床获益者,显示治疗前的cEPCs数量影响化疗的效果。
无论化疗前或化疗过程中的cEPCs增多,均可能利于肿瘤血管的新生和损伤血管的修复,有助于肿瘤生长、转移,加速病情恶化,而不利于临床治疗的获益。因此,降低cEPCs数量,对cEPCs高的患者或在治疗期间加用抗血管生成药物,也许是一种有益的探索[10]。另外,EPCs 由于其独特的肿瘤趋化性及在肿瘤新生血管生成中的作用,使其可能成为肿瘤基因药物治疗的最佳载体及抗血管生成治疗肿瘤的靶点。随着对EPCs生物特性及肿瘤病理机制的深入研究,EPCs 将在肿瘤诊断、治疗和预测预后方面有着广阔的应用前景。
[1]Mund J A,Case J.The role of circulating endothelial progenitor cells in tumor angiogenesis.Curt Stem Cell Res Ther,2011,6(2):115-121.
[2]Nowak K,Rafat N,Belle S,et al.Circulating endothelial progenitor cells are increased in human lung cancer and correlate with stage of disease.Eur J Cardiothorac Surg,2010,37(4):758-763.
[3]Steurer M,Kern J,Zitt M,el a1.Quantification of circulating endothelial and progenitor cells:comparison of quantitative PCR and four—channel flow cytometry.BMC Res Notes,2008,1(3):71-78.
[4]Naum ov GN,B ender E. A model of human tumor dormancy:an angiogenic switch from the nonangiogenic phenotype.J Natl Cancer Inst,2006,98(5):316.
[5]Furstenberger G, von Moos R,Lucas R, et al. Circulating endothelial cells and angiogenic serum factors during neoadjuvant chemotherapy of primary breast cancer.Br J Cancer 2006,94(8):524-531.
[6]Yu D, Sun X, Qiu Y, et al. Identification and clinical significance of mobilized endothelial progenitor cells in tumor vasculogenesis of hepatocellular carcinoma.Clin Cancer Res,2007,13(3),3814-3824.
[7]Igreja C, Courinha M ,Cachaco AS, et al. Characterization and clinical relevance of circulating and biopsy-derived endothelial progenitor cells inLymphoma patients.H aem atologica,2007,92(4):469-477.
[8]Shaked Y,Tang T,Wolszynek J,et al.Contribution of granulocyte colony-stimulating factor to the acute mobilization of endothelial precursor cells by vascular disrupting agents.Cancer Res,2009, 69(19): 7524-7528.
[9]Okazaki T, Ebihara S, Asada M, et al. Granulocyte colonystimulating factor promotes tumor angiogenesis via increasing circulating endothelial progenitor cells and Grl+ CD11b+ cells in cancer animal models. Int Immunol,2006,18(1):1-9.
[10]Shaked Y,Henke E,Roodhart J M,et al.Rapid chemotherapyinduced acute endothelial progenitor cell mobilization:implications for antiangiogenic drugs as chemosensitizing agents.Cancer Cell, 2008, 14(3):263-273.
ObjectiveTo probe into the effects of chemotherapy on the circulating endothelial progenitor cells (cEPCs) in patients with non-small cell lung caner (NSCLC).MethodsThe number of the peripheral blood cEPCs was determined through the flow cytometer 1 day before chemotherapy,as well as on the 7th,15th,and 42nd days after starting the chemotherapy in the 51 cases of patients with advanced NSCLC that received paclitaxel combined with cisplatin chemotherapy. The definition of the molecular marker of cEPCs was CD34+/CDl33+/VEGFR-2+.ResultsThe number of the peripheral blood cEPCs at various time points during the chemotherapy cycle showed difference. The number of cEPCs reached a peak on the 15th day after chemotherapy (F=5.153,P=0.002),that reduced in chemotherapy benefi ciaries after chemotherapy (t=3.716,P<0.001),and that increased in those with disease progression (t=4.215,P<0.001);and the change of the number of cEPCs was related to the therapeutic effect of chemotherapy(r=0.708,P<0.001). The number of cEPCs before treatment was lower in chemotherapy benefi ciaries than in those who did not react to chemotherapy(t=5.081,P<0.001).ConclusionThe therapeutic effect of chemotherapy on NSCLC was closely correlated with the number of cEPCs,and monitoring the cEPCs in patients with NSCLC might be served as a novel indicator for judging the prognosis.
Non-small cell lung caner Angiogenesis Chemotherapy Circulating endothelial progenitor cells
314000 浙江省嘉兴市第一医院

