产脲酶芽胞杆菌的微波诱变育种
杜 康, 李广悦*, 丁德馨, 刁宁宁, 王永东, 胡 南
(1.南华大学 铀矿冶生物技术国防重点学科实验室,湖南 衡阳 421001;2.南华大学 核资源工程学院,湖南 衡阳 421001)
产脲酶芽胞杆菌的微波诱变育种
杜 康1,2, 李广悦1,2*, 丁德馨1,2, 刁宁宁1,2, 王永东1,2, 胡 南1,2
(1.南华大学 铀矿冶生物技术国防重点学科实验室,湖南 衡阳 421001;2.南华大学 核资源工程学院,湖南 衡阳 421001)
巴氏芽胞杆菌是目前微生物诱导碳酸钙沉淀(MICP)方法中应用最为热门的一种细菌。为提高巴氏芽胞杆菌尿素分解以及矿化能力,以巴氏芽胞杆菌YB-B为出发菌株,采用微波诱变育种技术,通过诱变菌株特性筛选及其遗传稳定性检测,成功选育出2株突变菌株YB-3和YB-4。与出发菌株相比,诱变菌株尿素分解能力较原菌株提高1.5倍左右,矿化能力提高114%。诱变菌株具有生长速度快,环境适应性强,矿化能力高等优点,这为MICP更广层次的应用奠定了坚实的基础。
微波育种;巴氏芽胞杆菌;尿素分解;微生物诱导碳酸钙沉淀(MICP)

1 材料与方法
1.1 材料
1.1.1 出发菌种 菌株SporoscarcinapasteuriiYB-B,芽胞杆菌菌属,是一种革兰阳性碳酸盐矿化菌[14],由南华大学铀矿冶生物技术国防重点学科实验室自主分离保存。
1.1.2 培养基 ①平板培养基:酵母提取物20 g,氯化铵10 g,琼脂20 g,超纯水1 000 mL,pH 9;②液体培养基:酵母提取物20 g,氯化铵10 g,超纯水1 000 mL,pH 9;③尿素水溶液:尿素60 g,超纯水1 000 mL,pH 9;④沉淀液:无水氯化钙55.5 g,尿素33 g,超纯水750 mL,pH 10。
1.2 方法
1.2.1 菌悬液的制备 挑取平板培养基上的YB-B菌株单菌落接种在液体培养基中,置于摇床恒温培养12 h至细菌成长对数期[15],在显微镜下用血球计数板计数,加无菌水调整菌液浓度为106个/mL,作为备用菌悬液。
1.2.2 微波诱变处理 在超净工作台内,移液枪吸取1 mL菌悬液置于已灭菌的2 mL透明离心管中,并将离心管置于装满冷水(4 ℃左右)的100 mL烧杯中,微波炉中辐照。辐照时采用低档(700 W、脉冲频率2 540 MHz),每隔20 s换水一次以抵消微波辐照对菌悬液产生的热致死效应。辐照时间依次为20、40、60、80、100、120和140 s,对照组不作辐照处理。超净工作台内将辐照过的菌悬液稀释至10-3~10-2梯度,取10 μL涂布平板培养基,将平板置于恒温培养箱中30 ℃培养2~3 d。观察菌株生长情况,统计菌株个数,计算致死率和正突变率。计算公式:
致死率(%)=

1.2.3 初筛菌株 在诱变菌株的平板培养基中挑选生长速度快、抑菌圈直径较对照组大的单个菌株,分别编号为YB-1、YB-2、YB-3、YB-4、YB-5和YB-6,依次接种到液体培养基中,30 ℃、120 r/min摇床培养12 h。
1.2.4 尿素分解速率实验 超净工作台内按体积分数为1%的接种量将1.2.3中已培养的菌悬液接种至100 mL液体培养基中,置于转速120 r/min的摇床中,分别在20和30 ℃培养16 h,蛋白核酸测定仪(Biophotometer eppendorf Germany)测定菌悬液的OD600值,按1∶9配成菌液-尿素水溶液,用DDS-11A型电导率仪测定5 min的电导率变化差值Δh,记录并计算尿素分解速率,与对照组进行比较,得到诱变菌株尿素分解能力提高的百分比。计算公式:

1.2.5 CaCO3晶体沉淀实验 将1.2.3中的菌悬液调OD600值至1.0,按1∶3(体积比)与沉淀液混合均匀,置于50 mL锥形瓶(混合液共40 mL)中,用脱脂棉塞住瓶口,于30 ℃恒温培养箱中静置24 h,取上清液2 mL于离心管中,微量冷冻离心机20 000 r/min离心2 min。取50 mL蒸馏水于250 mL锥形瓶中,加入2 mL 6 mol/L NaOH溶液,摇匀。取1 mL离心上清液加入到250 mL锥形瓶溶液中,加入少许Ca2+指示剂,摇匀,溶液显示为淡紫色。用0.1 mol/L的EDTA溶液滴定,记录EDTA溶液的消耗量Δe,计算溶液的Ca2+浓度,推算出单位OD600值形成的CaCO3晶体量,与对照组对比得出诱变菌株CaCO3晶体沉淀能力提高的百分比。计算公式:

1.2.6 遗传稳定性 将突变菌株连续培养5代,对每一代通过尿素分解速率实验和晶体沉淀实验检测突变菌株尿素分解能力和CaCO3晶体沉淀能力的变化,并与第一代诱变菌株进行对比,以此确定诱变菌株的遗传稳定性。
2 结果与分析
2.1 致死率与正突变率
出发菌株YB-B经微波辐照,得到各辐照时间段的致死率和正突变率,结果见图1。由图1可知,随着辐照时间的延长,致死率显著增大,当辐照时间为120 s时菌株致死率高达99.9%,140 s时菌株致死率达100%,此时所有菌株已全部死亡,因此辐照时间应控制在140 s以内。在辐照时间为20~80 s内,正突变率逐渐增大,在80 s时达到峰值38.16%,而此时致死率为98.5%,故80 s为最佳诱变时间。发生正突变的菌株,其生长速度快,菌株抑菌圈直径较对照组大,菌株活性强。实验过程中通过更换冷水抵消了微波产生的热效应,因此可以认为致死菌株是受到了微波的非热效应影响。此时,菌株内分子级各类物质之间快速振动或转动,使遗传物质发生变异,从而导致菌株显现突变特性[16]。当然并不是所有的突变都是正向的,突变菌株在平板培养基上的成长现象说明相当一部分突变菌株较对照组生长缓慢,抑菌圈较小,出于研究目的,特选取生长快、抑菌圈大的菌株为研究对象。

图1 YB-B菌株微波诱变的致死率和正突变率Fig.1 The fatality rate and positive mutation rate for microwave mutagenesis of YB-B strain
2.2 诱变菌株尿素分解速率
对初步挑选的6株诱变菌株进行尿素分解速率实验,与原菌株对照分析结果见图2。由图2可知,与原菌株相比,6株菌株的单位细菌(OD600=1.0)尿素分解速率都有所提高。其中菌株YB-3和YB-5分解速率都提高了1倍左右,而菌株YB-4的分解速率提高1.5倍,这说明微波辐照的确提高了单位菌株的尿素分解速率。其他4株菌株相比于原菌株也有不同程度的提高。由于对所有菌株采取了调节细菌密度OD600值到1.0,并控制外界条件一致,因此可以断定分解速率的提高的确是由于诱变菌株自身所产尿素分解酶增加而引起的,从而达到了提高菌株自身尿素分解能力的目的。

图2 诱变菌株的尿素分解速率Fig.2 Urease decomposition rate of mutant strains
2.3 诱变菌株矿化能力
对6株菌株进行CaCO3晶体沉淀实验,可得到不同的结晶沉淀量如图3所示。
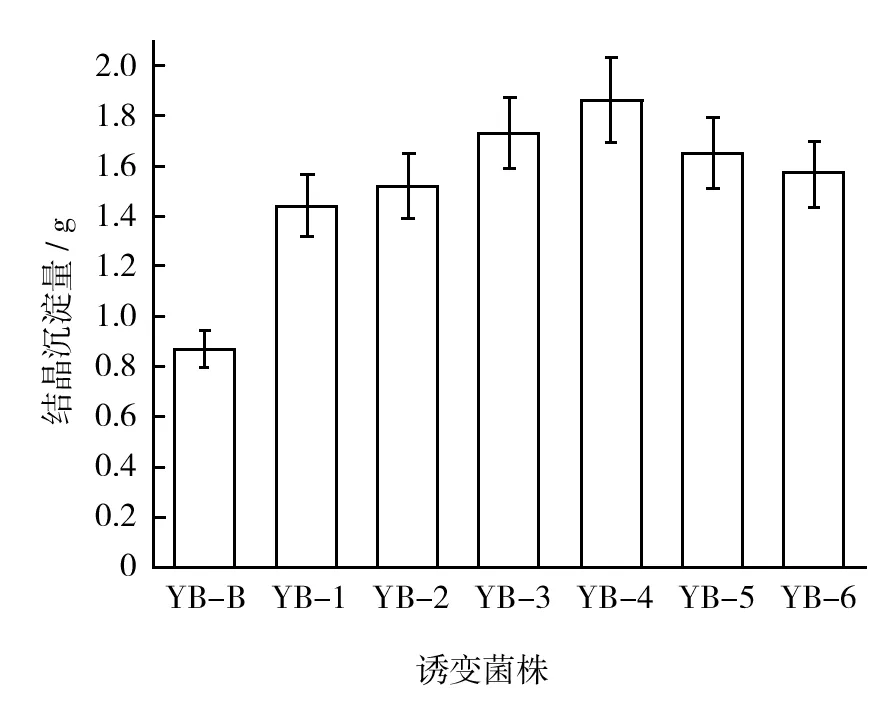
图3 诱变菌株的CaCO3结晶沉淀量Fig.3 CaCO3 crystal precipitation amount of mutant strains
相比图2中尿素分解速率的变化幅度,图3中的结晶沉淀量变化幅度有明显减小,这是由于沉淀液中游离的Ca2+对细菌所产脲酶活性具有抑制作用[17]。但从图3中仍然可看出,经过微波辐照的菌株YB-1~YB-6,其CaCO3结晶沉淀量有不同程度的增加。相对于菌株YB-B,菌株YB-1、YB-5和YB-6结晶沉淀量分别增加65%、74%和79%,菌株YB-3结晶沉淀量增加99%,而菌株YB-4结晶沉淀量增加114%,因此,菌株YB-3和YB-4作为具有超强矿化能力的优势菌株。
2.4 遗传稳定性检测
选择YB-3、YB-4突变菌株与出发菌株YB-B进行连续传代5次,对各代细胞CaCO3结晶沉淀能力进行试验,检测各代菌株的沉淀能力,结果见表1。

表1 30 ℃突变菌株CaCO3结晶沉淀 能力稳定性检测(g/L)Table 1 Stability test of crystal precipitation of CaCO3 for 30 ℃(g/L)
表1结果表明,优势菌株YB-3和YB-4经5次传代培养后仍然保持了较稳定的CaCO3结晶沉淀能力,这说明通过微波辐照诱变的菌株具有比较好的遗传稳定性,因此微波辐照诱变育种方法能较好地适用于选育特定功能的优势菌株。
5 结 论
本研究以芽胞杆菌YB-B为出发菌株,探究了不同的微波辐照时间芽胞杆菌尿素分解能力和矿化作用的影响,并与出发菌株进行了对照比较,得到了YB-3和YB-4两株突变菌株。实验数据表明,突变菌株和出发菌株相比,具有生长繁殖速度快、尿素分解能力高、矿化作用强等显著优势,并具有可靠的遗传稳定性。尿素分解和矿化实验说明,通过微波辐照选育的菌株使单位菌株的生产 能力从根本上获得了较大提升,这为微生物诱导矿化作用的研究提供了一种技术参考。
[1] 王瑞兴,钱春香,王剑云.微生物沉积碳酸钙研究[J].东南大学学报,2005,35(1):191-195.
[2] DeJong JT, Mortensen BM, Martinez BC,et al. Bio-mediated soil improvement[J].Ecol Eng,2010,36(2):197-210.
[3] Achal V, Mukherjee A, Reddy M S. Microbial concrete:way to enhance the durability of building structures[J].J Mater Civil Eng,2011,23:730-734.
[4] Phillips A J, Gerlach R, Lauchnor E, et al. Engineered applications of ureolytic biomineralization: a review[J].Biofouling,2013,29(6):715-733.

[6] Ghosh P, Mandal S, Chattopadhyay B D, et al. Use of microorganism to improve the strength of cement mortar[J].Cement Concrete Res,2005,35(10):1980-1983.
[7] De Muynck W, De Belie N, Verstraete W. Microbial carbonate precipitation in construction materials: a review[J].Ecol Eng,2010,36(2):118-136.
[8] 吴殿恺.微波诱变的实验研究与理论探讨[J].哈尔滨工业大学学报,1981,(3):88-99.
[9] 杨丽丽,尹宝华,侯文菊,等.芽胞杆菌诱变育种研究进展[J].山西农业科学,2012,40(7):804-806.
[10]梅林,陈芳,阚睿,等.枯草芽胞杆菌凝乳酶高产菌株的微波诱变[J].食品与发酵工业,2012,38(10):298.
[11]李永泉.微波诱变选育木聚糖酶高产菌[J].微波学报,2001,17(1):50-53.
[12]颜贤仔,余莉莉,张凤英.微波对枯草芽胞杆菌诱变效应的研究[J].江西农业大学学报,2005,27(6):857-860.
[13]贾红华,周华,韦萍.微波诱变育种研究及应用进展[J].工业微生物,2003,33(2):46-49.
[14]张振远,李广悦,丁德馨,等.一株碳酸钙矿化菌的分离与鉴定[J].南华大学学报(自然科学版),2014,02:30-33.
[15]陈杰,李广悦,张振远,等.1株尿素分解菌的分离及其生长特性[J].微生物学杂志,2014,34(2):37-40.
[16]李成,李红梅,弓爱君,等.苏云金芽胞杆菌诱变育种的初步研究[J].中国农学通报,2009,25(02):206-209.
[17]Ganendra G, De Muynck W, Ho A, et al. Formate Oxidation-Driven Calcium Carbonate Precipitation by Methylocystis parvus OBBP[J].Appl Environ Microb,2014,80(15):4659-4667.
Microwave Mutation Breeding for Urease-ProducingSporoscarcinapasteurii
DU Kang1,2, LI Guang-yue1,2, DING De-xin1,2, DIAO Ning-ning1,2, WANG Yong-dong1,2, HU Nan1,2
(1.KeyLab.forNat′lDefenseofBiotech.inUraniumMining&Hydrometallurgy,2.Schl.ofNuclearRes.Engin.,Uni.ofSouthChina,Hengyang421001)
Sporoscarcinapasteuriiis known as the most popular bacterium applied to microbial induced calcium carbonate precipitation (MICP) method in the present researches. In order to improve its ability of urea decomposition and biomineralization, two mutant strains YB-3 and YB-4 has been successfully bred based on theS.pasteuriistrain YB-B adopting microwave breeding technique, and determined and tested their genetic stability through special screening of the mutant strains. The capacity of urea decomposition had been increased 1.5 times or so and biomineralization by 114% respectively as compared with the starting strain YB-B. Moreover, the mutant strains have been proved possess significant advantages such as fast speed of growth, good environmental adaptability and high mineralization, these had laid a solid foundation for the wider aspect of application of the MICP.
microwave irradiation breeding;Sporoscarcinapasteurii; urea decomposition; microbial induced carbonate precipitation (MICP)
湖南省教育厅科学研究重点项目(13A083)
杜康 男,硕士研究生。研究方向为微生物岩土工程。E-mail:dukang5377@foxmail.com
* 通讯作者。男,博士,教授,硕土生导师。研究方向为铀矿开采及相关环境研究。Tel:0734-8281862,E-mail:lgyddk@163.com
2015-08-03;
2015-09-08
Q939.97
A
1005-7021(2016)03-0020-04
10.3969/j.issn.1005-7021.2016.03.004

