鱼类肠道铁载体高产菌株CB-EH-2的筛选与鉴定
李红芳, 翟秋倩, 门晋名,2, 韩晓红, 刘 丽, 李俊峰*
(1.青岛科技大学 化工学院,山东 青岛 266042;2.迪沙药业集团,山东 威海 264200)
鱼类肠道铁载体高产菌株CB-EH-2的筛选与鉴定
李红芳1, 翟秋倩1, 门晋名1,2, 韩晓红1, 刘 丽1, 李俊峰1*
(1.青岛科技大学 化工学院,山东 青岛 266042;2.迪沙药业集团,山东 威海 264200)
利用2216E限铁培养基从青岛近海海鱼肠道内筛选到1株铁载体高产菌株,命名为CB-EH-2。结合形态、生理生化特性、16S rRNA 基因序列同源性和系统发育分析将其初步鉴定为Cobetiaamphilecti。铬天青(CAS)法检测其铁载体的产生及对Fe3+的亲和能力。XAD-2 大孔径树脂提取铁载体,铁载体类型和拮抗活性分析显示,菌株CB-EH-2所产铁载体为异羟肟酸型,可显著抑制鳗弧菌等4种指示菌的生长。不同浓度2, 2′-联吡啶及铁离子对CB-EH-2的菌体量和铁载体产量具有较大的影响。本文首次报道C.amphilecti产生异羟肟酸型铁载体,CB-EH-2作为有益菌值得进一步研究。
Cobetiaamphilecti;铁载体;筛选;鉴定
水产品的抗生素或药物残留问题制约着水产养殖业的发展,从而使利用生态防治技术控制病原菌的生长成为养殖病害防治的研究重点[1]。生防技术往往是几种机制协同作用的结果,其中竞争营养、附着位点或产生拮抗物质是作用机制主要作用方式。大约1%~10%的鱼肠道细菌通过分泌多肽、细菌素、过氧化氢、抗生素和/或有机酸抑制肠道内其他微生物的生长[2]。铁载体作为拮抗物质的一种,在生防技术中受到广泛关注。它是由生活在开放环境中的好氧和兼性厌氧微生物在缺铁条件下,合成和分泌的一种小分子螯合物(<1 kDa),能够与铁元素紧密结合,实现铁的吸收和运输,具有高度特异性,有利于微生物在铁匮乏的环境中,与其他微生物竞争,获取充足的铁元素[3]。许多致病菌常常通过铁载体从宿主体液的铁结合蛋白来获取铁,然后通过特异性的细胞膜受体把铁运送到细胞内,从而导致宿主因缺铁而得病[3]。有益微生物通过产生更高亲和力的铁载体螯合环境中的铁来抑制致病菌生长[4-6]。实验表明荧光假单胞菌(Pseudomonasfluorescens)所产铁载体可减少杀鲑气单胞菌(Aeromonassalmonicida)引起的病害[7],抑制鳗弧菌(Vibrioanguillarum)的生长[8];橙色交替单胞菌(Alteromonasaurantia)[9]所产铁载体可抑制鱼类病原菌鳗弧菌w-1的生长。目前尚未见有关Cobetiaamphilecti分泌铁载体的报道。本研究对青岛近海海鱼肠道铁载体产生菌CB-EH-2进行了生理生化和基于16S rRNA基因序列系统发育分析;用XAD-2大孔径树脂色谱法获得了其铁载体粗品,并检测了其铁载体类型;同时验证了CB-EH-2分泌的铁载体对部分养殖病原菌的拮抗效果,对其在防治鱼类养殖病害中的应用提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源 铁载体产生菌CobetiaamphilectiCB-EH-2系本实验分离,指示菌鳗弧菌w-1由联合国教科文组织中国海洋生物工程中心提供,灿烂弧菌4501由山东大学(威海)海洋学院提供,其他为本实验保藏。
1.1.2 培养基 ① 2216E培养基(蛋白胨5 g,酵母粉1 g,磷酸高铁0.01 g,陈海水1 000 mL,pH 7.6,琼脂 18 g)121 ℃灭菌20 min备用;去铁固体培养基需加入30 g的8-羟基喹啉;液体培养基需用3%的8-羟基喹啉和三氯甲烷去铁;② LB培养基121 ℃灭菌20 min备用;③ Y去铁液体培养基:K2HPO42.0 g, (NH4)H2PO41.0 g,MgSO4·7H2O 0.1 g,酵母粉1.0 g,酸水解酪蛋白1.0 g,蔗糖 10.0 g,NaCl 35.0 g,超纯水1 000 mL,调节pH为7.6,并用8-羟基喹啉和三氯甲烷去铁,121 ℃灭菌20 min备用;④ M9培养基:Na2HPO43.0 g,NaCl 5.0 g,NH4Cl 10.0 g,超纯水1 000 mL,121 ℃灭菌20 min。冷却后加入下列无菌组分:20%葡萄糖10.0 mL,1 mol/L MgSO42.0 mL,1 mol/L CaCl20.1 mL,10%去铁水解酪蛋白20 mL。
1.1.3 主要试剂和仪器 Amberlite XAD-2 大孔树脂(北京北实纵横科技发展有限公司);用于PCR 扩增及其他分子生物学试剂(生工生物工程(上海)股份有限公司,即上海生工)。FBZ2002-UP标准试剂型超纯水系统(青岛富勒姆科技有限公司);WFZ UZ-2000型紫外可见光分光光度计(上海尤尼柯仪器有限公司);HZQ-Q全温振荡器 (哈尔滨市联电子技术开发有限公司);Alphalmager EC凝胶成像分析系统(Alpha Innotech Corporation,USA)。
1.2 方法
1.2.1 菌株的分离筛选 从青岛市姜戈庄码头购买近海捕捞的新鲜海鱼,立即带回实验室,无菌处理后进行解剖,取出完整鱼肠,无菌海水冲洗2遍,称重后,将肠道剪开,用少量无菌海水冲洗肠道2次,合并冲洗液;肠壁用无菌研钵研碎,加适量无菌海水。用无菌海水分别稀释成10-1、10-2、10-3的稀释液。分别从原液、10-1、10-2、10-3四个稀释度中吸取100 μL样品,涂布于去铁2216E平板上,28 ℃培养2~3 d,待菌落出现,观察4个稀释度下菌落的数目及种类,并计数。选择形态一致的菌落通过Z字划线法进行纯化,长出单菌落后,转接2216E斜面,待菌苔形成后,放入4 ℃冰箱备用。
1.2.2 铁载体的检测和定量分析 用铂金丝接种CB-EH-2的新鲜菌苔于去铁2216E液体(0.16 μmol/L FeCl3)培养基中,28 ℃、150 r/min摇床培养 48 h;发酵液经10 000×g 离心10 min,取上清液。异羟肟酸的检测采用Csáky[10]方法,儿茶酚类采用Arnow[11]方法,羧酸盐类采用Shenker等[12]的方法进行比色检测。利用Schwyn和Neilands改进的方法(CAS法)对上清液的铁载体进行定量检测[13],具体过程:上清液与CAS 检测液等体积混合,充分混匀,静置30 min后,测定630 nm处的吸光值(As),未接种的2216E培养基作为对照调零,同时未接种的2216E培养基与等体积CAS 检测液混合的吸光值作为参比值(Ar),铁载体活性单位的计算方式如下[14]:
铁载体量(%)=((Ar-As)/Ar)×100%
1.2.3 菌株CB-EH-2的形态及生理生化特征 参照文献[15]进行观察和鉴定。
1.2.4 16S rRNA基因的序列分析和数据处理 参照文献[16]的方法提取菌株CB-EH-2基因组DNA,以 P1 (5′-AGAGTTTGATCCTGGTCAGAACGCT-3′)和 P2 (5′-CTACGGCTACCTTG TTACGA-3′) 作为引物进行扩增。PCR反应采用50 μL体系,扩增条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,30次循环;72 ℃ 10 min。回收扩增产物,与pUCm-T质粒连接,转化E.coliJM109感受态细胞,采用蓝白斑筛选法获得阳性克隆,送上海生工测序。将测序结果用BLAST 软件与GenBank 数据库进行相似性分析,并与数据库中获得的相近模式种16S rRNA基因序列用CLUSTAL W进行多序列匹配排列(Multiple alignments)分析[17],用MEGA 5.0中的Neighbor-Joining法构建系统进化树,使用Kimura 双参数模型计算各序列遗传距离,并通过自举分析(Bootstrap)进行置信度检测,自举数据集为1 000次[18]。
1.2.5 铁载体的制备 铁载体的制备参照文献[19]的方法略有改进。先把活化好的XAD-2 大孔径树脂加入1.2.2制备的无菌铁载体上清液中,20 ℃、120 r/min振荡过夜,CAS法测试上清液中铁载体是否吸附完全。把吸附完成的XAD-2装柱(3.0 cm×60.0 cm 玻璃层析柱),先用超纯水洗涤2个柱体积,除去未被吸附的杂质和其他非铁载体物质,然后分别用25%、50%、75% 和100%的甲醇/水洗脱,流速0.3 mL/min,每个梯度100 mL,分步收集洗脱液,洗脱结束后,各洗脱液旋转蒸发除去甲醇和水并称重。5 mL超纯水溶解,0.22 μm滤膜过滤除菌,4 ℃保存备用。
1.2.6 抑菌活性的测定-扩散法 接种指示菌于LB 或者2216E液体培养基中,28 ℃培养过夜,取100 μL菌液均匀涂布于LB或者2216E平板上,将无菌滤纸片(d=6 mm)放置于涂有指示菌的平板上,取铁载体粗品20 μL滴加到滤纸片上,28 ℃培养24 h后,测量抑菌圈直径。
1.2.7 菌株CB-EH-2的特性研究 ①不同培养基对菌株CB-EH-2产铁载体能力的影响:分别配制去铁和不去铁2216E液体培养基、Y去铁液体培养基和M9培养基,250 mL三角瓶分装50 mL培养基,121 ℃灭菌20 min备用。接种等量CB-EH-2,28 ℃、150 r/min培养,24 h取样1次,每次3 mL,10 000×g离心10 min,取上清,连续取样4次。通过CAS法测定铁载体产量。每个实验重复两次。②2,2-联吡啶对菌株CB-EH-2产铁载体能力的影响:向Y去铁液体培养基中分别加入2, 2-联吡啶,使最终浓度分别为0、50、100、200、300 μmol/L,121 ℃灭菌20 min备用。其他操作同①。③铁离子浓度对菌株CB-EH-2产铁载体能力的影响:向Y去铁液体培养基中分别添加Fe3+,使其最终浓度分别为0、0.01、0.1、1、2 mmol/L,121 ℃灭菌20 min备用。其他操作同①。上述与铁载体产生、检测有关实验中所用的试剂和培养基均用双蒸去离子水配制,所有玻璃器具均在6 mol/L 盐酸中浸泡3 d,并用双蒸去离子水多次淋洗以除去痕量的铁离子。
2 结果与分析
2.1 铁载体高产菌株的筛选鉴定
采用CAS液体检测法(图1),从青岛近海海鱼肠道内筛选分离得到铁载体量超过50%的菌株45株,其中,菌株CB-EH-2在缺铁培养基中的铁载体量高达84.12%,选择该菌株进行深入研究。CB-EH-2的菌落特征:乳黄色、凸起、圆形、表面湿润、光滑(图2),菌体细胞呈短杆状,革兰染色阴性(图2)。经PCR扩增,菌株CB-EH-2的16S rRNA基因序列经纯化处理后的片段长约1 446 bp,在NCBI上进行BLAST比对(http://www.ncbi.nlm.nih.gov/BLAST/),发现该菌株与盐单胞菌科(Halomonadaceae)中Cobetia属的多个不同种均具有99%相似性,结合生理生化和形态学特征将CB-EH-2初步鉴定为Cobetia属。将CB-EH-2的16S rRNA基因序列与已报道Cobetia属中几个种的模式菌株16S rRNA基因序列,采用MEGA 5.1软件 构建系统发育树(图3),分析结果显示,所分离的CB-EH-2与C.amphilecti形成的群的1 000次自举分析(Bootstrap)置信度支持率达99%,因此,进一步确定菌株CB-EH-2可能属于C.amphilecti。

图1 发酵上清液的CAS检测Fig.1 The CAS assay of the supernatant 1:富铁对照;2:富铁发酵上清液;3:缺铁对照;4:缺铁发酵上清液;5:富铁空白;6:缺铁空白 1: the iron-rich media control; 2: the iron-rich supernatant; 3: the iron control; 4: the iron-deficient supernatant; 5: the iron-rich blank;6:the iron-deficient blank

图2 菌株CB-EH-2的菌落(A)和菌体(B)形态Fig.2 The colony (A) and cell (B) of strain CB-EH-2
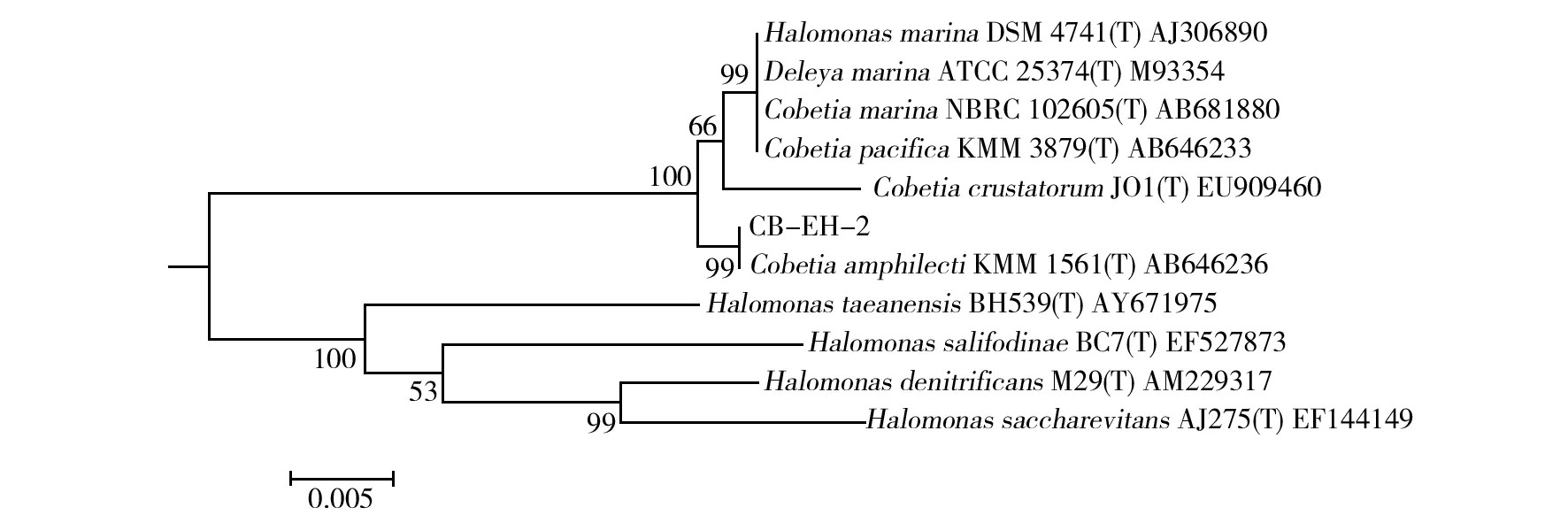
图3 菌株CB-EH-2基于16S rRNA基因的系统发育树Fig.3 Phylogenetic tree of strain CB-EH-2 and related type species based on the 16S rRNA gene sequences
2.2 铁载体的类型检测
采用铁载体特异性检测方法显示Csáky法检测结果为阳性,而其他铁载体类型检测反应均显阴性,说明菌株CB-EH-2所产铁载体只有异羟肟酸一种类型。同时,以盐酸羟胺为底物,绘制标准曲线,通过对菌株CB-EH-2的发酵上清液进行分析检测,发现该菌株所产异羟肟酸类铁载体的量达到了6.30 mg/L,为产铁载体优势菌株。
2.3 铁载体的制备及其抗菌作用
去细胞发酵上清液经过XAD-2大孔径树脂吸附,去离子水洗涤后,分别用不同浓度的甲醇洗脱,洗脱液旋转蒸发仪蒸干,超纯水溶解,分别标记为A、B、C和D,无菌水为对照(标记为E),再分别以金黄色葡萄球菌、大肠埃希菌、鳗弧菌w-1、灿烂弧菌4501为指示菌,检测其抑菌活性,结果见图4。样品A、B无抑菌活性;样品C仅能部分抑制大肠埃希菌和灿烂弧菌4501的生长;而样品D对4种指示菌都有抑制作用,抑菌圈分别为16、16、12、10 mm,抑菌作用明显,说明活性样品主要集中在100%甲醇洗脱液中。

图4 不同组分的抑菌结果
2.4 菌株CB-EH-2的特性研究
2.4.1 不同培养基对菌株CB-EH-2产铁载体能力的影响 不同培养基由于组分不同,对铁载体的分泌也有一定的影响,为了获得高铁载体产量,分别考察了2216E去铁和不去铁培养基、去铁Y培养基和M9培养基,结果如图5所示。在发酵第3天,菌株CB-EH-2在去铁Y培养基和M9培养基中铁载体含量最高分别达到85.53%和79.07%;2216E去铁培养基只有到第4天才达到36.40%;而在2216E不去铁培养基中,菌株不产铁载体。从发酵时间和铁载体产量综合考虑,随后的实验均选择Y去铁培养基作为菌株CB-EH-2的发酵培养基。

图5 不同培养基对菌株CB-EH-2 产铁载体的影响Fig.5 Effect of different media on siderophore products of strain CB-EH-2
2.4.2 铁离子浓度对菌株CB-EH-2产铁载体能力的影响 在去铁的Y培养基中加入不同浓度铁离子,研究铁离子对菌株CB-EH-2生长和产铁载体的影响,结果如图6、7所示。铁离子浓度对菌株的菌体产量影响不大,只有当铁离子浓度超过2 mmol/L,菌体量才有所下降(图6),但对菌株的铁载体产量有很大影响,当铁离子浓度超过10 μmol/L时,发酵液中铁载体量明显下降(图7),当铁离子浓度超过1 mmol/L时,48 h后发酵液中检测不到铁载体。菌株CB-EH-2铁载体产量随铁离子浓度增加而减少的趋势符合微生物对铁离子吸收的规律,铁载体转运系统只有在缺铁条件下才能启动[3]。

图6 不同铁离子浓度对菌株 CB-EH-2生长的影响Fig.6 Effects of different concentrations of Fe3+on the growth of strain CB-EH-2

图7 不同铁离子浓度对菌株 CB-EH-2产铁载体的影响Fig.7 Effects of different concentrations of Fe3+on the siderophore products of strain CB-EH-2
2.4.3 2, 2′-联吡啶对菌株CB-EH-2产铁载体能力的影响 在Y培养基中加入不同浓度的2, 2′-联吡啶,考察其对菌株CB-EH-2菌体生长及铁载体产量的影响,结果如图8、9所示。当2, 2′-联吡啶浓度为50 μmol/L时,CB-EH-2在48 h的菌体产量最高,随后,随螯合剂浓度的增加,CB-EH-2的生长量(OD600)逐渐减小,当其浓度达到200 μmol/L时,细胞停止生长(图 8),发酵液中也检测不到铁载体(图9)。在低浓度(<100 μmol/L)时,发酵液中的铁载体含量在24 h内随2,2′-联吡啶浓度的增大而增加,且在100 μmol/L时最高,达到84.84%,随后逐渐下降,但铁载体量一直维持在较高水平(图9)。说明培养基中添加微量的2,2′-联吡啶(<100 μmol/L),能够刺激CB-EH-2菌体细胞生长并高产铁载体,当浓度过高时(>200 μmol/L),可以抑制CB-EH-2菌体细胞生长且无铁载体产生。
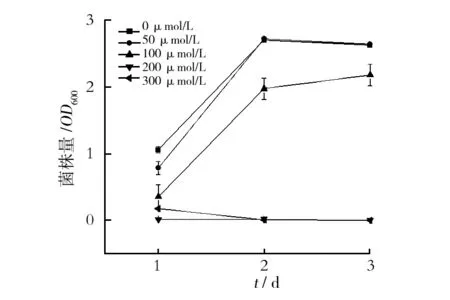
图8 不同浓度的2,2′-联吡啶对菌株 CB-EH-2生长的影响Fig.8 Effects of different concentrations of 2,2′-bipyridine on the growth of strain CB-EH-2
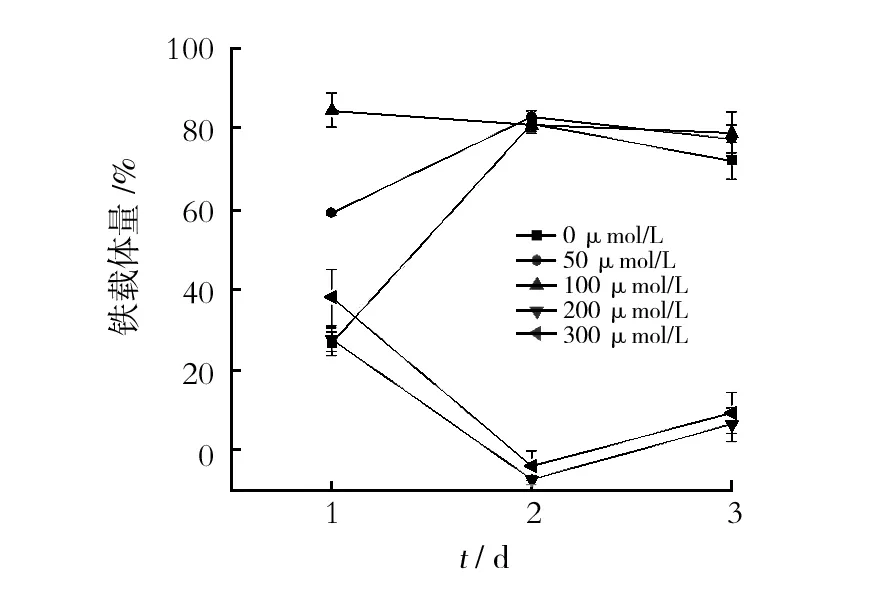
图9 不同浓度的2,2′-联吡啶对菌株CB-EH-2 铁载体生成量的影响Fig.9 Effects of different concentrations of 2,2′-bipyridine on the siderophore products of strain CB-EH-2
3 讨 论
本研究采用缺铁平板从青岛近海海鱼肠道筛选得到1株能显著抑制金黄色葡萄球菌、大肠埃希菌和鳗弧菌生长的铁载体产生菌CB-EH-2,结合生理生化、形态学特征和基于16S rRNA基因序列分析等方法对CB-EH-2进行了鉴定,但是由于Blast比对结果显示CB-EH-2的16S rRNA基因序列与GenBank中Cobetia属多个种的相似性都在99%,因此不能直接明确其在种水平的分类地位。本研究通过CB-EH-2的16S rRNA基因序列与Cobetia属已报道种的模式菌株的16S rRNA基因序列构建系统发育树,经过分析明确了其分类地位(图3)。
通过XAD-2 大孔径树脂吸附层析法获得了CB-EH-2所产铁载体粗品,与Julia等[20]所得结果相同,铁载体主要集中在100%的甲醇洗脱液中,活性检测发现其对4种指示菌都具有抑菌活性,与研究者之前对橙色交替单胞菌(A.aurantia)A18所做的研究结果相似[21]。同时,Wang等[6]也发现出芽短梗霉(Aureobasidiumpullulans)所产铁载体可以抑制海洋动物病原菌鳗弧菌和副溶血弧菌的生长;用特异性方法检测了其铁载体类型,明确了其主要的功能基团为羟肟基,但对其铁载体的详细结构研究还需要借助液质或气质联用、核磁共振等分析仪器[19]。
微生物是否分泌铁载体与其所处环境中的铁离子浓度密切相关。研究表明,多数微生物能够在缺铁环境中产生铁载体,用于螯合环境中微量的铁离子[22-23],该现象在本研究中得到了进一步验证,铁离子浓度对CB-EH-2的菌体产量略有影响,但是对其铁载体产量影响非常大,当铁离子浓度过多时,菌株不再分泌铁载体,说明铁载体只能在缺铁的条件下产生,当环境中的铁离子浓度足够其生长繁殖所用时,就不需要合成铁载体[24-25]。在培养基中添加不同浓度的2, 2′-联吡啶进一步验证了这一事实,上述实验结果与橙色交替单胞菌A18的特性一致[21]。
C.amphilecti是2013年报道的Cobetia属的一个新种[26],国外对该菌的研究目前也处于起步阶段。已有研究表明,与其同属的Cobetiamarina在污水处理与生物修复方面具有重要的应用潜力[27-28],C.marinaDSMZ 4741 和C.pacificaKMM 3879T可分泌结构特殊的多糖[29-30],但作为产铁载体的优势菌株,目前国内外尚未见相关文献报道,因此对CB-EH-2在生物防治方面做进一步的深入研究具有一定的理论和应用价值。
[1] Balcázar JL, de Blas I, Ruiz-Zarzuela I, et al. The role of probiotics in aquaculture[J]. Veterinary Microbiology, 2006, 114 (3): 173-186.
[2] Kesarcodi-Watson K, Kaspar H, Lategan ML, et al. Probiotics in aquaculture: the need, principles and mechanisms of action and screening processes[J]. Aquaculture, 2008, 274(1): 1-14.
[3] Neilands JB. Siderophores: structure and function of microbial iron transport compounds[J]. Journal of Biological Chemistry, 1995, 270 (45): 26723-26726.
[4] Sugita H, Hirose Y, Matsuo N, et al. Production of the antibacterial substance byBacillussp. strain NM12, an intestinal bacterium of Japanese coastal fish[J]. Aquaculture, 1998, 165(3): 269-280.
[5] Vijayan KK, Bright Singh IS, Jayaprakash NS, et al. A brackishwater isolate ofPseudomonasPS-102, a potential antagonistic bacterium against pathogenic vibrios in penaeid and non-penaeid rearing systems[J]. Aquaculture, 2006, 251 (2-4):192-200.
[6] Wang WL, Chi ZM, Chi Z, et al. Siderophore production by the marine-derivedAureobasidiumpullulansand its antimicrobial activity[J]. Bioresource Technology, 2009, 100(9): 2639-2641.
[7] Smith P, Davey S. Evidence for the competitive exclusion ofAeromonassalmonicidafrom fish with stress-inducible furunculosis by aPseudomonasfluorescent[J]. Journal of Fish Diseases, 1993, 16(6): 521-524.
[8] Gram L, Melchiorsen J, Spanggaard B, et al. Inhibition ofVibrioanguillarumbyPseudomonasfluorescentAH2, a possible probiotic treatment of fish[J]. Applied and Environmental Microbiology, l999, 65(3): 969-973.
[9] 李俊峰,李红芳,姚淑敏,等. J61321(Alteromonasaurantia)菌株产铁载体培养条件的研究[J]. 青岛科技大学学报(自然科学版),2007, 28(1): 20-24.
[10]Csáky TZ. On the estimation of bound hydroxylamine in biological materials[J]. Acta Chem Scand, 1948, 2: 450-454.
[11]Arnow LE. Colorimetric determination of the components of 3, 4-dihydroxyphenylalanine-tyrosine mixtures[J]. Journal of Biological Chemistry, 1937, 118 (2): 531-537.
[12]Shenker M, Oliver I, Helmann M, et al. Utilization by tomatoes of iron mediated by a siderophore produced byRhizopusarrhizus[J]. Journal of Plant Nutrition, 1992, 15(10): 2173-2182.
[13]Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores[J]. Analytical biochemistry, 1987, 160(1): 47-56.
[14]Takahiro Y, Kenichiro H, Hiroshi O. Dissolution of iron hydroxides by marine bacterial siderophore[J]. Chemical Geology, 2002, 184 (1-2): 1-9.
[15]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001: 349-388.
[16]Edwards U, Rogall T, Bocker H, et al. Isolation and direct complete nucleotide determination of entire genes. Characterization of a gene coding for 16S ribosomal DNA[J]. Nucleic Acids Research, 1989, 17(19): 7843-7853.
[17]Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 1994, 22(22):4673-4680.
[18]Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) Software Version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8):1596-1599.
[19]Moriah Sandy, Alison Butler. Chrysobactin Siderophores Produced byDickeyachrysanthemiEC16[J]. Journal of natural products, 2011, 74(5): 1207-1212.
[20]Julia M. Gauglitz, Hongjun Zhou, Alison Butler. A suite of citrate-derived siderophores from a marineVibriospecies isolated following the Deepwater Horizon oil spill[J]. Journal of Inorganic Biochemistry, 2012, 107(1): 90-95.
[21]Li JF, Chi ZM, Li HF. Characterization of a mutant ofAlteromonasaurantiaA18 and its usage in mariculture[J]. Journal of Ocean University of China, 2008, 7(1):55-59.
[22]Linda Johnson. Iron and siderophores in fungal-host interactions[J]. Mycological Research, 2008, 112(2): 170-183.
[23]Sharmistha B, Aisha F, Nasreen ZE, et al. Iron acquisition, assimilation and regulation in mycobacteria[J]. Infection, Genetics and Evolution, 2011, 11: 825-838.
[24]Martinez JS, Zhang GP, Holt PD, et al. Self-Assembling Amphiphilic Siderophores from Marine Bacteria[J]. Science, 2000, 287(5): 1245-1247.
[25]Ito Y, Butler A.Structure of synechobactins, new siderophores of the marine cyanobacteriumSynechococcussp. PCC 7002[J]. Limnology and Oceanography, 2005, 50(6): 1918-1923.
[26]Romanenko LA, Tanaka N, Svetashev VI, et al. Description ofCobetiaamphilectisp. nov.,Cobetialitoralissp. nov. andCobetiapacificasp. nov., classification ofHalomonashaloduransas a later heterotrophic synonym ofCobetiamarinaand emended descriptions of the genusCobetiaandCobetiamarina[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(1): 288-297.
[27]Jens Friedrichs, Andrea Zieris, Silvana Prokoph, et al. Quantifying the Effect of Covalently Immobilized Enzymes on Biofilm Formation by Atomic Force Microscopy-Based Single-Cell Force Spectroscopy[J]. Macromolecular Rapid Communications, 2012, 33(17): 1453-1458.
[28]Fumihisa Kobayashi, Teruya Maki, Yoshitoshi Nakamura. Biodegradation of phenol in seawater using bacteria isolated from the intestinal contents of marine creatures[J]. International Biodeterioration & Biodegradation, 2012, 69(4): 113-118.
[29]Florian Lelchat, Stéphane Cérantola, Christophe Brandily, et al. The marine bacteriaCobetiamarinaDSMZ 4741 synthesizes an unexpected K-antigen-like exopolysaccharide[J]. Carbohydrate Polymers, 2015, 124(6): 347-356.
[30]Maxim S. Kokoulin, Anatoliy I. Kalinovsky, Nadezhda A. Komandrova, et al. The sulfated O-specific polysaccharide from the marine bacteriumCobetiapacificaKMM 3879T[J]. Carbohydrate Research, 2014, 387(1): 4-9.
Screening and Identification of High Sidero-Carrier High-Producing Bacteria CB-EH-2 from Intestinal Tracts of Marine Fish
LI Hong-fang1, ZHAI Qiu-qian1, MEN Jin-ming1,2, HAN Xiao-hong1, LIU Li1, LI Jun-feng1
(1.Coll.ofChem.Engin.,QingdaoUni.ofSci. &Technol.,Qingdao266042; 2.DishaPharm.Group,Weihai264200)
A high sidero-carrier high-producing bacterial strain was screened from the intestinal tracts of marine fish using iron-limited 2216E medium, and named as CB-EH-2, initially identified asCobetiaamphilectiwith morphological, physiological, and biochemical features, 16S rRNA gene sequence homology and phylogenetics analysis. The chrome azurol S (CAS) assay was used to detect the sidero-carrier production and its affinity to Fe3+. Sidero-carrier produced by CB-EH-2 were isolated from the cell-free culture supernatant by adsorption to Amberlite XAD-2 resin. Antagonistic activity and type of sidero-carrier from CB-EH-2 were analyzed. The results show that CB-EH-2 produced hydroxamate-type sidero-carrier against four indicator stains includingStaphylococcusaureus,E.coli,VibrioanguillarumandVibriosplendidus. Different concentrations of 2, 2′-bipyridine or Fe3+have a great influence on the growth and the sidero-carrier production of CB-EH-2.C.amphilectiwas the first reported to produce hydroxamate-sidero-carrier, and CB-EH-2 was worthy to study further as probiotic.
Cobetiaamphilecti; sidero-carrier; screening; identification
山东省高校科技计划项目(J14LE59);青岛市应用基础研究计划项目(12-1-4-3-(3)-jch);山东省科技发展计划项目(2015GSF121030)
李红芳 女,实验师,硕士研究生。从事应用微生物学研究。E-mail: lihongfang@126.com
* 通讯作者。男,讲师,博士,硕士生导师。主要从事海洋微生物活性物质研究。Tel: 0532-84023030,E-mail:Lijf1999@qust.edu.cn
2015-08-08;
2015-09-14
Q939.1
A
1005-7021(2016)03-0032-07
10.3969/j.issn.1005-7021.2016.03.006

