水溶性的半胱氨酸-β-环糊精铂配合物的合成及生物活性研究
赵美霞,姚文静,朱冰洁,陈迪凤,张亚宏
(河南大学 河南省天然药物与免疫工程重点实验室,河南 开封 475004)
水溶性的半胱氨酸-β-环糊精铂配合物的合成及生物活性研究
赵美霞,姚文静,朱冰洁,陈迪凤,张亚宏
(河南大学 河南省天然药物与免疫工程重点实验室,河南 开封 475004)
利用半胱氨酸修饰的β-环糊精与K2PtCl4反应得到了水溶性的铂配合物(Pt(L-Cys-β-CD)Cl2).通过质谱、元素分析和核磁等手段对合成的铂配合物进行表征.利用MTT法对该铂配合物的抗肿瘤活性进行研究.主要选择K562,HepG2和7701三种细胞对这种铂配合物的细胞毒性进行研究,结果表明该铂配合物具有较高的细胞抑制率.其在K562细胞中的IC50值为(89.5 ± 2.6) μmol/L.更有意义的是,这种铂配合物对正常细胞7701的细胞毒性要明显低于另外两种癌细胞.因此,该类铂配合物有望作为潜在的抗肿瘤药物.
半胱氨酸;β-环糊精;铂配合物;生物活性研究;抗肿瘤药物
作为抗肿瘤药物,铂配合物的发展已经成为人们关注的焦点,基于铂的抗肿瘤药物已有很多报道[1-5].为了更有效的提高其抗肿瘤活性,铂配合物应该被转移进入细胞内,同时要具有较好的水溶解性[6-7].目前,提高疏水抗肿瘤药物的水溶性最常用的方法是利用载体或进行生物分子修饰,但是很多载体系统由于需要比较复杂的结构,或者由于较差的体内选择性,使其生物应用受到限制[8].通过链接生物基团 (例如氨基酸,多肽,嘌呤和嘧啶等) 可以得到具有靶向性的铂配合物,即在癌细胞中具有较好活性而在正常细胞中具有较低的细胞毒性[9-11].并且很多生物基团修饰的铂配合物可以有效的与DNA结合[12-13].
β-环糊精 (β-CD) 是一种由7个葡萄糖单元组成的寡糖,是由疏水的空腔和一个亲水的外表面组成的环状低聚糖.β-CD可以用作药物赋形剂提高疏水性药物分子的溶解度,稳定性和生物利用度[14-16].本文中我们把配体半胱氨酸修饰到β-CD上,以考察这种生物活性配体的存在是否可调节铂复合物细胞毒性.半胱氨酸修饰的β-CD可提高铂配合物的溶解性和稳定性,同时可以更好的与铂结合.我们利用质谱、元素分析和核磁对合成的配合物进行了表征.此外,我们对Pt(L-Cys-β-CD)Cl2进行了细胞毒性研究,结果表明这种铂配合物具有较高的细胞抑制率,同时具有一定的细胞选择性,即在正常细胞中的细胞毒性低于在癌细胞中的细胞毒性.
1 实验部分
1.1 化学药品和试剂
β-CD,对甲苯磺酰氯,三乙醇胺,L-Cysteine (L-Cys)和K2PtCl4购自上海化学试剂厂.β-CD反应之前利用二次蒸馏水重结晶3次,然后95 ℃干燥12 h.其他有机溶剂购于EM科学试剂.胎牛血清(FBS)和DMEM血清购自Invitrogen,MTT购自Sigma.
1.2 配体半胱氨酸修饰的β-CD的制备
半胱氨酸修饰的β-CD的制备方法如下:L-Cys和对甲苯磺酰氯环糊精以1∶3的比例溶于30 mL水和20 mL三乙醇胺的混合溶液中,氮气保护条件下,加热到85 ℃搅拌反应24 h,点板监测反应进程.低压蒸出大部分溶剂,然后在剧烈搅拌条件下,把剩余液体倒入至500 mL无水乙醇中,1 h后把该液体置于4 ℃冰箱中,18 h后得到大量浅黄色沉淀.离心得到浅黄色固体产品,用去离子水做洗脱液过G25葡聚糖柱,然后再用水和乙醇的混合溶液重结晶3次,得到纯净的固体产品,产率为69.5% (L-Cys-β-CD).
1.3 半胱氨酸修饰的β-CD铂配合物的合成
取0.5 mmol半胱氨酸修饰的β-CD和0.5 mmol的K2PtCl4溶解在50 mL水中,60 ℃条件下避光搅拌48 h.然后,反应液冷却至室温.离心得固体产物,然后过G-25柱子纯化得到黄色固体产物,产率为63.6%.
[Pt(L-Cys-β-CD)Cl2]·8H2O,1H NMR (DMSO-d6, TMS):δ= 1.02~1.24 (m, 2H), 2.72~2.88 (m, 2H), 3.12~3.15 (m, 2H), 3.26~3.62 (m, 45H), 4.26~4.54 (m, 7H), 4.82~4.91 (m, 7H), 5.65~5.91 (m, 14H), 7.93 (m, 1H); 元素分析 (%), C45H75Cl2N4O36PtS·8H2O: 理论值: C 32.79, H 5.56, N 0.85; 实验值: C 32.91, H 5.42, N 0.91.
1.4 细胞培养
K562,HepG2和7701细胞用含10% (体积比) 胎牛血清 (FBS) 的DMEM培养基于培养瓶中培养,其中含有1% (体积比) 的双抗 (每毫升69 μg青霉素和100 μg链霉素).将细胞置于37 ℃,含5% CO2且湿度为90%的培养箱中孵育.
1.5 细胞毒性研究
细胞毒性采用如文献中所述MTT法测定[17].细胞培养传代3、4次后,当细胞生长到对数期时,将细胞用0.25%胰蛋白酶消化成单细胞悬液,采用血球计数板进行活细胞计数,调整活细胞浓度为5 × 104/mL接种于96孔培养板中,每孔100 μL,于37 ℃,含5% CO2且湿度为90%的培养箱中培养24 h后,吸出旧培养基,再分别加入用培养基稀释的不同浓度的铂配合物 (10、50、100、150、200 μmol/L).样品的具体制备方法如下,样品溶于DMSO中,每个样品设置3个复孔.加入样品的96孔板置于37 ℃,含5% CO2的培养箱中孵育48 h,然后加入MTT 20 μL/孔 (2.5 g/L),4 h后弃上清液,加入DMSO 100 μL/孔,振荡5 min左右,用M200酶标仪测定OD值,波长设置为570 nm和690 nm双波长.没有加入样品的孔的细胞存活率作为对照,设为100%.
2 结果与讨论
2.1 Pt(L-Cys-β-CD)Cl2铂配合物的合成与表征
铂配合物Pt(L-Cys-β-CD)Cl2通过K2PtCl4与配体L-Cys-β-CD反应得到 (图1).利用质谱和核磁对其进行了结构表征.电喷雾质谱(ESI-MS)是一种表征铂配合物形成的重要方法,质谱结果表明,m/z1 502.1的峰为Pt(L-Cys-β-CD)Cl2的离子峰,m/z780.9的峰归属于[Pt(L-Cys-β-CD)Cl2]2+吸附一个钠离子和两个水分子的离子峰,而m/z751.0为[Pt(L-Cys-β-CD)Cl2]2+的离子峰.
然后我们又利用核磁氢谱对Pt(L-Cys-β-CD)Cl2的形成进行了表征,表明了Pt(L-Cys-β-CD)Cl2的稳定存在.
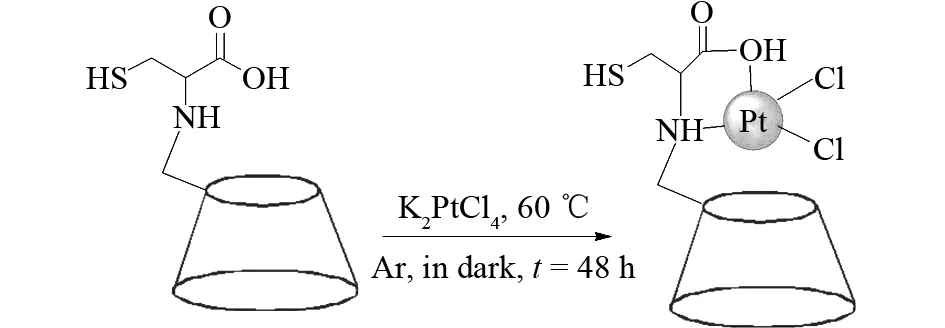
图1 Pt(L-Cys-β-CD)Cl2铂配合物合成示意图
2.2 Pt(L-Cys-β-CD)Cl2铂配合物的细胞毒性研究
我们利用3种细胞(K562, HepG2 和 7701)对Pt(L-Cys-β-CD)Cl2铂配合物的细胞毒性进行了研究.利用MTT法得到的Pt(L-Cys-β-CD)Cl2铂配合物的IC50值列于表1中.当Pt(L-Cys-β-CD)Cl2铂配合物的浓度为100 μmol/L时,对3种细胞的成活率的结果见图2.由图中结果我们可以看到,Pt(L-Cys-β-CD)Cl2铂配合物对细胞的成活率具有一定的抑制作用.有趣的是Pt(L-Cys-β-CD)Cl2铂配合物对正常细胞7701细胞的抑制率明显低于两种癌细胞.总之,我们合成的水溶性的Pt(L-Cys-β-CD)Cl2铂配合物具有一定细胞选择性.
表1 Pt(L-Cys-β-CD)Cl2铂配合物的细胞毒性
Table 1 Cytotoxicity activity of Pt(L-Cys-β-CD)Cl2complex

SampleIC50(μmol/L)K562HepG27701Pt(L-Cys-β-CD)Cl289.5±2.692.3±3.1128.3±2.8

图2 Pt(L-Cys-β-CD)Cl2配合物浓度为100 mol/L时3种细胞的成活率结果
3 结论
设计合成了水溶性半胱氨酸修饰的β-CD铂配合物,其具有较好的抑制细胞生长的作用.质谱、核磁及元素分析结果均表明我们成功合成了Pt(L-Cys-β-CD)Cl2铂配合物.同时这种Pt(L-Cys-β-CD)Cl2铂配合物具有一定的细胞选择性.因此,这种铂配合物可以作为潜在的抗肿瘤药物.
[1] MATESANZ A I, TAPIA S, SOUZA P.First 3,5-diacetyl-1,2,4-triazol derived mono(thiosemicarbazone) and its palladium and platinum complexes: Synthesis, structure and biological properties [J].Inorg Chim Acta, 2016, 445(24): 62-69.
[2] 李添, 周立新, 李娟.杂环反铂(Ⅱ)抗癌药物水解反应机理的DFT研究 [J].化学研究, 2012, 23(5): 44-51.
[3] OHNDORF V M, ROULD M A, QING H E, et al.Basis for recognition of cisplatin-modified DNA by high-mobility-group proteins [J].Nature, 1999, 399(6737): 708-712.
[4] KLEIN A V, HAMBLEY T W.Platinum drug distribution in cancer cells and tumors [J].Chem Rev, 2009, 109(10): 4911-4920.
[5] GHOSH I, NAU W M.The strategic use of supramolecular pKa shifts to enhance the bioavailability of drugs [J].Adv Drug Delivery Rev, 2012, 64(9): 764-783.
[6] TODD R C, LIPPARD S J.Inhibition of transcription by platinum antitumor compounds [J].Metallomics, 2009, 1(4): 280-291.
[7] FEAZELL R P, NAKAYAMA-RATCHFORD N, DAI H, et al.Soluble single-walled carbon nanotubes as longboat delivery systems for platinum(IV) anticancer drug design [J].J Am Chem Soc, 2007, 129(27): 8438-8439.
[8] EL KAZZOULI S, EL BRAHMI N, MIGNANI S, et al.From metallodrugs to metallodendrimers for nanotherapy in oncology: a concise overview [J].Curr Med Chem, 2012, 19(29): 4995-5010.
[9] ALSALME A, LAEEQ S, DWIVEDI S, et al.Synthesis, characterization ofα-amino acid Schiff base derived Ru/Pt complexes: Induces cytotoxicity in HepG2 cell via protein binding and ROS generation [J].Spectrochim Acta A, 2016, 163: 1-7.
[10] JAMIESON E R, LIPPARD S J.Structure, recognition, and processing of cisplatin-DNA adducts [J].Chem Rev, 1999, 99(9): 2467-2498.
[11] OREGO L, MEIRELES M, KASPER C, et al.Group 11 complexes with amino acid derivatives: Synthesis and antitumoral studies [J].J Inorg Biochem, 2016, 156: 133-144.
[12] GILL M R, THOMAS J A.Ruthenium(II) polypyridyl complexes and DNA-from structural probes to cellular imaging and therapeutics [J].Chem Soc Rev, 2012, 41(8): 3179-3192.
[13] ZHANG J C, LI L W, MA L L, et al.Synthesis, characterization and cytotoxicity of mixed-ligand complexes of palladium(II) with 2, 2′-biquinoline/1, 4-diaminobutane and 4-toluenesulfonyl-L-amino acid dianion [J].Eur J Med Chem, 2011, 45(11): 5711-5716.
[14] HU M Y, SHEN Y R, ZHANG L, et al.Polymersomes via self-assembly of amphiphilicβ-cyclodextrin-centered triarm star polymers for enhanced oral bioavailability of water-soluble chemotherapeutics [J].Biomacromolecules, 2016, 17(3): 1026-1039.
[15] BREWSTER M E, LOFTSSON T.Cyclodextrins as pharmaceutical solubilizers [J].Adv Drug Deliv Rev, 2007, 59(7): 645-666.
[16] 张稳, 赵永德.环糊精醛及其衍生物的合成与性能研究进展 [J].化学研究, 2007, 18(2): 98-102.
[17] WANG H Z, CHANG C H, LIN C P, et al.Using MTT viability assay to test the cytotoxicity of antibiotics and steroid to cultured porcine corneal endothelial cells [J].J Ocul Pharmacol Ther, 1996, 12(1): 35-43.
[责任编辑:刘红玲]
Synthesis and bioactivity of the water-solubleL-cysteine-β-cyclodextrin platinum complexes
ZHAO Meixia*, YAO Wenjing, ZHU Bingjie, CHEN Difeng, ZHANG Yahong
(KeyLaboratoryofNaturalMedicineandImmuneEngineeringofHenanProvince,HenanUniversity,Kaifeng475004,HenanChina)
We synthesized a water-solubleL-cysteine-β-cyclodextrin platinum complex (Pt(L-Cys-β-CD)Cl2), and the platinum complex was obtained by the reaction of the ligandL-cysteine-modifiedβ-cyclodextrin with K2PtCl4.The Pt(L-Cys-β-CD)Cl2complex has been characterized using ESI-MS, elemental analysis and1H NMR.The antitumor activity of Pt(L-Cys-β-CD)Cl2complex has been studied by MTT assay.The in vitro cytotoxicity of the platinum complex was evaluated in K562, HepG2 and 7701 cells and higher cell inhibition ratio was observed.Interestingly, the Pt(L-Cys-β-CD)Cl2complex was less toxic on the normal 7701 cells than other two types of cancer cells.So the type of Pt complexes could be used as potential antitumor drug.
L-cysteine;β-cyclodextrin; platinum complex; bioactivity; antitumor drug
2016-07-22.
国家自然科学基金(U1204201, 221501044), 河南省高等学校重点科研项目(13A150063, 16A150004), 河南省科技发展计划项目-基础与前沿技术研究(132300410228),河南省青年骨干教师项目(2015).
赵美霞(1977-), 女, 副教授, 研究方向为生物无机化学.*
R969.1
A
1008-1011(2016)06-0711-03

