超声波-Fenton试剂协同降解亚甲基蓝废水研究*
张 锋
(宝鸡文理学院化学化工学院,陕西省植物化学重点实验室,陕西宝鸡 721013)
超声波-Fenton试剂协同降解亚甲基蓝废水研究*
张 锋
(宝鸡文理学院化学化工学院,陕西省植物化学重点实验室,陕西宝鸡 721013)
研究了超声波法-Fenton试剂氧化联合使用对亚甲基蓝染料废水的降解。采用控制变量法,用亚甲基蓝溶液模拟染料废水,对降解过程中H2O2用量、Fe2+的用量、最适pH值、最佳反应时间进行研究。结果用Origin软件进行数据处理,对其进行分析讨论。实验结果表明,对于5mL浓度为100mg/L的亚甲基蓝溶液,在H2O2(30%)0.45mL,20mmol/L硫酸亚铁铵0.25mL,pH=3体系下,超声波处理60min,亚甲基蓝的降解率为96.2%,比Fenton试剂单独处理节省约1倍时间。说明超声波-Fenton氧化法具有一定协同作用。
染料废水,Fenton试剂,超声波,降解
纺织印染行业在我国工业经济发展中占有很大比重,与此同此,工业生产中所排放的废水总量中有大约35%来自印染废水。这类废水色度大、有机含量高、处理难度大,因此,相关处理技术的研究很早就受到研究人员的广泛关注[1-2]。化学氧化法是去除水体有机污染的有效技术手段。基于OH·氧化的Fenton技术反应氧化能力强、条件温和、无次生污染物,获得了广大研究者的关注[3-4]。但在实际应用过程中,也发现该反应存在部分缺陷。例如对体系pH值要求苛刻,随着pH值升高,氧化效率急剧下降[5];反应过程中Fe(Ⅲ)易水解形成铁泥,后处理困难[6];H2O2利用率低,处理成本高等问题[7]。
针对这些问题,研究人员采取多种改进措施,例如通过将臭氧、氧气和紫外光等引入Fenton试剂中,增强其氧化能力,也能节约H2O2的用量。但是一般臭氧均通过无声放电法臭氧发生器产生,实际产生效率较低。而氧气在水中溶解度不大也限制了该方法的进一步推广使用。紫外光则受限于整体催化效率低,不能直接利用廉价自然光源太阳光。
利用超声法对水系中有机污染物进行降解具备操作条件简单,适用范围广,降解处理污染水体已有大量相关报道。降解污染物类型包括多环芳烃、氯酚、有机染料等多种有机物,均取得了良好的降解效果[8-10]。但单独超声降解存在能量利用率低,处理容量小,费用高等问题[11]。因此,微波、超声波等能量耦合不同类型水处理技术的新型处理工艺显示出一定技术优势,有必要对其进行深入研究,进而拓展有机废水处理技术基础研究与工程应用。
因此,本文以亚甲基蓝模拟染料废水,在Fenton-超声波辐照协同条件下对其进行了降解实验。对反应的最佳条件进行了相关研究,并比较了协同处理方法与Fenton或超声波单独处理工艺的降解效率,从而为研究高效降解工业染料废水处理工艺提供一定理论与实验数据支持。
1 材料与方法
1.1 试剂与仪器
亚甲基蓝、硫酸亚铁铵、30%过氧化氢溶液等试剂均购于国药集团化学试剂有限公司,使用前未做进一步纯化。
Cary-50型紫外可见分光光度计,Varian公司;791 型磁力搅拌器,中西远大科技有限公司;TGL-16C型台式离心机,上海安亭科学仪器厂;XH-300B型电脑微波超声波组合合成/萃取仪,北京祥鹄科技发展有限公司。
1.2 实验方法
1.2.1 亚甲基蓝标准曲线绘制
取5个50mL的容量瓶,用去离子水准确配制5mg/L、10mg/L、15mg/L、20mg/L、25mg/L、30mg/L、35mg/L亚甲基蓝溶液。摇匀,贴上标签,用紫外分光光度计测定664nm处的吸光度。以亚甲基蓝溶液浓度为横坐标,吸收值为纵坐标,绘制标准曲线。
1.2.2 Fenton法降解亚甲基蓝条件优化
(1)最佳H2O2用量确定
取7只试管分别依次加入5mL 100mg/L亚甲基蓝溶液、0.3mL 20mmol/L的硫酸亚铁铵溶液,再加入0.2mL、0.3mL、0.35mL、0.4mL、0.45mL、0.5mL、0.55mL的30%的H2O2静置待其充分反应。随后将试管放入离心机(6000r/min)离心5min,分别移取对应试管中上清液。稀释3倍后在紫外分光光度计测定664nm处的吸光度,并根据1.2.1标准曲线计算反应后对应浓度。
(2)Fe2+的用量确定
在上步实验确定的最佳最佳H2O2用量基础上,取7只试管分别加入0.1mL、0.15mL、0.2mL、0.25mL、0.3mL、0.35mL、0.4mL 20mmol/L的硫酸亚铁铵溶液,其余物质浓度及反应测试条件均保持不变,计算反应后浓度。
(3)最适pH值的确定
在反应体系其余物质浓度不变基础上,加入稀硫酸或氢氧化钠溶液,调节体系pH值依次为2、3、4、5、6、7、8,测定不同pH值下反应后溶液中亚甲基蓝浓度。
(4)最佳反应时间确定
取多只试管分别依次加入5mL 100mg/L亚甲基蓝溶液,0.25mL 20mmol/L的硫酸亚铁铵溶液,再加入0.45mL 30%的H2O2溶液,调节体系pH为3,每隔20min测一次反应离心后所对应上清液的吸光度,直至其基本不变为止。
1.2.3 超声波-Fenton协同处理效果影响
将1.2.2实验体系放大10倍,在100mL烧杯分别加入50mL 100mg/L亚甲基蓝溶液、2.5mL 20mmol/L的硫酸亚铁铵溶液、4.5mL 30%的H2O2,加入硫酸调节体系pH值为3。开启超声波,功率400W,分别在20min、40min、60min、80min、100min、120min、140min取上层清液测664nm处的吸光度。换算成相应浓度并与超声波、Fenton单独处理进行比较。
2 结果与讨论
2. 1 亚甲基蓝溶液标准曲线
图1为亚甲基蓝溶液的标准曲线,随着溶液浓度增加,664nm处吸光度值呈线性增加,R2值为0.9987,表明线性程度良好,可在相同体系条件下,测定未知浓度的亚甲基蓝水溶液的吸光度,并根据标准曲线计算出待测亚甲基蓝水溶液的浓度。
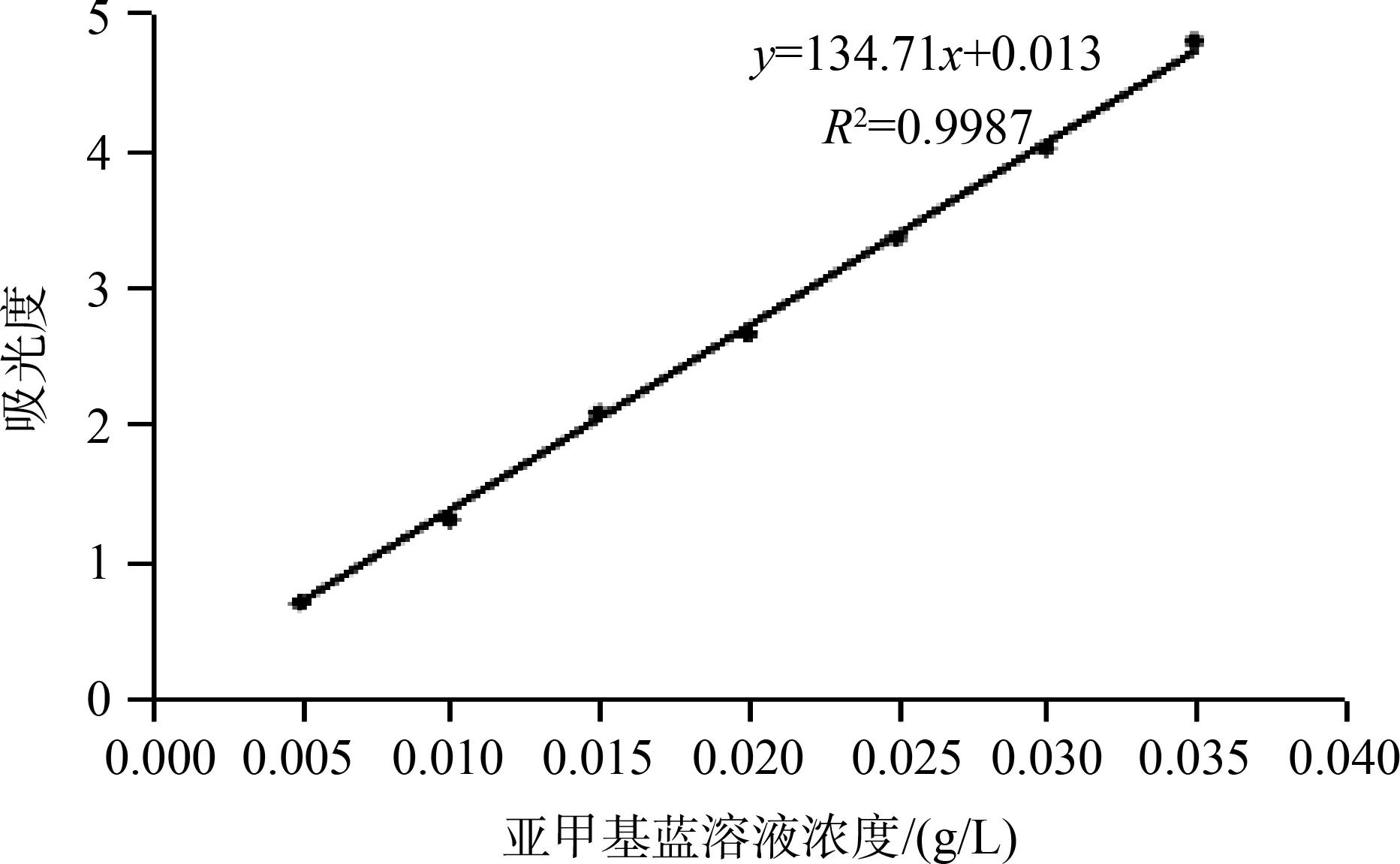
图1 亚甲基蓝标准曲线
2.2 反应H2O2的最佳用量
图2为随H2O2加入量增加亚甲基蓝溶液浓度变化趋势图。在相同实验条件下,当H2O2加入量从0.2mL增加到0.45mL时,亚甲基蓝浓度下降非常明显,但继续增加H2O2浓度时,反应后溶液的吸光度反而增大,该实验结果与两方面因素有关:一方面Fenton试剂主要依靠二价铁离子催化H2O2分解产生·OH,借助其强氧化性对有机染料分子进行氧化。但文献指出Fenton体系中H2O2浓度超过一定限度之后,其对·OH的捕捉作用随之加强,将·OH转化为氧化能力较弱的H2O·,从而使得体系降解效率下降[12-13]。另外也与体系H2O2浓度过高之后导致亚铁离子被氧化成颜色更深的三价铁离子,干扰溶液吸光度值,导致其变大有关。丁真真[14]以Fenton试剂对苯酚及橡胶工业废水氧化降解时也得到类似实验结果,证明Fenton体系针对不同类型的有机污染物均有与其对应的最佳H2O2用量。
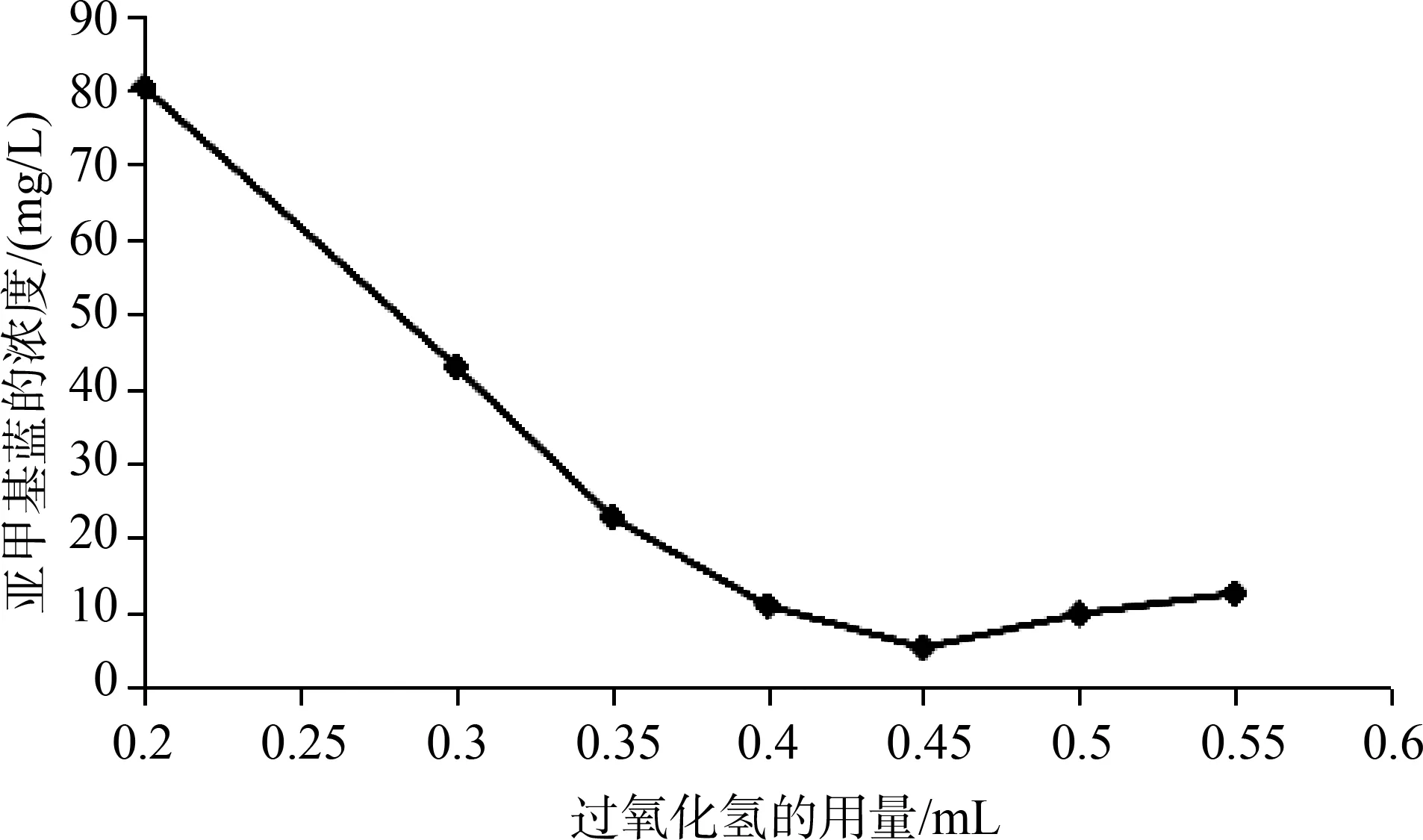
图2 过氧化氢的用量对Fenton降解的影响
2.3 反应硫酸亚铁铵溶液的最佳用量
硫酸亚铁铵浓度对降解反应的影响见图3。当硫酸亚铁铵溶液加入量小于0.25mL时,亚甲基蓝溶液降解效果随硫酸亚铁铵加入量增大而增强,此时体系二价铁离子越多越有利于反应·OH生成从而使Fenton试剂的氧化能力增强。而当硫酸亚铁铵溶液加入量大于0.25mL后,降解效果略有下降,因为二价铁离子不稳定,所以过量二价铁离子容易被水和空气中的氧气所氧化,变成颜色更深的三价铁离子,使溶液吸光度变大,带来实验偏差,同时也不利于后续样品的处理。

图3 硫酸亚铁铵用量对Fenton降解的影响
2.4 最佳pH值确定
pH值对反应的影响如图4所示。当pH值在2~3范围时,亚甲基蓝溶液浓度随pH值增加而减小,但pH值大于3时随pH值增加而增大。因为Fenton反应以链反应方式产生羟基自由基,进而对有机物进行降解。体系最佳反应pH值为3。此时[Mn(salen)]2-Fenton体系中Fenton反应占主导作用。而随着pH值逐渐增加,对照组的氧化降解效率迅速下降,这是由于酸性条件下,生成的羟基自由基数量多,氧化能力强,对苯酚降解效果好。根据Fenton反应原理,在pH值较大时,体系中被氧化的Fe3+水解程度增加,形成的Fe(OH)3沉淀难于参与链反应重新转变为Fe2+,造成整个体系内有效铁离子浓度降低,催化效率降低[15]。
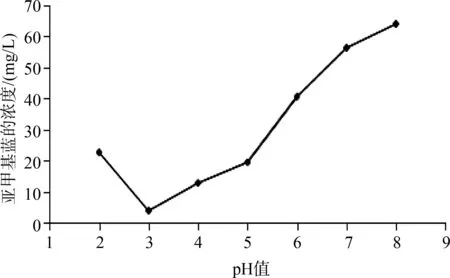
图4 pH值对Fenton降解的影响
2.5 最佳反应时间确定
不同时间下反应体系亚甲基蓝溶液浓度变化如图5所示。

图5 反应时间与亚甲基蓝降解的关系
随着反应时间延长,亚甲基蓝溶液的浓度越来越小,120min基本无残留。继续放置20min时浓度略有增加。因为此时染料分子均以沉淀形式被分离,所以造成此时浓度增加的原因应该归属于反应结束后,体系内被还原的亚铁离子逐渐被氧化成三价铁离子导致吸光度增大而对实验结果造成的影响。因此对于氧化处理之后的染料溶液应当进行进一步后处理,除掉其中所含的杂质铁离子,否则会影响出水色度,也会对试验结果造成一定程度干扰。
2.6 超声波-Fenton试剂协同处理的反应进程对比
超声波-Fenton试剂协同处理与超声波或Fenton试剂单独使用时对比结果如图6所示。
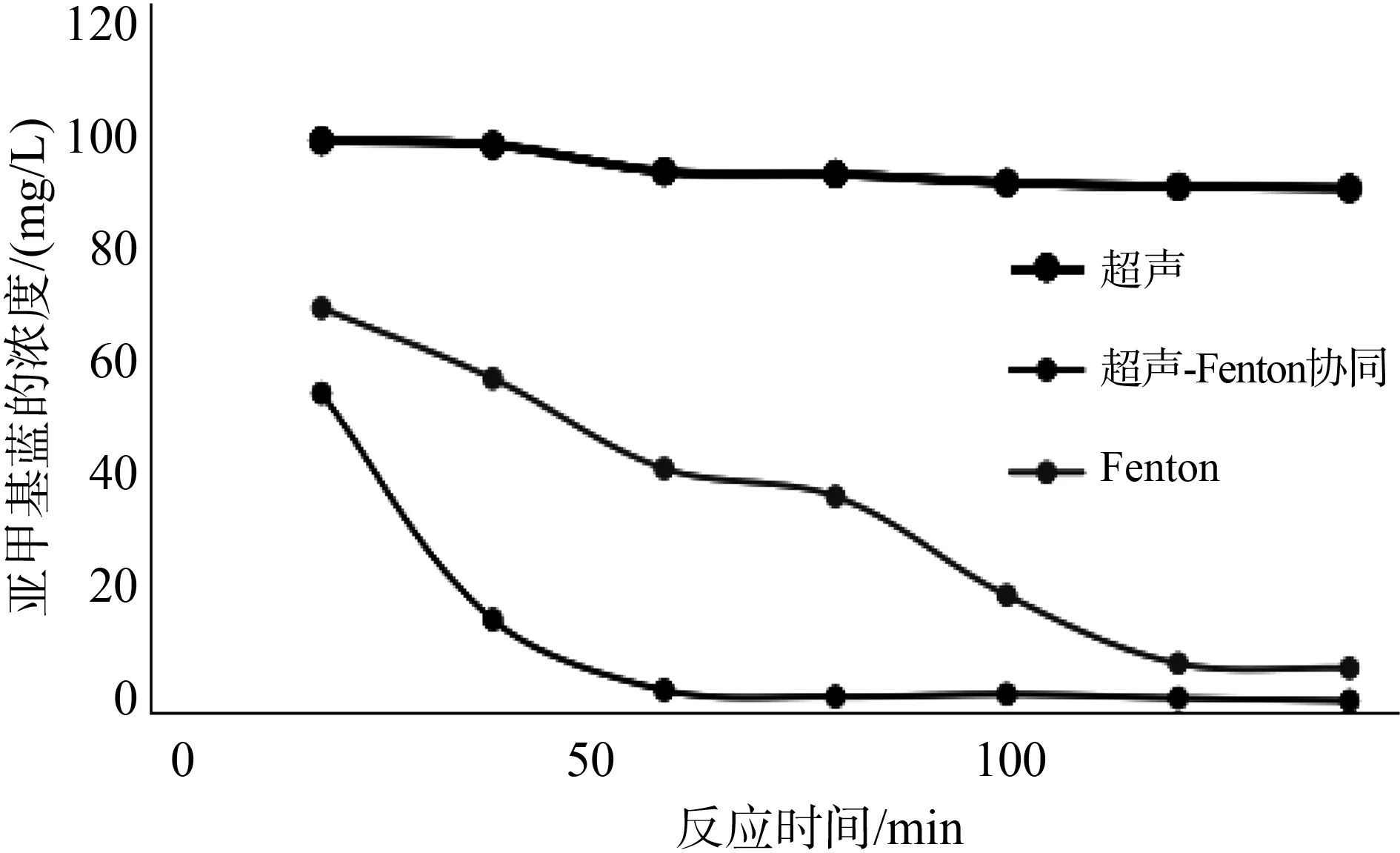
图6 Fenton试剂-超声波协同处理亚甲基蓝
只用超声波时,随着反应时间延长,亚甲基蓝的浓度仅略有下降,因为超声波主要通过高温热解、自由基氧化、超临界水氧化等方式共同实现染料分子的降解[16]。这些方式均基于直接氧化进行,但是处理时间较长,降解过程中能量耗量较多,造成处理成本增高。吴志林[17]等人利用微波-超声波协同降解苯酚时也提出了相应问题。因此,必须与其他处理手段协同进行,方能提高效率。只用Fenton试剂时,在0~120min内亚甲基蓝溶液浓度不断下降,在120min时达到最低,整体降解效果较好。当Fenton试剂协同超声波处理时,在0~60min内亚甲基蓝溶液浓度不断下降,在60min时达到最低,且降解效果优于Fenton试剂单独使用。这说明联合处理具有加快反应进程、提升反应速度的效果。因为Fenton试剂和超声波处理均能产生强氧化能力的·OH,两者协同处理能够提升对亚甲基蓝的降解效率。
3 结论
(1)Fenton试剂降解亚甲基蓝时,实验结果与H2O2用量、硫酸亚铁铵用量、pH值、反应时间多种因素有关。单因素实验法表明最佳反应条件为5mL 100mg/L的亚甲基蓝溶液中加入0.45mL 30% H2O2、0.25mL 20mmol/L硫酸亚铁铵,pH值为3。
(2)Fenton试剂-超声波协同处理染料废水优于两者单独使用。在最佳条件下,超声波单独处理染料分子降解率不超过10%,Fenton试剂处理能够达到92%以上,但耗时较长。而Fenton联合超声波处理60min后,亚甲基蓝的降解率即可达到96.2%。证明两者具有一定协同效应,从而提高了降解效果。
[1] Marco S L,Albino A,Ana S,et al. Degradation of a textile reaetive Azo dye by a combined ehemical-biological Proeess:Fenton’s reagen-yeast[J]. Water Researeh,2007,41(5):1103-1109.
[2] 徐向荣,王文华,等.Fenton试剂与染料溶液的反应[J].环境科学,1999,20(3):72-74.
[3] 张德莉,黄应平,罗光富,等. Fenton 及 Photo-Fenton 反应研究进展[J].环境化学,2006,25(2):121-127.
[4] 陈胜兵,何少华,娄金生,等. Fenton 试剂的氧化作用机理及其应用[J]. 环境科学与技术,2004,27(3):105-107.
[5] Gallard H,delaat J,Legube B. Effect of pH on the Oxidation Rate of Organic compounds by FeII/H2O2. Mechanisms and simulation[J]. New Journal of Chemistry,1998,22(3):263-268.
[6] 庞素艳. 铁锰催化 H2O2、KHSO5、KMnO4氧化降解酚类化合物的效能与机理研究[D].哈尔滨:哈尔滨工业大学,2011:5-12.
[7] Martins R C,Henriquess L R,Quinta-Ferreira R M. Catalytic activity of low cost materials for pollutants abatement by Fenton process [J]. Chemical Engineering Science,2013,100:225-233.
[8] Silva M R A,Trovo A G,Nogueira R F P. Degradation of the herbicide tebuthiuron using solar photo-Fenton process and ferric citrate complex at circumneutral pH [J]. Journal of Photochemistry and Photobiology a-Chemistry,2007,191(2-3):187-192.
[9] Bai C P,Xiao W S,Feng D X. Efficient Decolorization of Malachite Green in the Fenton Reaction Catalyzed by [Fe(Ⅲ)-salen]Cl Complex[J]. Chemical Engineering Journal,2013,215:227-234.
[10] Carolyn E,Burrow T J,Burchell,et al. Salen-Based [Zn2Ln3] Complexes with Fluorescence and Single-Molecule-Magnet Properties[J]. Inorganic Chemistry,2009,48(17):8051-8053.
[11] Scott E Denmark,John R,et al. Strategies for Hydrogen Storage in Metal-Organic Frameworks[J]. Angewandte Chemie International Edition,2005,44(30):4670-4679.
[12] Rigg T,Taylor W,Weiss J. The rate constant of the reaction between hydrogen peroxide and ferrous ions [J]. Journal of Chemical Physics,1954,22(4):575-577.
[13] Buxton G V,Greenstock C L,Heiman W P,et al. Critical-review of rate constants for reactions of hydrated electrons,hydrogen-atoms and hydroxy 1 radicals in aqueous-solution [J]. Journal of Physical and Chemical Reference Data,1988,17(2):513-886.
[14] 丁真真. Fenton试剂氧化苯酚废水和橡胶工业废水的研究[M].甘肃:西北师范大学,2007:27-38.
[15] 白翠萍.类Fenton高级氧化技术处理染料废水的研究[D].湖北:武汉理工大学,2012.
[16] Ince N H,Tezcanli G,Belen R K,et al. Ultrasound as a catalyzer of aqueous reaction systems:the state of the art and environmental application[J].Appl Cat B:Environ,2001,29(3):167-176.
[17] Wu Z L,Berndond R,Gianc A.Degradation of phenol under combined irradiation of microwaves and ultrasound[J].J Environ Sci Technol,2008,42 (6):8083-8087.
Study on Degradation of Methylene Blue Wastewater by Ultrasonic Synergistic Fenton Reagent
ZHANG Feng
(Dept. of Chemistry and Chemical Engineering,Baoji University of Arts and Science,Shaanxi Key Laboratory of Phytochemistry,Baoji 721013,Shaanxi,China)
The degradation of methylene blue dye wastewater by Fenton reagent oxidation combined with ultrasonic method was studied. The control variables method was used to study the influence of H2O2,Fe2+amounts,the optimum pH value,and best reaction time during degradation process.The results were statistically analyzed by Origin software to discuss and give quantitative evaluation result.The results showed that the degradation rate to 5mL 100mg/L methylene blue solution was 96.2% in following system conditions:H2O2(30%) 0.45mL,20mmol/L ammonium ferrous sulfate 0.25mL,pH=3,ultrasonic treatment for 60min. It spend much less 1 hour than Fenton reagent treated it separately,indicating the ultrasonic-Fenton oxidation method has a certain synergistic effect.
dye wastewater,Fenton reagent,ultrasound,degradation
X 703.1

