冻存脐带间充质干细胞的临床前制备
何 洁,赵 晶,王金祥,蔡学敏,庞荣清,潘兴华
冻存脐带间充质干细胞的临床前制备
何 洁,赵 晶,王金祥,蔡学敏,庞荣清,潘兴华
目的将冻存的人脐带间充质干细胞(UC-MSCs)制备成一种复苏后可直接用于临床的制剂,并进行质量检定。方法从种子细胞库复苏冻存的UC-MSCs,待细胞培养至P3代时,收集UC-MSCs,按照4×107/剂的规格加入含5%人血白蛋白、10%DMSO、85%复方电解质溶液的细胞保护液,形成制剂,并对其进行质量检定,包括无菌检测、支原体检测、细胞内外源致病因子检测、内毒素检测、免疫表型检测、稳定性检测、异常免疫学反应检测以及残留物检测。结果制备的UC-MSCs制剂无菌、无支原体污染,无内外致病因子,毒素<2 EU,能抑制异源淋巴细胞的增殖,抑制率随脐带间充质干细胞数量增加而增大。牛血清残留<50 ng/袋,制剂冻存前细胞活性>90%,复苏后活性>85%。结论按照此方法制备的UC-MSCs制剂符合临床治疗要求的质量检定标准。
脐带;间充质干细胞;制剂;制备;质量检定
脐带来源的间充质干细胞 (umbilical cord mesenchymal stem cells,UC-MSCs)因具有来源广泛、采集方便、不受供体年龄限制以及可以大规模制备等优点[1],而成为间充质干细胞研究的热点,可以用于治疗脊髓损伤、脑缺血、移植物抗宿主病以及自身免疫性疾病等的治疗[2-4]。随着干细胞的广泛应用,为了适应临床需要,各种干细胞产品相继被开发,作为一种新型的生物制剂。因为hUC-MSCs具有活细胞属性,从分离培养到鉴定最终形成制剂的每一个环节都有可能会影响其质量,也直接决定着后续临床治疗的安全性和有效性。目前,已经有较多关于hUC-MSCs制备以及治疗方面的研究报告,但尚未建立制剂制备、检定的技术规范以及质量控制标准。所以需对hUC-MSCs制剂的制备进行标准化研究和质量检定。本课题在前期已经建立了一套标准化的UC-MSCs制备鉴定技术,并在此基础上形成标准化的hUC-MSCs细胞库,本研究旨在如何将冻存的UC-MSCs制备成一种复苏后可直接用于临床的制剂,为临床应用提供基础。
1 材料与方法
1.1 主要试剂和设备 UC-MSCs来源于本中心干细胞库;DMEM/F12培养液(Hyclone公司),胎牛血清(FBS)和0.25%trypsin-EDTA(BI公司);复方电解质溶液(勃脉力A,上海百特医疗用品);人血白蛋白(广东卫伦生物制药有限公司);DMSO(Bioniche Pharman,USA LLC公司);低分子肝素钙(葛兰素史克有限);鲎试剂及检查用水(湛江安度斯生物有限公司);内毒素工作标准品(中国食品药品检定研究院);HBV、HCV、HIV、CMV、EBV、MP、TP荧光定量PCR试剂盒(中山大学达安基因股份有限公司);猪细小病毒检测试剂盒(西班牙Ingenasa公司);定量检测牛血清白蛋白(BSA)试剂盒(Cygnus);MTS检测试剂盒(Promega公司)。
1.2 种子细胞的复苏 从液氮罐中取出hUCMSCs冻存管,核对好批号后,迅速置于37℃水浴中,期间不断晃动,使管中的细胞悬液迅速融化,待细胞悬液完全融化后,在超净工作台内加入10倍体积以上的生理盐水低速离心,除去上清后再重复用培养液洗一次。胎盼蓝染色检测细胞活性、计数。之后接种培养瓶,放入5%CO2、37℃的培养箱中静置培养。
1.3 hUC-MSCs制剂的制备 取第3代细胞(P3)计数,采用台盼蓝拒染法进行细胞活性测定。当活性大于90%时,按照4×107/剂的规格,加入含有5%人血白蛋白、10%的DMSO的勃脉力A 20 ml,充分混匀后缓慢装入冻存袋中,待细胞完全装入袋后,轻轻挤压冻存袋排除多余气体,然后密封,贴好标签,注明生产批号、生产日期、规格。把密封好的袋装制剂放入程序降温盒中,置于-70℃冰箱,24 h后移入液氮中保存备用。临床拟使用剂量为:1×106个/kg。临床使用时,把冻存袋从液氮取出迅速置于37℃水浴中,期间不断晃动冻存袋,使其中的细胞悬液快速融化。待细胞悬液完全融化后,仔细核对袋上标签注明的批号、姓名、数量,确认后用勃脉力A进行五倍稀释,并根据1050 IU/(4×107)个细胞添加低分子肝素钙,低温保存备用。
1.4 hUC-MSCs的质量检定
1.4.1 无菌检测 采用全自动微生物培养法,取适量制剂悬液加入需氧培养瓶和厌氧培养瓶中,置于全自动微生物培养检测系统,37℃培养。
1.4.2 病原体检测 采用定量PCR法检测支原体;采用Q-PCR法检测人源特定病毒(HIV、HBV、HCV、EBV、CMV);采用ELISA法检测猪细小病毒;依据 《中华人民共和国药典》2010年版三部附录ⅫB细菌内毒素检查法检测内毒素。
1.4.3 牛血清残留量检测 使用定量检测牛血清白蛋白(BSA)酶联免疫试剂盒,对制剂的牛血清残留量进行检测。每次检测同时进行试验有效性确认。判定标准为每个制剂中牛血清残留量≤50 ng。
1.4.4 异常免疫学反应检测 制剂按照1×104个/ml hUC-MSCs接种于6孔板中,2 h贴壁后,按照hUCMSCs∶外周血T淋巴细胞(PBLCs)为1∶1、1∶5、1∶10、1∶20的比例加入PBLCs,在PHA刺激的作用下,培养72 h后,MTS一步法检测UC-MSCs对CD3+T淋巴细胞增殖抑制作用。
1.4.5 稳定性检测 分别于制剂冻存后的2 w、1个月、3个月、6个月后,分别复苏同一批号的细胞,计数存活细胞数量,胎盼蓝染色后检测其活性。
2 结果
2.1 复苏后hUC-MSCs的形态观察 复苏后的hUC-MSCs,倒置相差显微镜下观察呈圆形透亮的单个细胞,培养2 h逐渐贴壁;3~4 d换液1次,待细胞均匀分布生长至80%~90%融合时,可见大量成纤维样细胞呈漩涡状、网状、辐射状生长(图1)。
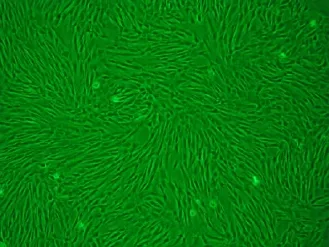
图1 倒置相差显微镜下hUC-MSCs(P3)形态
2.2 hUC-MSCs制剂的制备 hUC-MSCs制剂是一种复苏后直接用于临床治疗的细胞制剂,所以需对制剂制备过程进行原始记录并存档(图2)。规格:4×107/20 ml/袋;性状:微黄色细胞混悬液;包装:冻存袋;保存方式:液氮保存。

图2 hUC-MSCs制剂
2.3 hUC-MSCs制剂质量检定结果 从表1可见,各检测项目全部合格。
2.4 hUC-MSCs制剂的异常免疫学反应 从图3可见,hUC-MSCs制剂对人T淋巴细胞增殖具有抑制作用,且抑制作用随着hUC-MSCs数量的增加而增大。
2.5 hUC-MSCs制剂的稳定性 从表2可见,hUC-MSCs制剂保存2 w~6个月,hUC-MSCs制剂中的细胞数量和活性没有显著变化。

图3 PHA刺激后hUC-MSCs对CD3+T淋巴细胞增殖抑制作用
3 讨论
基于干细胞广泛的应用前景,为适应临床使用的需要,各种干细胞制品制剂不断被开发而推向市场,干细胞制剂越来越多的应用于细胞治疗的领域。目前为止,国际上已有多款的相关干细胞产品上市并批准进入临床[5],这些都标志着干细胞从实验室技术向着药物的方向发展。在我国,干细胞临床研究已是如火如荼,但由于细胞来源和各实验室制备条件的差异,对干细胞制剂的质量还缺乏系统性的评价和规范性的要求。2015年8月,国家卫计委和国家食品药品监督管理局联合发布了《干细胞制剂质量控制及临床前研究指导原则 (试行)》,目的就是要规范干细胞制剂的临床前研究、确保干细胞制剂的质量可控性以及治疗的安全性和有效性。本研究制备的临床级hUC-MSCs制剂,是将一定浓度的干细胞悬液与细胞冻存保护液按比例混合制备后,分装于适宜冷冻的冻存袋,放于液氮中保存,复苏后可直接用于临床的制剂。作为一种不同于传统药物制剂的全新药物制剂形式,因为其具有活细胞属性,所以有非常强的特殊性,更需要通过全面的质量检测和控制。
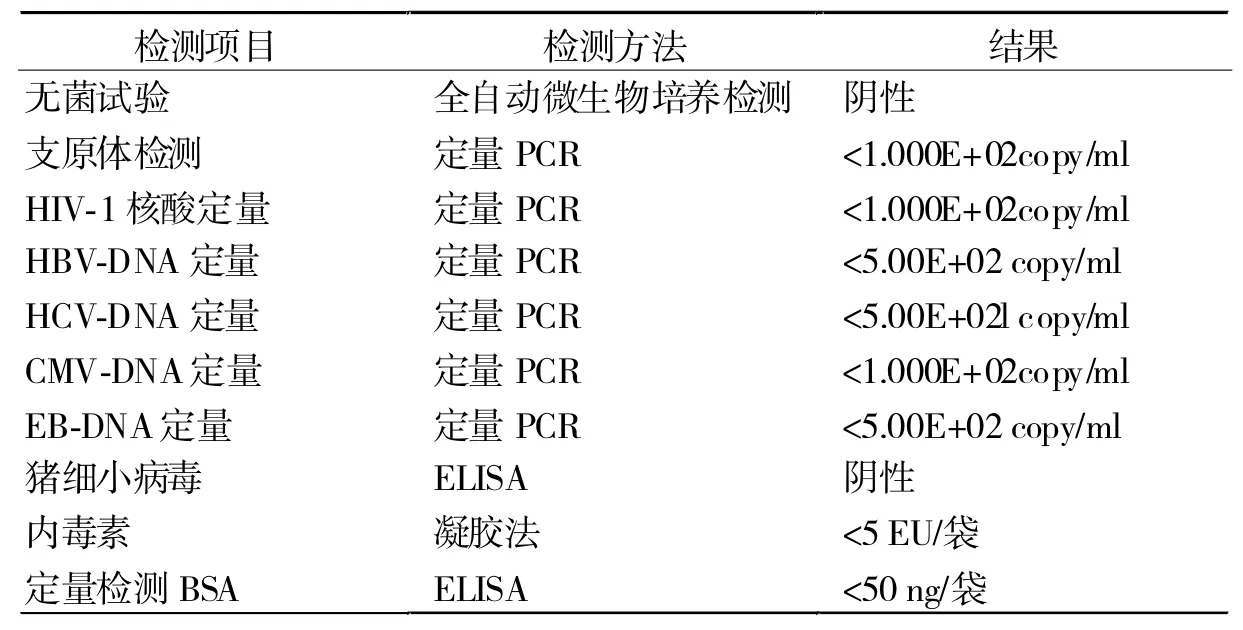
表1 hUC-MSCs制剂质量检定结果

表2 hUC-MSCs制剂质量稳定性结果
在干细胞制剂的临床应用中,最基本的要求就是确保制剂的无菌、无内毒素、无内外源致病因子。在本研究中,细菌和内毒素检测参照了2010版药典规定的方法检测,方法简易又经济,有可操作性和实用性。在对内外源致病因子的检测中,除了猪细小病毒,均采用了定量PCR的方法,从基因水平对病毒进行检测,确保安全。但由于有些病毒存在窗口期的问题,所以关键措施还是需要完善供者信息以便之后随访,排除病毒处在窗口期漏检的因素。
近几年来,免疫调节成为间充质干细胞最受关注的原因之一,因为其免疫原性低且本身具有免疫调节功能,可以抑制T、B淋巴细胞、树突状细胞和巨噬细胞的成熟和功能[6-8],因此,不论是自体还是同种异体的MSCs,用于治疗一般都不会引起宿主的免疫反应,本研究应用MTT法检测了异体来源的UC-MSCs对于人T淋巴细胞的抑制作用,对于监测UC-MSCs免疫调节功能提供了简便可行的检测方法,保证了临床使用的有效性。
干细胞制剂最突出的特点就是有效性成分是活细胞,能发挥生物学效应的前提是具有一定稳定性,因此,长期在液氮保存,其活性需要长期的监测。本研究对制备的脐带间充质干细胞制剂的活性在冻存后2 w~6个月复苏后检测其活性,均不低于90%。
此外,牛血清是培养过程中培养基的添加物,根据《指导原则》在制剂制备过程中坚持少加甚至不加的原则,尽可能少引入异源的病毒和致敏源,因此,对牛血清的残留需控制在一定范围内来确保制剂的安全性。
[1] Wang L,Tran I,Seshareddy K,et al.A comparison of human bone marrow-derived mesenchymal stem cells and human umbilical cord-derived mesenchymal stromal cells for cartilage tissue engineering[J].Tissue Eng Part A,2009,15(8):2259-2266.
[2] Chen Aiqing,Siow B,Blamire AM,et al.Transplantation of magnetically labeled mesenchymal stem cells in a model of perinatal brain injury[J].Stem Cell Res,2010,5(3):255-266.
[3] Ringden O,Le Blanc K.Mesenchymal stem cells for treatment of acute and chronic graft-versus-host disease,tissue toxicity and hemorrhages[J].Best Pract Res Clin Haematol,2011,24(1):65-72.
[4] MacDonald GI,Augello A,De Bari C.Role of mesenchymal stem cells in reestablishing immunologic tolerance in autoimmune rheumatic diseases[J].Arthritis Rheum,2011,63(9):2547-2557.
[5] Goldring CE,Duffy PA,Benvenisty N,et al.Assessing the safety of stem cell therapeutics[J].Cell Stem Cell,2011,8(6):618-628.
[6] Xu G,Zhang L,Ren G,et al.Immunosuppressive properties of cloned bone marrow mesenchymal stem cells[J].Cell Res,2007, 17(3):240-248.
[7] Vellasamy S, Sandrasaigaran P, Vidyadaran S, et al. Mesenchymalstem cells of human placenta and umbilical cord suppress T-cell proliferation at G0 phase of cell cycle[J].Cell Biol Int,2013,37(3):250-256.
[8] Cutler AJ,Limbani V,Girdlestone J,et al.Umbilical cord-derived mesenchymal stromal cells modulate monocyte function to suppress T cell proliferation[J].J Immunol,2010,185 (11):6617-6623.
Pre-clinical preparation of cryopreserved UC-MSCs
He Jie,Zhao Jing,Wang Jinxiang,Cai Xuemin,Pang Rongqing,Pan Xinghua Cell Biological Therapy Center,Kunming General Hospital of Chengdu Military Command,Kunming,Yunnan,650032,China;National Joint Engineering Laboratory of Stem Cells and Immune Cells and Biological Medicine Technology,Kunming,Yunnan,650032,China;Key Laboratory of Cell Therapy Technology and Translational Medicine of Yunnan Province,Kunming,Yunnan,650032,China;Yunnan Stem Cell Engineering Laboratory,Kunming, Yunnan,650032,China;Key Laboratory of Stem Cell and Regenerative Medicine of Kunming,Kunming,Yunnan,650032,China
[Abstract]Objective To prepare the cryopreserved umbilical cord mesenchymal stem cells(UC-MSCs)into a kind of preparation that can be directly clinically used upon the resuscitation and to test the quality.MethodsThe cryopreserved UC-MSCs from the seed cell bank were resuscitated and collected when cultivated to P3-generation.The cell protective fluid containing 5% human serum albumin (HSA),10%DMSO and 85%compound electrolyte solution with a specification of 4×107/agent was added to form the preparation,the quality of which was tested,including sterility test,mycoplasma detection,internal and external pathogenic factor detection,endotoxin detection,immune phenotype detection,stability detection,abnormal immune response detection and residue detection.ResultsThe UC-MSCs preparation thus prepared was sterile without mycoplasma contamination or internal and external pathogenic factors,with poison<2 EU.It could inhibit the proliferation of allogeneic lymphocytes,with the inhibition ratio increasing with the increase of the number of UC-MSCs.Bovine serum residue<50 ng/bag;the cell activity of the preparation before cryopreservation>90%;the cell activity after the resuscitation>85%.ConclusionThe UC-MSCs preparation thus prepared is up to the quality test standard for clinical treatment.
UC;MSC;preparation;quality test
R 318.1
A
1004-0188(2016)12-1365-05
10.3969/j.issn.1004-0188.2016.12.004
2016-07-04)
国家科技支撑计划项目(2014BI01B0);国家973计划项目(2012CB5181060);云南省科技计划重点项目(2013CA005)
650032昆明,成都军区昆明总医院细胞生物治疗中心,干细胞与免疫细胞生物医药技术国家地方联合工程实验室,云南省细胞治疗技术转化医学重点实验室,云南省干细胞工程实验室,昆明市干细胞与再生医学研究重点实验室
庞荣清,E-mail:pangrq2000@aliyun.com;潘兴华,E-mail:xinghuapan@aliyun.com

